宫颈HSIL患者初次锥切术后切缘阳性相关因素分析与补充手术必要性探讨
2022-07-02周冬梅林小翠赖贺生秀杰
周冬梅,林小翠,赖贺,生秀杰
宫颈癌是女性最常见的恶性肿瘤之一,尽管病因明确,可防可治,但防控形势依然严峻。全球癌症数据统计评估报告显示,2020年全球宫颈癌新发病例约60万,死亡病例约34万,约90%的宫颈癌病例发生在中低收入国家[1]。2020年11月,WHO正式启动“全球加速消除宫颈癌战略”,其中一项关键措施就是90%的确诊宫颈疾病患者得到治疗。近年来随着宫颈癌筛查逐渐普及,大量宫颈癌前病变得以诊治。2012年,宫颈癌前病变由既往传统三级分类法(CIN 1、2、3)被ASSCP提出的两级分类法代替,即低级别鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL)和高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)[2]。处理原则上,宫颈LSIL约90%可自然消退,无需治疗,随诊即可;而31%~50%宫颈HSIL患者可在30年内进展为浸润性宫颈癌,经常规治疗后,其癌变风险可降至0.7%[3],故应积极治疗。宫颈锥切术,包括宫颈冷刀锥切(cold-knife conization,CKC)和宫颈电环切除(loop electrosurgical excision procedure,LEEP)是治疗宫颈HSIL首选、有效的标准术式,但锥切术后标本仍有切缘阳性可能,影响切缘阳性风险因素有争议,而且锥切术后仍有病变残留复发风险,是否需要补充二次手术也有争议。本研究收集在广州医科大学附属第三医院就诊的宫颈HSIL患者,分析初次锥切术后切缘阳性的高危因素,并进一步分析初次锥切术后切缘阳性和切缘阴性患者个体化处理后疾病转归情况,以期为临床上子宫颈高级别上皮内瘤变的治疗及后续处理方式的选择提供参考。
1 资料与方法
1.1 一般资料
回顾性分析2014年1月至2018年12月在广州医科大学附属第三医院经宫颈锥切术后病理诊断为宫颈HSIL共501例患者的相关临床资料,包括年龄、绝经状态、宫颈转化区类型(阴道镜满意情况)、HPV16型感染、症状(接触性出血或不规则阴道流血)、术前阴道镜下宫颈活检病理结果、锥切方式、锥高、锥宽、宫颈腺体累及、病变累及点数、术后病理、术后个体化处理情况。
1.2 诊治流程
501例宫颈HSIL患者均按诊疗规范进行宫颈癌筛查及阴道镜检查,阴道镜检查病理活检提示宫颈HSIL,再按规范行宫颈锥切术(CKC或LEEP),术后常规送病理检查;78例宫颈HSIL初次锥切术后根据患者意愿(切缘阳性或合并其他妇科因素),半年内补充二次手术(锥切或全子宫±双附件切除术);113例宫颈HSIL初次锥切术后定期规范随访,行宫颈/阴道残端液基细胞学检查(thinprep cytologic test,TCT)、高危型HPV 检测(HR-HPV)及阴道镜检查。
1.3 观察指标
① 探讨锥切术后切缘阳性的相关危险因素;② 初次锥切术后切缘阳性和切缘阴性行再次补充手术的病变残留情况分析;③ 初次宫颈锥切术后切缘状态与术后病变复发的相关性。
1.4 病理学判定
所有组织病理均经两个以上高级职称病理科医生评估。宫颈锥切切缘阳性指宫颈锥切术后切缘可见病变或切缘与病变距离<1 mm[4-5]。根据2011年国际宫颈病理和阴道镜联合会(IFCPC)指南[6],锥高是指宫颈标本内侧边缘与外侧边缘之间的距离,锥宽是指锥底直径。并用宫颈锥切术后标本的病变累及点数来反映病变累及范围,如1~12点统计为12个点位数。残留指初次锥切术后6月内病理学证实的CIN 2或更严重的病变;复发指初次锥切术后6月内出现呈阴性的细胞学检查结果,6月后病理学证实的CIN 2或更严重的病变;宫颈癌分期按FIGO 2009年分期标准。
1.5 统计学处理
采用SPSS 21.0软件进行统计分析,所有统计检验为双侧检验。计数资料以例数(n)数和百分数(%)表示,采用χ2检验或Fisher 精确概率法进行组间比较。影响切缘阳性因素纳入Logistic多因素分析回归模型计算相关风险因素。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
501例患者年龄22~70岁,中位年龄39岁,初次锥切切缘阳性者116例,切缘阳性率23.15%。78例因切缘阳性或其他因素(子宫肌瘤、子宫腺肌病等)半年内补充二次手术(再次锥切19例和全子宫±双附件切除59例),患者年龄27~70岁,中位年龄 46岁,初次锥切术后病灶残留率为25.64%(20/78),其中癌1例,为IA1期(初次锥切切缘阳性),宫颈锥切术术后病理升级率为1.28%。113例初次锥切术后规范随访患者中,随访中位数时间为24月(范围:6~48个月),其中有7.08%(8/113)患者发现CIN 2+病变复发,随访过程中复发的时间为(10.0±2.7)月。8例复发患者中切缘阳性组6例,切缘阴性组2例。
2.2 宫颈HSIL首次锥切术后切缘阳性影响因素
2.2.1 单因素分析 分析显示年龄、LEEP锥切方式、锥高≤1.6 cm、宫颈腺体累及、病变累及点数和切缘阳性相关(P<0.05),而患者绝经状态、症状(接触性出血或不规则阴道流血)、宫颈转化区类型(阴道镜满意情况)、HPV16型感染、术前阴道镜下宫颈活检病理结果、锥切宽度与宫颈锥切术后切缘阳性无关(P≥0.05)。详见表1。

表1 单因素分析宫颈HSIL初次锥切术后切缘阳性的影响因素
2.2.2 多因素分析 对切缘阳性相关因素进一步行多因素Logistic回归分析显示LEEP手术方式、锥高≤1.6 cm、病变累及点数是宫颈锥切术后切缘阳性的高危因素。详见表2。
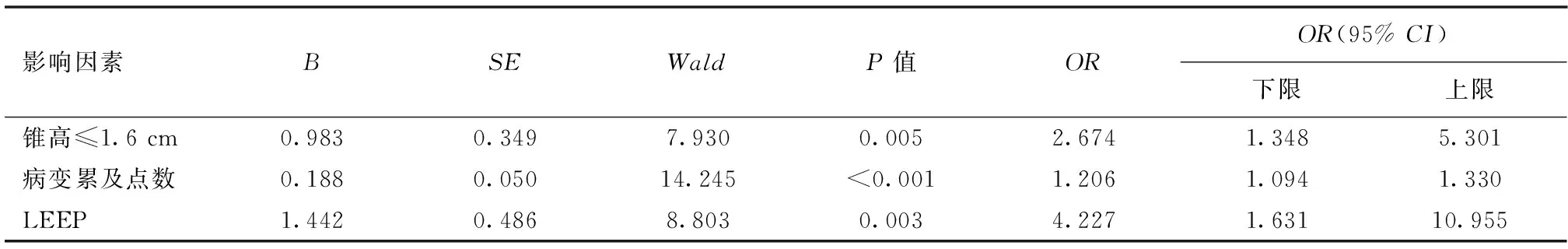
表2 宫颈HSIL锥切术后切缘阳性高危因素的多因素Logistic分析
2.3 宫颈HSIL首次锥切术后切缘状态与病灶残留关系
78例二次手术(包括再次锥切与全子宫±双附件切除术)患者中,按宫颈初次锥切术后切缘状态分为切缘阳性组(35例)和切缘阴性组(43例),两组病变残留率分别为40%、13.95%,差异有统计学意义(P<0.05)。详见表3。

表3 初次锥切术后切缘状态与术后病变残留率
2.4 宫颈HSIL锥切术后切缘状态与病变复发关系
113例(宫颈HSIL患者初次锥切后)规范随访患者中,按宫颈初次切缘状态分为切缘阳性组(25例)和切缘阴性组(88例),两组病变复发率为8.00%、6.81%,差异无统计学意义(P>0.05)。详见表4。

表4 初次锥切术后切缘状态与病变复发率
3 讨论
基于宫颈癌前病变具有多细胞起源、多中心分布、宫颈管内病灶无法界定的特点,以及缺乏肉眼可见包膜样结构、触诊质地异常的“鲜明特征”,故而,临床上尽管严格遵循规范化手术原则,宫颈HSIL锥切手术后仍然不可避免会出现切缘阳性,以及术后存在病变残留或复发的问题。尽管宫颈癌前病变治疗后最终进展为宫颈癌的概率很小,切缘阳性与病灶残留复发也不存在必然的因果关系,但对患者可能造成沉重心理负担,尤其对年轻有生育要求的患者而言,一方面对于宫颈癌的恐惧,另一方面又担心补充手术影响生育功能。因此,分析哪些是切缘阳性的高危因素,并加以重视,对于降低宫颈锥切术后切缘阳性的发生率具有重要临床意义。
一项荟萃分析纳入66项研究结果发现,35 109例宫颈锥切患者中有8 091例切缘阳性,切缘阳性率为23%[7]。国内外学者对宫颈锥切术后切缘阳性率的报道不一致,总的阳性率介于19%~45%[8-10]。可能与研究方法、切缘阳性定义不同有关。本研究纳入501例宫颈HSIL显示宫颈锥切术后病变残留率为23.15%,与文献报道一致,经多因素Logistic回归分析后,研究结果表明宫颈锥切方式为LEEP、锥高≤1.6 cm及病变累及范围是切缘阳性危险因素[7]。Chen Y等[11]对1 113例高级别宫颈上皮内病变患者进行研究指出LEEP手术方式是切缘阳性的危险因素。本研究中LEEP术切缘阳性率为40.7%,CKC术切缘阳性率为15.5%,两者对比差异有统计学意义,多因素分析也提示LEEP手术是锥切病理切缘阳性的危险因素,跟文献报道相符。然而关于LEEP与CKC比较,是否是切缘阳性高危因素的研究结果也不尽相同,Arbyn M[8]在2017年发表一项荟萃分析,纳入1975~2016年97篇宫颈HSIL锥切文献,研究表明LEEP切缘阳性率略高于CKC(25.9% vs 20.2%)与锥切病理切缘阳性无显著性相关。本研究结果发现病变累及点数,即病变累及范围也是切缘阳性的高危因素之一,这与Tasci T等[12]学者认为HSIL累及2个以上的象限病变是锥切术后切缘阳性且病变残留的高危因素的报道相符。另外宫颈锥切的锥高与切缘状态关系、术后妊娠结局关系密切[13-14],因此也备受关注。有学者认为,宫颈锥切的锥高与不良妊娠结局,包括早产、流产、胎膜早破等在内的产科并发症的风险呈正相关,临界值为10~15 mm,超过此范围,则上述风险增加[3]。本文研究结果切缘阳性高危因素之一锥高界值为≤1.6 cm,表明锥高≤1.6 cm尽管增加了切缘阳性的风险,但是在术后发生产科并发症的角度,它却不增加妊娠不良结局的风险,因此,我们在进行宫颈锥切手术时,应充分考虑患者的年龄、生育需求、其他合并症等因素,严格遵循规范化的同时,权衡利弊,高度个体化设计锥切手术的锥高与锥宽。
前文提及切缘阳性的出现有一定的客观性,即使严格遵循规范,也难以规避之,因此,临床上需要正确认识与对待,重要的问题是探讨切缘阳性与疾病预后指标—宫颈HSIL病变残留、复发之间的关系,那么切缘阳性是否就意味着病变残留、需要补充二次手术,而切缘阴性就意味着病变被彻底切除了呢?宫颈HSIL锥切术后病理提示切缘阳性的患者病变残留率多波动于在5%~50%[15-16],Arbyn M[8]通过统计分析了全球近40年行宫颈锥切术的患者,切缘阳性CIN 2+残留的总体风险为7%,是切缘阴性患者的5倍,术后复发风险是阴性组的5.47倍,切缘阳性预测CIN 2+残留/复发的敏感度为56%,特异性为84%,而高危型HPV检测预测病变残留/复发的敏感度和特异度分别为91%、83.8%,相对而言,高危型HPV检测具有更好的预测病变残留/复发的价值。吴婷婷等[17]统计分析切缘阳性补充二次手术相关数据,结果提示病灶残留率达32.5%(54/166),年龄与锥宽不足为残留高危因素。本研究中78例初次锥切后患者半年内补充二次手术(包括再次锥切与全子宫±双附件切除术),总体病变残留率为25.64%,与大多数文献报道结果相一致,初次锥切病理切缘阳性组残留率为40%,是切缘阴性组(13.95%)的2.87倍,两者差异有统计学意义,表明切缘阳性是残留的高危因素,但缺点是样本量较小。目前虽然切缘阳性是术后残留的高危因素这一观点已成为大多数学者的共识,但是很多学者认为切缘阳性的患者不是均需短期内补充二次手术,许多切缘阳性患者进行随访复查或进行二次手术后的病理回报并不存在宫颈高级别病变。该现象可能是由于宫颈锥切术中对锥切边缘的电凝止血处理消除了切口处的残留病变,此外,切口处病变也可能在愈合过程中受阴道酸碱度和细胞快速生长作用影响从而发生消退。
有报道指出锥切术后随访的病变复发概率为4%~18%,好发于初次锥切术后2~3年内[18]。然而目前切缘阳性和随访中病变复发的关系仍未有统一定论,周萍等[19]学者认为切缘阳性患者术后在随访观察过程中病变复发率比切缘阴性患者高,然而Orbo A等[20]学者对379例高级别宫颈上皮内病变初次锥切术后的患者进行长达19~23年的随访,其中切缘阳性80例,发现切缘阳性与切缘阴性患者病变复发率之间差异无统计学意义 (11.37% vs 10.00%) 。而本研究113例初次锥切后规范随访的患者中,复发的平均时间为(11.1±2.4)月,总体病变复发率为7.08%,复发率在切缘阳性组与切缘阴性组之间差异无统计学意义(8% vs 6.81%)。本项研究中锥切术后切缘阴性的88例患者在随访中有6例患者病理提示CIN 2~3复发,这表明无论切缘状态如何,我们都需要重视宫颈HSIL规范化术后随访与管理,关于随访策略,2019年ASCCP建议无论切缘状态如何,首选初次治疗后6个月随访基于HPV检测(联合检测或HPV检测)如阴性,则每年基于HPV检测1次,直到3次阴性,之后转为每3年1次基于HPV检测,至少25年(即使年龄超过65岁)。另外,对于切缘阳性者,年龄≥25岁且无生育计划患者,也可以选择补充二次锥切或观察随访,但对于年龄小于25岁或有生育计划患者,推荐观察随访。随访期间,若证实病灶残留可考虑二次锥切术,如因解剖因素难以完成二次锥切,可考虑全子宫切除;如排除病灶残留则考虑继续随访;不推荐切缘阳性者直接补充手术,包括二次锥切和全子宫切除术[21]。这一随访管理策略与《子宫颈锥切术后高危型人乳头瘤病毒阳性者规范化管理的专家共识》[22]基本一致。
综上所述,本研究认为临床上应该要客观面对宫颈HSIL锥切术后不可避免存在切缘阳性这一问题,术前需充分解读阴道镜图像,结合患者年龄、生育需求、宫颈长度、手术史及随访条件等因素综合考虑,精细化制定治疗方案、手术方式、宫颈锥切范围(锥高与锥宽),以求尽量降低切缘阳性率的同时,最大程度上保留正常宫颈组织以期保护宫颈功能。对于宫颈HSIL初次锥切术后患者,无论切缘状态如何,切缘阳性并不等同于残留或复发,切缘阴性也不等同于病灶彻底切除,因此,不能盲目立即补充手术一切了之,而应根据其生育要求、年龄、个人意愿、随访条件等因素,予以高度个体化处理。切缘阴性者同样有残留复发的风险,锥切术后应密切随访。
