三河口水库消落带植物水解氮磷释放特征研究
2022-07-01冯民权
何 姜,冯民权
(西安理工大学 西北旱区生态水利国家重点实验室,陕西 西安 710048)
1 研究背景
水库消落带是指因水库的调度运行而在两岸形成的水位涨落区域,一般具有周期性[1],作为水体与陆地之间的连接带,起着承上启下的关键作用,使水陆之间的物质、能量等得到交换。消落带一般在植物生长茂密的夏季露出,在9月其生物量达到最大时因库区蓄水而被淹没,植物被浸泡分解,释放出大量氮、磷等养分,引起水库中营养物质浓度升高,水体环境发生变化,对水库的生态环境造成负面影响[2]。三河口水利枢纽是引汉济渭工程的重要水源之一,水库死水位614 m,正常蓄水位641 m,水位涨落可达27 m,其消落带对水库水环境安全有着密切的影响,是水陆之间的最后一道防线。
目前对水库消落带的研究多针对其土壤养分形态特征[3-4]、植物群落物种多样性及分布格局[5-7]和生态系统修复[8-9]等方面,而这些研究大部分以三峡水库[10]等大型南方内陆水库水体为对象进行开展。如:王建超等[11]以三峡库区消落带优势植物为材料,进行了室内模拟实验,分析了其氮、磷养分释放过程及特征;肖丽微等[12]研究了不同环境条件(温度、pH、避/透光)对三峡库区狗牙根氮、磷养分释放量的影响;袁庆叶等[13]以消落带中10种常见的草本植物为样本,探究了水淹条件下不同植物氮、磷释放速率与其内部初始营养基质(C、N、木质素)之间的关系。这些研究都集中在植物水解后的总氮、总磷释放过程及影响因子、自身基质等方面,有关其对水体环境浊度、溶解氧的变化及释放的氮磷不同形态等方面的研究不多,而各种形态的氮、磷对水库的富营养化有着不同的影响[14],比如颗粒态氮、磷会影响水库内悬浮物的输移转化等[15]。
三河口水库正在进行初期蓄水,消落带已初步形成,为了探明蓄水期间消落带植物水解后对库区水环境的影响,本研究选取5种消落带优势植物为样本,进行室内水解模拟实验,通过监测和分析,得到消落带植物水解后水环境的变化过程以及氮、磷养分的释放特征,可为后期引汉济渭工程的环境评价及制定消落带植物管理策略等提供科学依据及数据支持。
2 材料与方法
2.1 研究区概况
三河口水利枢纽是引汉济渭工程的重要水源之一,也是整个工程中具有较大水量调节能力的核心项目。坝址地处湖北省麻城市佛坪县大河坝乡三河口村下游2 km处,流域面积为2 186 km2,河长为106 km,坝高为145 m,总库容为7.1×108m3。水库库区属北亚热带湿润、半湿润气候区,多年平均气温为12.3 ℃[16]。
2.2 实验用水及植物
以三河口水库库水为实验用水。2021年6月在三河口水库库区的开阔区域(33°19′N,108°02′E)采集库水,带回实验室冷藏备用。
2021年6月在三河口水库蓄水前对库区消落带植被生长情况进行现场调查,根据三河口水库消落带植物的实际状况,选取耐淹能力不同且具有代表性的5种优势植物作为实验样本,采集植物样本地上茎叶部分,带回实验室,清洗擦干备用。选取的5种植物样本包括青蒿(ArtemisiacarvifoliaBuch.-Ham)、艾(ArtemisiaargyiLevl.et Van)、醴肠(EcliptaProstrataL.)、菵草(BeckmanniaSyzigachne(Steud.) Fern.)、酸模叶蓼(PolygonumlapathifoliumL.),各样本植物及浸泡实验如图1所示。

图1 采集到的5种消落带优势植物样本及浸泡实验
2.3 实验设计
根据文献[17]、[18],选择2 L容积的烧杯作为模拟实验的浸泡容器(图1(f)),植物含量为10 g/L。为了减少系统误差和保证实验的科学性,将采集到的5种实验植物的茎叶部分用剪除法调配,确保每个容器内的植物茎叶完整且比例基本一致,将处理好的样本各称取20 g放入尼龙网袋内(尺寸为20 cm×20 cm,网孔大小为1 mm×1 mm),然后置于烧杯中,加入2 L库水,同时设置库水空白(KB)对照实验。将浸泡装置置于室内进行模拟实验,保持各烧杯外环境(温度、光照)一致。根据文献[11]、[19]的研究成果,在植物水解过程的前30 d,其氮、磷释放量可达到最大,因此本实验设置水解时长为32 d。在实验进行的第1、3、5、7、10、13、17、21、26、32 d分别取样监测,并在取样后补充相应量的库水,模拟水库上游来水的补水,同时保证实验过程中浸泡水体体积的一致。
(1)植株含水率、氮(N)、磷(P)的含量测定。将所采集的植物地上茎叶样本带回实验室,先称量鲜重,再烘干后测重,计算含水率;用凯氏定氮法测定植物总氮含量,用钼锑抗比色法测定植物总磷含量[20]。

2.4 数据计算及处理
养分累积释放量:上覆水养分浓度与其总体积的乘积再比上植物初始干重,计算方法见公式(1)。
(1)
式中:Di为植物养分的累积释放量,mg/g;ci为第i次取样时的上覆水养分浓度,mg/L;Vi为第i次取样后烧杯内水的体积,L;n为取样次数;vi为第i次取样的水体积,L;m0为植物初始干重,g。
养分释放速率:
r=Dmax/t
(2)
式中:r为养分释放速率,mg/(g·d);Dmax为养分最大累积释放量,mg/g;t为植物浸泡时间(即养分释放浓度达到峰值的时间),d。
养分释放负荷:
F=10A·Dmax
(3)
式中:F为养分释放负荷,kg/hm2;A为植物生物量,kg/m2。
实验数据使用SPSS软件进行数据分析、Origin软件进行图形绘制;采用One way-ANOVA方法进行显著性分析、Pearson法进行相关性分析。
3 结果与分析
3.1 植物的理化特征
测定消落带5种优势植物的含水率及总氮、总磷含量,结果见表1。由表1可知,5种植物平均含水率为37.54%,且彼此差异不大,其中酸模叶蓼的含水率最高,艾的含水率最低;植物平均氮含量为23.64 mg/g,其中菵草的氮含量最高,醴肠氮含量最低,前者氮含量为后者的1.6倍;植物平均磷含量为3.10 mg/g,其中青蒿的磷含量最高,醴肠的磷含量最低,前者磷含量为后者的1.7倍。5种植物平均N/P值为7.81,其中菵草的N/P值最高,青蒿的N/P值最低。
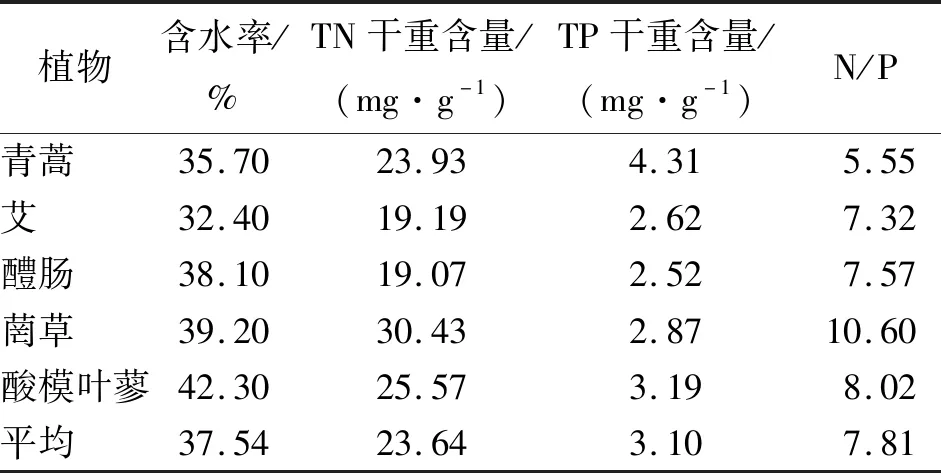
表1 研究区水库消落带5种优势植物的理化性质
3.2 植物水解上覆水理化性状特征
在模拟水解实验中,对植物样本的形态、上覆水的颜色味道、pH、电导率、溶解氧(DO)和浊度等指标进行了32 d连续观察与监测,各理化指标随时间的变化过程如图2所示。
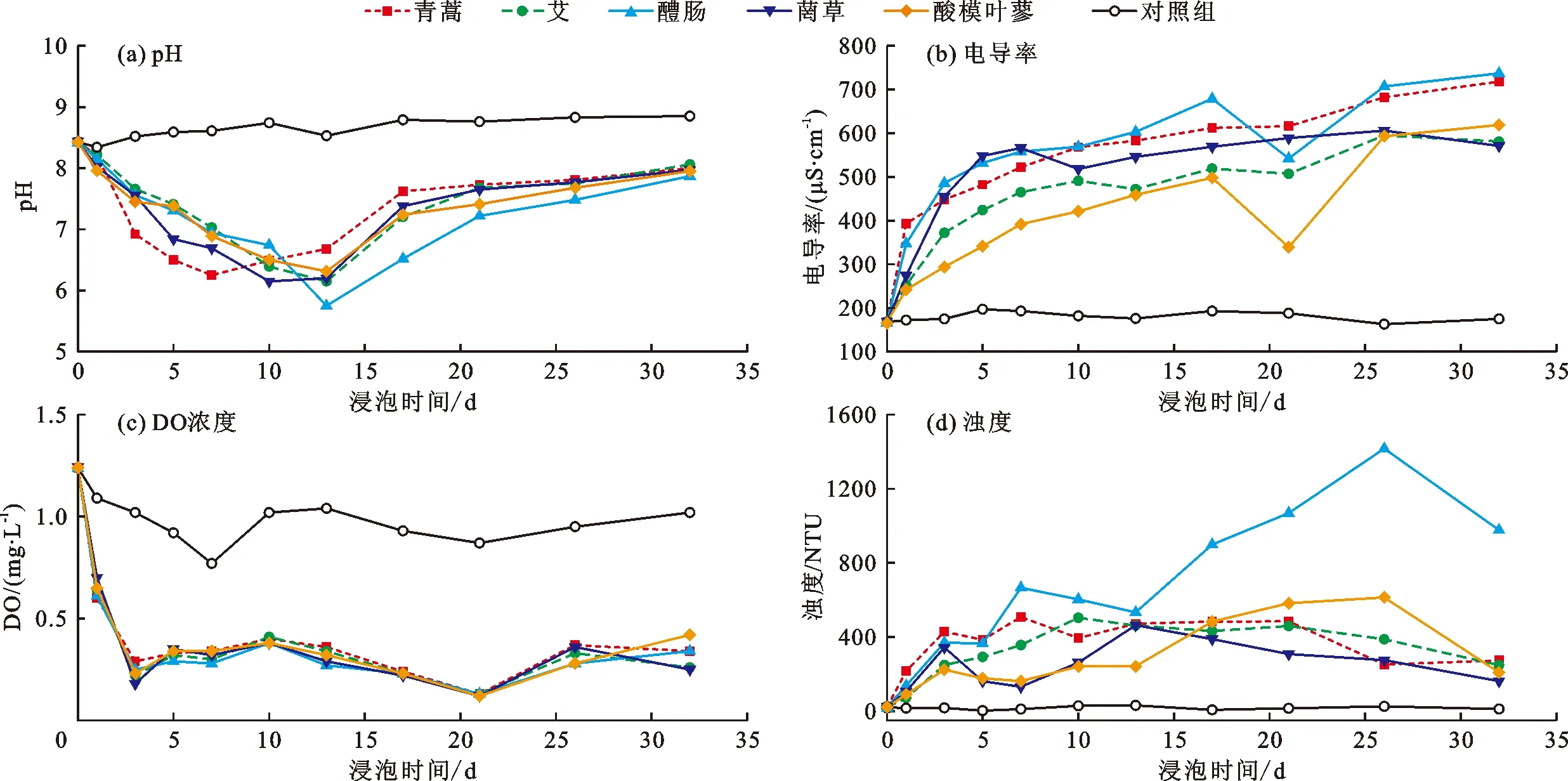
图2 水解实验消落带5种样本植物上覆水各理化指标的变化过程
对各植物样本水解实验过程中上覆水的理化性状变化特征分析如下:
(1)上覆水体变化和植物形态变化。在植物水解实验过程中,上覆水颜色由起初的无色透明开始逐渐变黄,且颜色随时间的增加而加深,同时颗粒物逐渐增多,最终形成浑浊褐色水体;植物样本由新鲜茎叶逐渐变得透明,随着不断分解体积也越来越小,最终呈完全透明且无完整茎叶形态;随着植物的水解,库水从无味到逐渐产生异味,最后散发出强烈刺鼻的恶臭味。
(2)上覆水pH值变化。由图2(a)可知,5种植物上覆水的pH值变化规律一致,均在浸泡前期15 d内持续减小,随后又先快速增大后逐渐稳定。其中青蒿水解上覆水的pH值减小速度最快,在第7 d达到最小值,醴肠水解上覆水的pH值减小速度最慢,在第13 d时达到最小值5.75,且稳定后的pH值也比其余4种植物略小;经水解32 d后,5种植物上覆水的pH值相差不大,其平均值为7.79,且均小于库水空白对照组的pH值(8.85)。
(3)上覆水电导率变化。水体中含盐量和无机离子浓度常用电导率大小来推测。由图2(b)可知,在植物水解实验中,5种植物上覆水的电导率变化规律基本一致,均在前5 d内迅速增大,随后增大速度降低,趋于稳定;5种植物经过水解32 d后,上覆水电导率平均值为645.2 μS/cm,其中醴肠水解上覆水的电导率最大,菵草的最小;5种植物上覆水的电导率均远大于库水空白对照组(175.0 μS/cm),表明消落带植物被浸泡水解之后使水体的电导率增大,即水体中无机离子浓度和含盐量增加。
(4)上覆水溶解氧DO变化。天然水体中溶解氧含量会影响该水域中生物的数量和类型。由图2(c)可知,5种实验植物样本水解上覆水的DO变化趋势一致,在浸泡的前3 d内DO浓度均急速降低,然后呈小幅波动,在第21 d达到最低值,整个实验过程中5种植物样本水解上覆水的DO浓度差异不大;5种植物浸泡32 d后,DO平均浓度为0.32 mg/L,均明显低于库水空白对照组(1.02 mg/L),表明消落带植物被浸泡水解后使得水体的DO减少,将影响水中生物的生存。
(5)上覆水浊度变化。浊度是水体监测中的一项重要水质指标。由图2(d)可知,5种植物样本上覆水浊度变化趋势基本一致,在浸泡前期浊度上升迅速,至15 d左右开始下降,期间波动较为明显,可能是取样扰动造成。醴肠水解过程中的浊度变化很大,呈迅速上升趋势,在25 d左右达到高峰,然后开始下降。水解32 d后,5种植物上覆水的浊度平均可达374.42 NTU,远大于库水空白对照组(11.59 NTU),表明植物水解后,会使水体变浑浊,影响水库水环境。
3.3 消落带植物水解养分释放过程
水库蓄水后,消落带植物被浸泡,由于受到物理、化学和微生物等作用,植物茎叶发生腐烂分解,向水中释放出大量营养物质,上覆水各项营养物质浓度增大,同时因为植物和烧杯壁吸附等作用,浸泡后期营养盐的浓度会发生轻微波动。通过室内模拟水解实验,得到上覆水中氮、磷养分浓度变化过程,如图3、4所示。
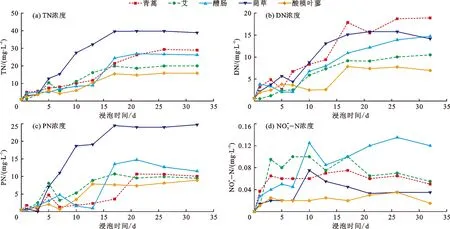
图3 水解实验消落带5种样本植物上覆水中氮养分浓度的变化过程
对图3、4中的实验测试结果分析如下:
(1) 上覆水中氮养分浓度的变化。由图3(a)可以看出,5种植物浸泡水解后,TN的释放均呈现先增大后平稳的过程。平均在20 d时,上覆水中的TN浓度达到峰值,浸泡初期TN释放最快的样本植物为菵草,释放最慢的植物为酸模叶蓼和醴肠;浸泡后期5种植物上覆水中的TN消耗速度基本等于自身释放速度,因此上覆水的TN浓度基本保持不变。至浸泡结束时,上覆水中TN浓度大小排序为菵草>青蒿>醴肠>艾>酸模叶蓼。
如图3(b)、3(c)所示,在浸泡前期,上覆水中的DN浓度迅速增大,在浸泡后期,增速变缓或上下波动,与TN不同的是,各样本植物上覆水中DN浓度达到峰值的时间大部分在浸泡20 d之后,浸泡32 d后,青蒿的DN浓度占TN浓度的比例最高,菵草的DN浓度占TN浓度的比例最低,5种植物平均的DN浓度占TN浓度的56.8%,即植物水解释放的氮中,多半以DN存在,少半以PN存在。浸泡前期PN的释放浓度增大速率较快且波动明显,后期逐渐平缓,上覆水中PN的浓度平均在20 d达到峰值,至浸泡后期,除菵草和醴肠外,其余3种植物的PN浓度差别不大。
(2) 上覆水中磷养分浓度的变化。如图4(a)所示,5种植物水解过程中,TP的释放过程均呈对数曲线状,在浸泡初期5 d内TP浓度迅速增大,然后增幅变缓,平均第17 d时释放浓度达到峰值,随后趋于稳定,在浸泡初期TP释放最快的植物为青蒿,释放最慢的植物为菵草;5种植物上覆水TP浓度后期波动较小,曲线平缓,因为磷素与氮素相比受环境因素的影响相对较小,不易通过变成气体而挥发损失。至浸泡结束时,上覆水中TP浓度大小排序为青蒿>醴肠>艾>酸模叶蓼>菵草。

图4 水解实验消落带5种样本植物上覆水中磷养分浓度的变化过程
由图4(b)、4(c)可见,上覆水DP浓度在浸泡前15~20 d内上升迅速,与TP相似,而在TP浓度基本趋于平稳后(20 d之后),除醴肠在第17 d达到浓度峰值之外,其余4种植物的DP浓度总体还在增大,至浸泡后期(32 d),平均的DP浓度占TP浓度的63.8%,其中艾的DP浓度占比最高,醴肠的DP浓度占比最低;PP的浓度呈现先增大后波动的变化特征,且5种植物上覆水中PP浓度达到峰值的时间差异较大,其中醴肠的PP浓度峰值最大,菵草的PP浓度峰值最小,至浸泡后期,除醴肠、青蒿外,其余3种植物的PP浓度几无差别。
从图4(d)中可以看出,PO43-—P的释放过程与DP相似,也是浸泡前期释放浓度增加较快,后期波动变缓。浸泡前期,青蒿和醴肠上覆水中PO43-—P浓度增大速度较快,除醴肠在第7 d时达到浓度峰值之外,其余4种植物上覆水中的PO43-—P浓度至浸泡末期还处于增大状态;第32 d时,5种植物上覆水的平均PO43-—P浓度占TP浓度的69%,即植物水解释放的磷大部分以PO43-—P的形式存在。
3.4 消落带植物水解氮、磷养分释放量
植物水解的氮、磷养分释放量是用上覆水中测得的养分浓度,经过公式(1)计算得到的最大累积释放量来表示,计算结果如图5所示。

图5 水解实验消落带5种样本植物氮、磷养分释放量
图5表明,因5种样本植物体内的氮含量均高于磷含量,因此其水解的养分释放量均呈现TN>TP,TN、TP的平均释放量为4.06和0.78 mg/g,各自占初始基质氮、磷含量的17.2%和25.3%,TN释放量为TP释放量的5.2倍,释放比例却小于TP,表明植物中磷素的释放更为彻底。
经过方差分析,5种消落带优势植物水解的TN和TP释放量之间差异显著(p<0.05),说明不同的植物类型对其氮、磷养分释放的影响显著,其中菵草的TN释放量最大,为6.17 mg/g,释放了初始基质氮含量的20.3%;酸模叶蓼的TN释放量最小,为2.42 mg/g;醴肠释放的氮占初始基质氮含量的比例最大,达到21.6%。青蒿为TP释放最多的植物,释放量达到1.16 mg/g,为初始磷含量的27.0%;菵草的TP释放量最少,为0.48 mg/g;醴肠释放的磷占初始基质磷含量的比例最大,达到42.0%。
植物水解后的氮、磷损失量分别由植物初始氮、磷含量减去浸泡后残体中剩余的氮、磷含量得到,如表2所示。植物的氮、磷损失量与上覆水中氮、磷累积释放量存在较大差异,5种植物的平均氮释放量占损失量的33.6%,平均磷释放量占损失量的45.5%,均不及养分损失量的一半。究其原因,一方面,在植物水解过程中,氮、磷元素不仅会在水中释放,也会被微生物吸收或者变成气体释放到空气中;另一方面,颗粒态的氮、磷也会沉淀附着在植物残体或者容器杯壁上造成养分损失[23]。
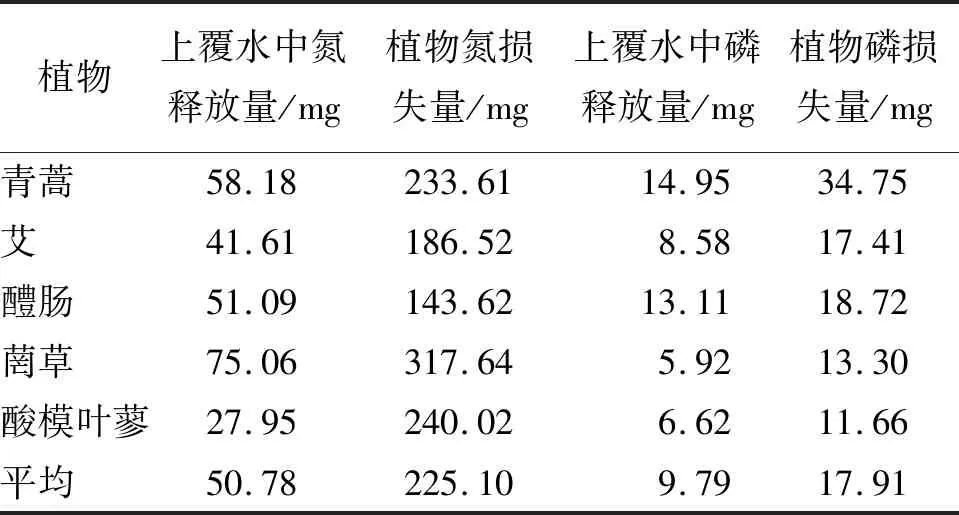
表2 消落带5种样本植物水解后的氮、磷损失量与释放量对比
3.5 消落带植物水解氮、磷养分释放速率
消落带5种样本植物的氮、磷养分释放速率如图6所示。由图6可见,除青蒿外,其余4种植物的TN释放速率均远大于TP释放速率。TN、TP的平均释放速率分别为0.156和0.065 mg/(g·d),TN释放速率为TP的2.4倍。其中,菵草的TN释放速率最大,可达0.237 mg/(g·d),酸模叶蓼最小,为0.076 mg/(g·d),前者为后者的3.1倍;青蒿的TP释放速率最大,为0.232 mg/(g·d),菵草最小,为0.015 mg/(g·d),前者为后者的15.5倍。方差分析表明,5种植物的TN、TP释放速率存在显著差异(p<0.05),说明植物类型对氮、磷养分释放速率有显著影响。相关性分析表明,植物水解实验中TN的释放速率与初始基质含氮量无显著相关性(p>0.05),而TP的释放速率与初始基质含磷量呈显著正相关(p>0.05)。
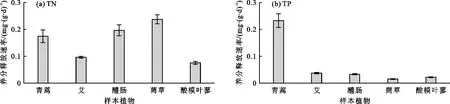
图6 水解实验消落带5种样本植物氮、磷养分释放速率
3.6 消落带植物氮、磷养分水解释放负荷
在对三河口水库消落带植物进行现场踏勘和测定的基础上,根据文献[24]以及引汉济渭环境影响评价报告等资料,以植被地上总生物量为5 kg/hm2估算5种样本植物的地上生物量,依据分布比例和盖度等数据,对其进行权重分配(表3),计算5种样本植物的氮、磷释放负荷,结果见表4。在蓄水初期(32 d)中,植物通过水解,平均释放到三河口水库的养分负荷TN为40.4 kg/hm2,TP为7.6 kg/hm2,TN为TP的5.3倍。其中不同植物的氮、磷释放负荷差别较大,菵草的TN释放负荷最大,达到59.9 kg/hm2,酸模叶蓼最小,为22.5 kg/hm2,两者相差2.7倍。青蒿的TP释放负荷最大,达到12.0 kg/hm2,菵草最小,为4.7 kg/hm2,两者相差2.6倍。

表3 消落带5种样本植物生物量及分布权重
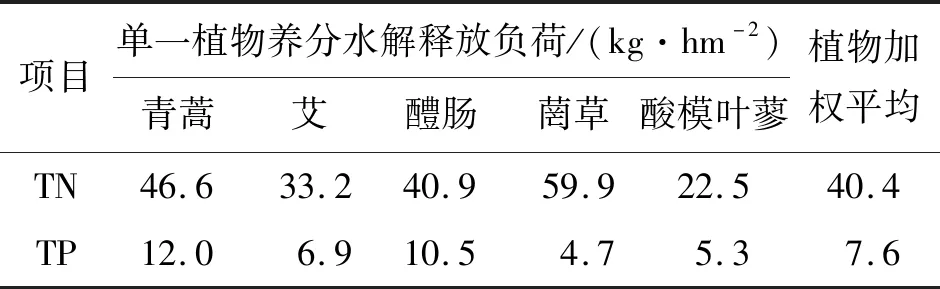
表4 消落带5种样本植物单位面积氮、磷养分水解释放负荷
4 讨 论
本研究发现植物水解过程中上覆水的pH值先下降后升高且一直小于空白对照组的pH值,这与王建超等[11]“植物水解造成上覆水pH值升高”的结论不一致,可能因为该文献使用的浸泡水为去离子水,pH呈中性,而本实验使用三河口水库的库水作为浸泡水,其pH值高于去离子水,浸泡前期植物分解腐烂释放出有机酸,以及微生物呼吸消耗O2产生CO2,导致水体pH值降低,随着水体中O2含量的消耗[25],溶解氧浓度减小,有机酸的释放速率降低,同时浸泡后期植物开始厌氧分解,pH值逐渐增大但仍小于库水空白的对照组。
植物水淹后第20 d氮素释放达到峰值,第17 d磷素释放达到峰值,推测三河口水库水质在蓄水前25 d为最差。根据《引汉济渭一期环评报告》中三河口水库上游来流水质监测资料,其总磷浓度为0.02 mg/L,总氮浓度太小未检测出,对比可见,消落带植物在蓄水期带来的氮、磷释放会成为三河口水库蓄水期间的重要营养物质来源。一方面,植物分解会对水体水质产生影响,大量营养物质的释放可能会造成水体缺氧或富营养化[26],而另一方面,较小的植物分解速率可以降低水中营养盐的循环速度,有利于控制水体富营养化的发展[27]。因此可以考虑在水库蓄水前对消落带中养分释放速率较大的青蒿和菵草等进行适量收割等处理,防止蓄水期间水库中营养物质浓度迅速增长上升而造成水库水质污染。
5 结 论
(1)三河口水库消落带5种优势植物平均含水率为37.54%,其中酸模叶蓼含水率最高,艾含水率最低;植物干重平均总氮、总磷含量分别为23.64和3.10 mg/g,其中菵草的总氮含量最高,醴肠最低;青蒿的总磷含量最高,菵草最低。
(2)植物在浸泡水解的过程中,上覆水的颜色逐渐变深至褐色且浑浊,散发出恶臭异味;叶片变得透明,最终失去形态;浸泡32 d后,上覆水平均pH值下降至7.79,平均电导率增大至645.2 μS/cm,平均溶解氧DO减小为0.32 mg/L,平均浊度达374.42 NTU,这些将对水库水环境造成影响。
(4)在水库蓄水后的30 d内,5种消落带植物的TN和TP的累积释放量达到最大,植物被浸泡水解后向水体释放的氮、磷负荷分别可达40.4、7.6 kg/hm2,因此在三河口水库蓄水初期,可能会出现局部水域氮、磷养分超标,水质恶化的现象。
