鸭疫里默氏杆菌外膜蛋白A原核表达及间接ELISA方法的建立和初步应用
2022-07-01陈汝佳张亚楠欧德渊徐景峨
陈汝佳,李 婷,余 波,张亚楠,蒲 龄,欧德渊,徐景峨*
(1.贵州大学动物科学学院,贵阳 550025;2.贵州省农科院畜牧兽医研究所,贵阳 550005)
鸭疫里默氏杆菌(Riemerellaanatipestifer,RA)是具有荚膜,未产生芽孢,没有鞭毛的革兰氏阴性短小杆菌[1]。目前暂定为里氏杆菌属,未定为哪一科,纯培养菌落涂片可见菌体呈单个、成对或偶呈丝状,菌体大小不一,0.2~0.4 μm×1~5 μm[2]。RA在全国各地广泛分布,且在鸭、鹅中具有着高感染率,主要通过呼吸道和损伤皮肤等传播,也可经蛋垂直传播[3]。该病一年四季皆可发生,其主要病变特征为纤维素性心包炎,纤维素性肝周炎和脑膜炎等多系统性综合征[4],在临床上RA与鸭圆环病毒、鸭坦布苏病毒、鸭源呼肠孤病毒、新城疫病毒等发生混合感染,给水禽业带来严重危害[5]。
鸭疫里默氏杆菌外膜蛋白A(Outer Membrane Protein A,OmpA)具有较强的免疫原性和反应原性,不同来源的OmpA基因同源性较高。OmpA蛋白是RA的主要外膜蛋白维持细菌完整,同时参于吸附定植于宿主细胞[6]。此外,有研究已证明[7],OmpA蛋白是RA的主要免疫原性蛋白。本研究利用原核表达系统成功制备了重组OmpA蛋白,并进一步建立了检测RA IgG抗体的间接ELISA方法。
1 材料与方法
1.1 试验材料 RA分离株(G06株)由本实验室分离并保存;RA阳性及阴性血清、多杀性巴氏杆菌、沙门氏菌、坦布苏病毒、大肠杆菌阳性血清由本实验室保存;pET32a原核表达载体购自南京钟鼎生物技术有限公司;BamHI、XhoI、BL21购自宝生物工程(大连)有限公司;DNA 胶回收试剂盒、质粒小量提取试剂盒购自OMEGA;IPTG、Urea购自生工生物工程(上海)股份有限公司;Tris、Glycine、SDS、酶标板、TMB显色液、PBST购自北京索莱宝科技有限公司;HisPurTMNi-NTA纯化试剂盒购自赛默飞世尔科技(中国)有限公司;HRP-羊抗鸭IgG购自美国KPL公司。鸭传染性浆膜炎二价灭活疫苗(1型RAf63株+2型RAf34株)购自天津瑞普生物技术股份有限公司。
1.2 引物设计及合成 根据RA毒株中OmpA基因序列和pET32a原核表达载体载体序列中的克隆位点,利用Primer5.0设计一对特异性引物。选用BamHI和XhoI作为酶切位点,引物由上海生工公司合成,上游引物:5′-GGATCCATGTTGATGACTGGACTTGGT-3′,下划线为BamHⅠ酶识别位点;下游引物: 5′-CTCGAGTTATTTTCTTTTCTTTTTTACTACT-3′,下划线为XhoI酶识别位点;目的片段大小约为1149 bp。
1.3 pET32a-OmpA原核表达质粒的构建 提取RA总核酸,PCR扩增OmpA基因,利用BamHI和XhoI限制性内切酶双酶切PCR产物同时双酶切pET32a原核表达载体,将获得的线性化目的基因与目标载体连接,连接产物转化E.coliBL21(DE3)感受态细胞,挑取单个菌落,抽提质粒,双酶鉴定和测序验证。将测序结果与预期序列进行比对,验证正确的质粒命名为pET32a-OmpA。
1.4 OmpA重组蛋白的诱导表达与纯化 将pET32a-OmpA载体转化至大肠杆菌BL21(DE3)感受态细胞,挑取转化平板上的单个菌体扩大培养。用IPTG诱导表达重组菌37 ℃,4 h;取1 mL菌液,10000 g室温离心2 min弃掉上清,用PBS重悬菌体,上样。剩余菌液4000 g离心,10 min,弃上清,PBS重悬后超声波破碎,分别取上清和沉淀,上样。
1.4.1 OmpA重组蛋白可溶性分析 取阳性菌培养18 h,按1∶100接种50 mL LB(Amp+)锥形瓶,37 ℃摇到OD600值约为0.6,加终浓度0.5 mmol/L的IPTG诱导表达4 h,离心5 min,沉淀用PBS洗三遍,加20 mL PBS重悬,超声破碎后4 ℃离心,收集包涵体。
1.4.2 OmpA蛋白的纯化 包涵体使用Tris缓冲液洗涤3次后,用含2 mol/L尿素的Tris缓冲液洗去杂蛋白,离心取沉淀用含8 mol/L尿素的TGE缓冲液于4 ℃过夜溶解,离心取上清置于透析袋中,分别用6、5、4、3、2 mol/L尿素的TGE复性溶液梯次复性,蔗糖浓缩。
1.4.3 OmpA蛋白再纯化 将蛋白质提取物与平衡缓冲液混合制备样品使得总体积等于二倍树脂体积;将HisPurNi-NTA旋转柱700 g离心 2 min,去除存储缓冲液;向平衡柱中加入二倍树脂床体积的平衡缓冲液。使得缓冲液进入树脂层700 g离心2 min,收集缓冲液;将制备好的蛋白提取物加入柱中,使其吸附于树脂床700 g离心2 min;用二倍树脂床体积的洗涤缓冲液清洗树脂,700 g离心2 min,收集离心液;重复以上步骤两次。上样12%SDS-PAGE。
1.5 OmpA重组蛋白的Western-blotting鉴定 将纯化后的重组OmpA蛋白上样经SDS-PAGE后转印至NC膜,5%脱脂粉封闭液封闭37 ℃1 h。用封闭液稀释一抗(RA鸭阳性血清),膜在一抗稀释液中 4 ℃过夜。次日将膜取出后用PBST洗膜4次,每次5 min,用封闭液稀释二抗(HRP-羊抗鸭IgG)。膜在二抗中37 ℃反应 1 h。反应完毕后,把膜取出后置于干净的盒子中洗膜4次,每次5 min。ECL显影,曝光。
1.6 OmpA间接ELISA检测方法的初步建立 根据文献[8]设计好包被板,在板条上做上标记。用包被液将OmpA蛋白抗原稀释成需要的浓度,混匀后加入板中,每孔加入100 μL,4 ℃冰箱12 h。包被好后,弃除包被液,洗板3次,每孔加入200 μL 5%BSA封闭液,37 ℃恒温孵育1 h。取出酶标板,弃除封闭液,洗板1次。RA阳性血清1∶100倍稀释,每孔100 μL,37 ℃恒温孵育1 h。取出酶标板,弃去内液,洗板3次,向每孔中加入100 μL 稀释好的酶标二抗:HRP-羊抗鸭,1∶1000。37 ℃恒温孵育1 h。取出酶标板,弃去二抗,洗板5次,每孔先加入200 μL TMB 显色液,室温15 min。每孔加50 μL终止液,终止反应。即刻在酶标仪上读OD450值。
1.6.1 OmpA间接ELISA检测方法的优化 以纯化的OmpA蛋白为抗原,羊抗鸭-HRP为二抗,对下列条件进行优化,抗原包被浓度(1∶5、1∶10、1∶50、1∶100、1∶200、1∶400)、封闭条件(37 ℃ 15 min、37 ℃ 30 min、37 ℃60 min、37 ℃ 90 min、37 ℃ 120 min)、血清反应条件(37 ℃ 15 min、37 ℃ 60 min、37 ℃90 min、37 ℃ 120 min)、酶标反应条件(37 ℃ 15 min、37 ℃ 60 min、36 ℃ 90 min、37 ℃120 min)、显色时间(5 min、10 min、15 min、20 min)。

1.6.3 特异性试验 利用优化后的条件对本试验室保存的多杀性巴氏杆菌、沙门氏菌、葡萄球菌和大肠杆菌阳性血清进行检测,并设立RA阴阳性血清对照,评估该方法的特异性。
1.6.4 重复性试验 批内重复试验:使用同一批次纯化的OmpA蛋白包被酶标板,对6份临床阳性血清样品进行检测,每个样品重复3孔。
批间重复性试验:使用3个批次纯化的OmpA蛋白包被酶标板,检测同样的6份阳性血清样品。计算批内和批间变异系数,以检测其重复性。
1.6.5 敏感性试验 将5份RA抗体阳性血清进行倍比稀释(1∶50、1∶100、1∶200、1∶400、1∶800、1∶1600、1∶3200),利用建立的 ELISA方法进行检测、评价其敏感性。
1.6.6 临床样品的检测 利用本研究建立的OmpA间接 ELISA方法对2020年-2021年在贵州地区采集的120份鸭、76份鹅血清进行检测,计算RA抗体阳性率。
1.6.7 OmpA间接ELISA检测方法的初步应用 将40只1日龄健康雏鸭随机分成2组,20只/组。分别设A组为灭活疫苗组(0.2 mL)、B组为生理盐水阴性对照组(0.2 mL)。对饲养至7日龄健康雏鸭分别采用皮下注射进行接种免疫(首免),间隔1周(14日龄)后进行二次免疫。在首免(7 d采血)和二次免疫(14 d采血)后21 d、28 d、35 d、42 d、49 d、56 d,各组随机采集10只雏鸭外周血样本,分离血清,测定OD450值。
将40只健康产蛋鸭随机分成2组,20只/组。分别设A组为灭活疫苗组(0.40 mL)、B组为生理盐水阴性对照组(0.40 mL)。对产蛋鸭分别采用皮下注射进行接种免疫(首免),隔上1周后对产蛋鸭进行二次免疫。收集免疫产蛋鸭0、1、2、3、4、5、6、7 w下的种蛋,每组10枚蛋,采用间接ELISA方法检测卵黄抗体,测定OD450值。
2 结果与分析
2.1 OmpA基因的PCR扩增及重组质粒鉴定 OmpA扩增产物及双酶切重组质粒pET32a-OmpA的电泳结果均与预期片段一致,表明重组质粒构建正确(图1)。
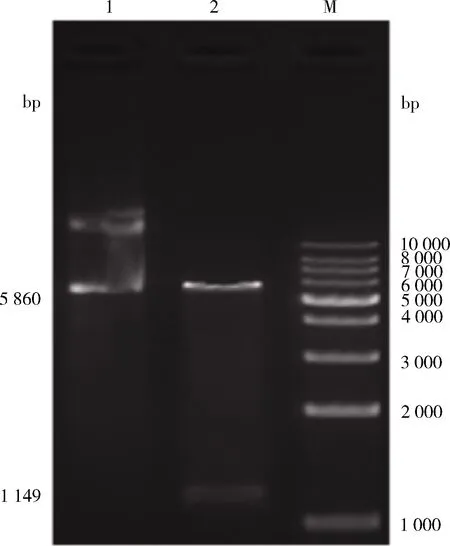
M: DL10000 Marker;1:酶切前质粒;2: 酶切后质粒
2.2 OmpA重组蛋白的诱导表达与纯化 原核表达质粒 pET32a-OmpA体外诱导表达后经12% SDS-PAGE 分析,结果显示,在57 KD处有预期大小的目的条带,目标蛋白主要在沉淀中,上清中无明显条带(图2.1),表明 OmpA重组蛋白主要以包涵体形式表达。进一步利用 His 标签蛋白纯化试剂盒对OmpA重组蛋白进行纯化。将11 μg纯化后的重组蛋白上样12% SDS-PAGE,显示,在57 KD处有明显单一条带(图2.2),表明OmpA蛋白纯化效果较好。用BCA法测得的纯化OmpA蛋白的浓度约为2.243 mg/mL。
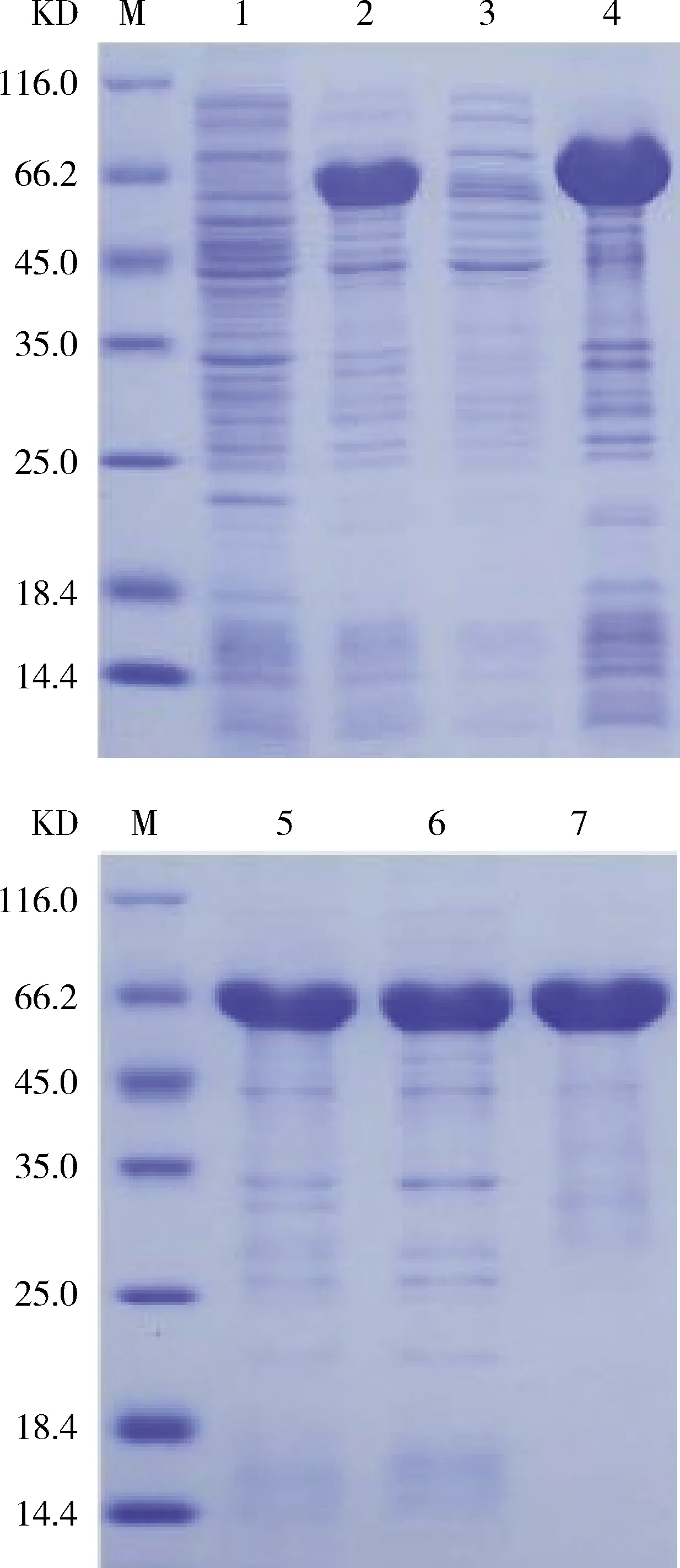
M:蛋白分子质量标准 1:未诱导 2:诱导后 3:诱导破碎后上清 4:诱导破碎后沉淀 5:破碎后处理样品 6:流出 7:洗脱
2.3 OmpA蛋白的Western-blot鉴定 用鸭疫里默氏杆菌抗体阳性血清鉴定纯化的OmpA蛋白。Western-blotting结果显示,在57 KD处有一条清晰带(图3),表明重组OmpA单边具有良好的反应原性。

M:蛋白质分子质量标准 1:纯化后OmpA蛋白
2.4 OmpA-ELISA检测条件的优化结果 经多次方阵检测结果显示,OmpA蛋白以2.243 mg/mL的浓度进行包被,血清以11∶100稀释,抗原包被条件为4 ℃过夜、封闭条件为37 ℃ 120 min、血清反应时间为37 ℃ 60 min、酶标抗体工作浓度为1∶1000、酶标抗体反应时间为37 ℃ 60 min、显色时间为15 min。


图4 临界值的计算
2.6 特异性试验 利用建立的OmpA-ELISA方法对本实验室保存的多杀性巴氏杆菌、沙门氏菌、葡萄球菌和大肠杆菌阳性血清进行检测,并设立RA阴阳性血清对照,结果显示,除RA阳性血清有较好反应外,对其他血清均无明显反应,说明该ELISA方法对RA特异性较好。
2.7 重复性试验 选择同批次包被ELISA板,进行批内重复试验和批间重复试验,结果显示,批内变异系数2.77%~8.00%,批间变异系数为1.10%~7.80%,变异系数均小于10%,证明该ELISA方法可重复。

表1 特异性试验

表2 重复性试验
2.8 敏感性试验 运用建立的OmpA-ELISA方法将RA阳性血清稀释7个梯度后,结果显示当阳性血清稀释比例为1∶1600时,OD450值仍大于0.389(图5),仍可判断为阳性,表明该方法敏感性较高。

图5 敏感性试验
2.9 临床样品的检测 利用试验建立的OmpA-ELISA方法对贵州省120份鸭、76份鹅血清样本进行检测,结果显示,120份鸭血清样本中57份血清样本为阳性,63份血清样本为阴性,阳性率为47.5%。76份鹅血清样本中17份血清样本为阳性,59份血清样本为阴性,阳性率为22.4%。
2.10 OmpA间接ELISA检测方法的初步应用 应用本试验建立的OmpA-ELISA方法检测经灭活疫苗免疫后雏鸭RA抗体及免疫产蛋鸭后鸭蛋中卵黄抗体规律变化水平。如图6、图7所示。
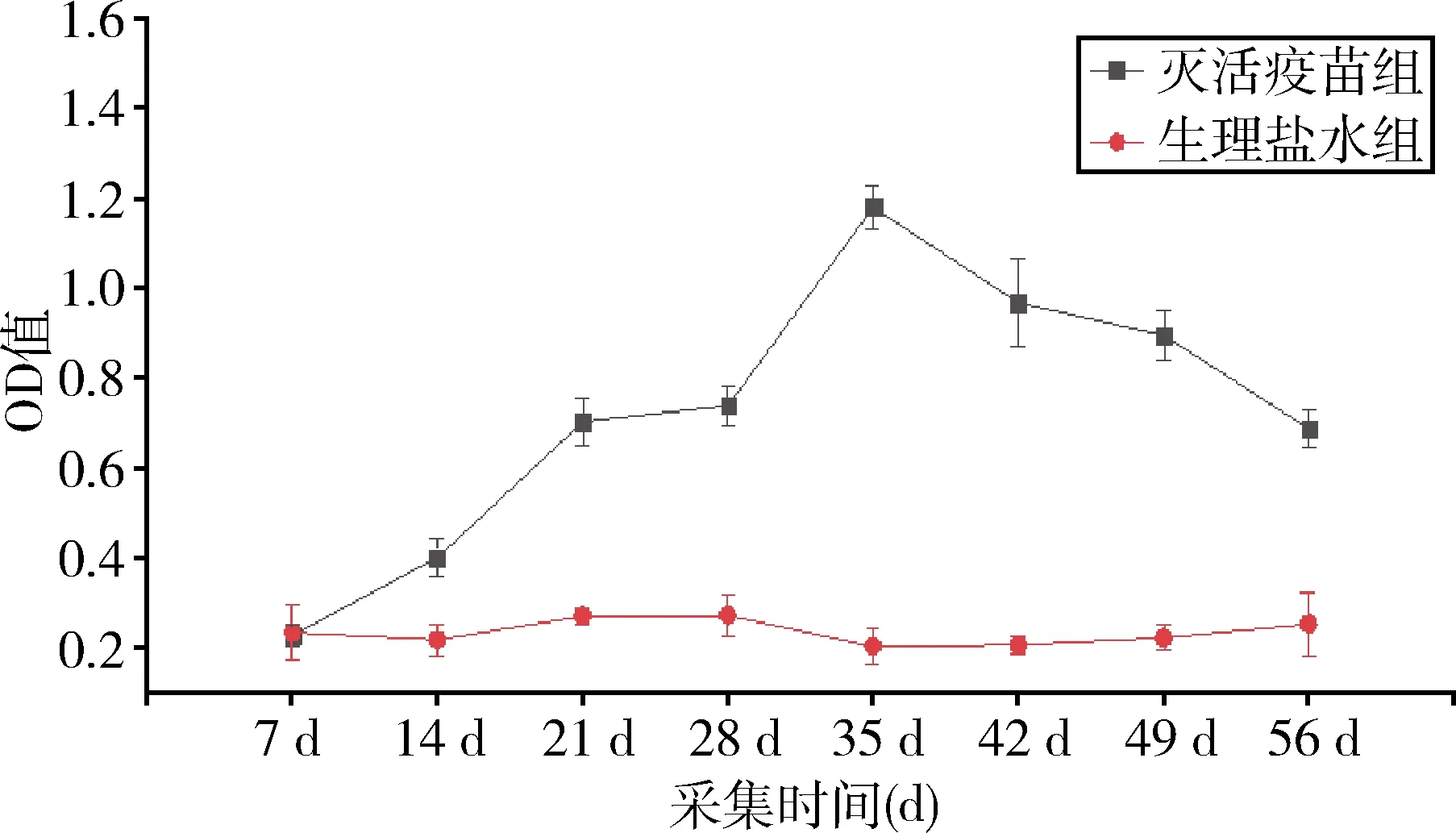
图6 雏鸭血清中RA特异性抗体检测
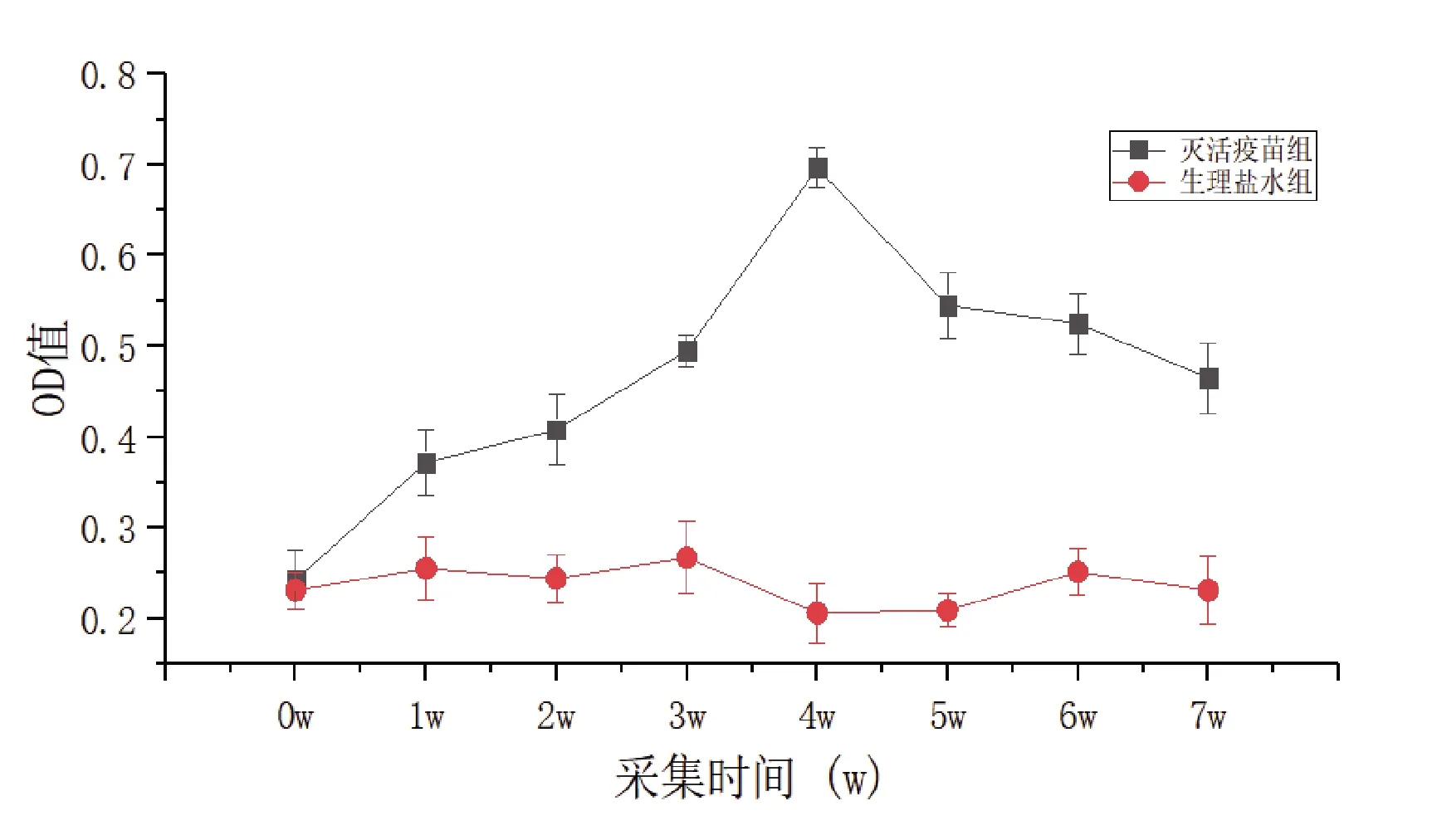
图7 鸭蛋卵黄中RA特异性抗体检测
3 讨论与结论
RA病是目前危害水禽养殖产业最主要的细菌源传染病之一,RA传播性和致病性强,患病鸭感染后死亡率高、生长缓慢且治疗难度增大,对水禽养殖产业打击巨大[9]。使用抗生素是治疗该病的主要措施,而滥用抗生素致使RA易产生多重耐药,甚至造成药物残留,严重危害环境和人类健康[10]。出于对耐药性和食品安全性等问题的考虑,采用疫苗免疫预防该病仍是当前最为安全、有效的途径[11]。因此,在临床上检测鸭群中RA抗体是有必要的,通过抗体检测可以判断鸭场中RA抗体水平,从而制定有效的防控措施。间接ELISA方法是检测RA抗体的重要手段,但由于目前商品化的试剂盒多以裂解菌体或脂多糖作为抗原,而血清中存在较多针对血清型相关的特异性抗体,血清型针对性较强,使检测结果易出现假阴性或假阳性[12]。实验室前期使用江苏某公司鸭疫里氏杆菌(RA Ab)ELISA试剂盒检测灭活疫苗免疫鸭血清抗体,检测结果均为阴性。因此,建立一种临床检测不同血清型RA抗体的间接ELISA方法非常有必要。
外膜蛋白A(OmpA)是细菌外膜蛋白的主要组成成分,在维持细菌结构的完整性、参与黏附侵袭宿主和逃逸宿主防御机制中发挥重要作用[13]。近年来研究表明OmpA是RA各血清型共有的外膜蛋白,并且具有很高的保守性与很强的抗原性[14]。余波[15]等基于鸭疫里默氏杆菌OmpA基因构建的真核表达质粒pVAX1-OmpA,通过免疫雏鸭后表明该质粒能够诱导鸭机体产生RA特异性抗体,并且具有较强的免疫保护效果。Yang等[16]将鸭IgY Fc基因与RA的OmpA基因融合真核表达,并转化毕赤酵母重组表达,免疫雏鸭后能够显著提高血清抗体滴度,具有良好的免疫效力、保护性及安全性。因此本研究构建了pET32a-OmpA的原核表达质粒,成功表达了OmpA重组蛋白,并以该蛋白为抗原初步建立ELISA方法,通过特异性、敏感性、重复性试验表明本研究建立的间接ELISA方法特异性强,敏感性高,重复性好。应用本方法检测2020年9月到2021年9月贵州省120份鸭血清样本5中7份血清样本为阳性,阳性率为47.5%。76份鹅血清样本中17份血清样本为阳性,阳性率为22.4%。应用该方法检测灭活疫苗免疫后的鸭血清和卵黄抗体,结果符合灭活疫苗消长规律。
现今各养殖场面对RA的感染,均出现在对抗生素耐药的情况,感染后很难治疗[17],因此预防和早期检测对于RA的广泛爆发具有重要作用,试验研究结果表明,OmpA蛋白间接ELISA检测RA抗体效果明显,对无抗养殖技术的推广普及提供了强有力支持。
