狂犬病毒G蛋白原核表达及间接ELISA检测方法的建立
2022-07-01张莹辉杜吉革陈小云印春生
张莹辉,朱 真,杜吉革,薛 麒,陈小云,冯 宇,印春生
(中国兽医药品监察所,北京 100081)
狂犬病是由狂犬病毒(Rabies virus,RV)引起的侵犯中枢神经系统的人畜共患传染病,发病后致死率几乎为100%[1]。RV入侵宿主后能够在宿主体内大量复制,进而转移至中枢神经系统而使其发病,狂犬病常见的临床症状包括神经兴奋、意识障碍等,最终全身麻痹死亡[2]。我国是受狂犬病危害较为严重的国家,其发病率仅次于印度,年均有2000~3000人因狂犬病死亡。该病在我国法定上报的传染病中位列前三[3]。
RV属于弹状病毒科(Rhabdoviridae)狂犬病毒属(Lyssavirus),是一种具有包膜的单链负股RNA病毒。它具有5种主要的结构蛋白,分别是核蛋白(N)、磷蛋白(P)、基质蛋白(M)、包膜糖蛋白(G)和依赖RNA的RNA聚合酶(L)。其中G蛋白位于病毒的囊膜外,是目前发现唯一可以刺激机体产生中和抗体的蛋白抗原[4-5]。通过基因重组表达的G蛋白可用于制备狂犬病亚单位疫苗,这在许多国家都已经有所应用。除此之外,G蛋白作为抗原还可以用于RV血清抗体的检测。
本研究拟采用pET-32a作为表达载体,使用大肠杆菌表达系统,对G蛋白进行优化表达,并对表达出的G蛋白进行纯化、鉴定,建立以G蛋白为抗原的间接ELISA方法,以期为RV血清抗体测定和单克隆抗体筛选提供依据。
1 材料和方法
1.1 试验材料 RV CVS-11株由中国兽医药品监察所提供;pET-32a原核表达载体、Vero细胞均为本试验室保存;pMD-18T平末端载体、大肠杆菌JM109感受态细胞、DH5α感受态细胞和Rosetta(DE3)感受态细胞均购自TaKaRa公司。
1.2 主要试剂 Premix ExTaqDNA聚合酶购自TaKaRa公司;XhoI和EcoR I DNA限制性内切酶、T4DNA连接酶购自美国NEB公司;病毒RNA提取试剂盒、反转录试剂盒、胶回收试剂盒、质粒DNA小量提取试剂盒购自美国Omega Bio-Tek公司;抗His标签单克隆抗体、HRP标记的羊抗鼠二抗均购自美国Sigma公司;HRP标记的兔抗小鼠IgG、HRP标记的羊抗犬IgG购自赛默飞世尔科技(中国)有限公司;IPTG、氨苄、卡那霉素购自天根生物有限公司。
1.3 目的基因的克隆
1.3.1 引物设计 根据GenBank中所提供RV的G蛋白基因序列(NCBI号:NC_001542.1),使用Primer5软件设计上下游引物各一条,其中上游引物G-F/EcoR I序列为CGGAATTCATGGTT ̄CCTCAGGTTCTTT,下游引物G-R/XhoI序列为CCCTCGAGTCACAGTCTGGTCTCGCC,其中斜体部分为保护碱基,下划线部分为酶切位点,由生工生物工程(上海)股份有限公司进行合成。
1.3.2 总RNA提取及目的基因片段扩增 使用OMEGA病毒RNA提取试剂盒对RV细胞液进行总RNA提取,使用反转录试剂盒利用下游引物G-R/XhoI获得cDNA,并以cDNA为模板进行PCR扩增目的片段:cDNA 1 μL、上下游引物各1 μL、Premix ExTaq酶25 μL、双蒸水22 μL,混匀后94 ℃ 预变性5 min,95 ℃ 10 s、55 ℃ 30 s、72 ℃ 1 min,32个循环,72 ℃ 10 min,扩增后进行聚丙烯酰胺凝胶电泳鉴定目的条带并进行胶回收。
1.3.3 目的基因测序鉴定 将胶回收后的目的片段连接到pMD-18T平末端载体上,得到pMD-18T-G并将其转化至JM109感受态细胞中,挑取菌落进行PCR鉴定,将鉴定连接成功的阳性克隆菌进行测序并扩增(测序由中美泰和生物技术公司完成)。
1.4 G蛋白的表达及纯化
1.4.1 表达载体的构建 将测序成功的目的基因用XhoI和EcoR I DNA限制性内切酶酶切后,使用T4DNA连接酶与同样进行双酶切的pET-32a载体连接,并转化至大肠杆菌DH5α中,转化后使用含有氨苄西林的选择性LB琼脂培养基37 ℃过夜进行培养,挑取单菌落进行扩大培养并进行菌液PCR鉴定,对鉴定成功的菌液进行质粒提取,送至中美泰和生物技术公司测序。将测序正确的质粒转化至大肠杆菌BL21(DE3)感受态细胞中,经菌液PCR鉴定成功后将该质粒命名为pET-32a-RVG。将表达菌扩大培养后冻存于-80 ℃备用。
1.4.2 G蛋白的表达 将活化后的表达菌接种到10 mL含有Amp抗性的LB肉汤培养基中,37 ℃ 200 r/min 摇菌过夜,第2天以1%的比例接种于50 mL含有Amp抗性LB肉汤培养基中,37 ℃ 200 r/min,4 h后每隔30 min 取100 μL 菌液进行OD600nm测定,直到OD600nm值达到0.5~0.6,停止摇菌。取出1 mL菌液作为未诱导对照,再加入终浓度为1.0 mmol/L的诱导剂IPTG,在合适的诱导温度下继续培养,诱导结束后收集菌液,将未诱导和诱导后菌液均离心后弃去上清培养基,加入无菌PBS重悬沉淀,进行超声波裂解,直至溶液清亮,10000 r/min离心5 min,分别收集裂解后的沉淀和上清进行SDS-PAGE电泳鉴定。
1.4.3 G蛋白的纯化及鉴定 将鉴定正确的包涵体蛋白进行SDS-PAGE电泳后,对所需的条带进行切胶回收,具体操作是将电泳后的蛋白胶浸泡在0.25 mmol/L的KCl溶液中约5 min,同时将蛋白Marker泳道和相邻蛋白样品泳道切下染色,观察胶块中的蛋白条带,并与Marker对照,将所需目的蛋白条带切下,用PBS清洗2次,将胶块在洁净密封袋中碾碎,加入一定量的PBS溶液,置于4 ℃冰箱中过夜,12000 r/min离心10 min,得到纯化后的G蛋白。对纯化后的蛋白使用BCA蛋白浓度测定试剂盒进行浓度定量测定,并使用SDS-PAGE电泳和Western Blot进行鉴定。
1.5 间接ELISA检测方法的建立
1.5.1 抗血清的制备 使用狂犬病国际标准疫苗以每次每只200 ng的量免疫10只Balb/c小鼠,共免疫3次。初次免疫使用弗氏完全佐剂对疫苗进行乳化,以后每隔2周加强免疫一次,加强免疫时使用弗氏不完全佐剂对疫苗进行乳化。从首次免疫后第一周开始,每两周收集一次小鼠血液,共收集5次,分离并混合血清,此血清作为阳性标准血清。同时取空白的Balb/c小鼠血清作为阴性标准血清。
1.5.2 间接ELISA方法建立 将纯化后的G蛋白作为抗原以不同的浓度包被于固相载体上,封闭后使用1.5.1中得到的阳性标准血清和阴性标准血清作为一抗与包被抗原结合,洗板去除未结合物,再加入HRP标记的羊抗鼠酶标抗体,最后通过加入能与酶反应的底物显色,通过读取OD450nm值进行定量判断。
1.5.2.1 抗原最佳包被量及一抗最佳稀释比例的确定 使用交叉实验的方法:将纯化后的G蛋白抗原按照1 μg、500 ng、250 ng、125 ng、62.5 ng、31.25 ng、15.625 ng、7.8125 ng每孔的量包被到酶标板中,每孔100 μL;将阳性血清、阴性血清分别进行1∶50、1∶100、1∶200、1∶400倍稀释,每孔100 μL。操作步骤按照常规间接ELISA方法进行。
1.5.2.2 酶标二抗稀释度优化 将HRP标记的羊抗鼠IgG酶标抗体用PBS进行1∶1000、1∶2000、1∶4000、1∶8000、1∶16000倍稀释。按照常规ELISA方法进行,根据试验结果确定酶标抗体的最佳使用浓度。
1.5.2.3 底物显色时间优化 使用TMB底物在室温下避光显色5、10、15和20 min。按照常规ELISA方法进行,根据试验结果确定显色时间。
1.5.2.4 封闭条件优化 分别使用1%脱脂乳、5%脱脂乳、1%BSA、5%BSA进行包被抗原的封闭,同时设置4 ℃ 封闭过夜、37 ℃ 封闭2 h的封闭条件,按照常规ELISA方法进行,根据结果确定试验最佳封闭条件。
1.5.3 间接ELISA方法阴阳性临界值、敏感性和特异性鉴定以及标准曲线的确定
1.5.3.1 阴阳性临界值的确定 使用此方法检测30份空白小鼠血清,计算血清OD450nm值的平均值和标准方差,并根据公式(阴阳性临界值=平均值+3×标准方差)计算阴阳临界值。
1.5.3.2 敏感性试验 按照1∶4000、1∶8000、1∶16000、1∶32000倍倍比稀释狂犬病病毒阳性血清,依次加入到包被好G蛋白抗原的ELISA板中,根据阴阳性临界值确定能够检测为阳性结果的稀释度,来确定方法的敏感性。
1.5.3.3 特异性试验 按照建立的间接ELISA方法,将狂犬病阴性血清和3份未免疫狂犬病疫苗小鼠的细小病毒阳性血清、3份犬瘟热病毒阳性血清进行检测,重复3次,根据待检血清和阴阳血清OD450nm值确定试验的特异性。
1.5.3.4 标准曲线的确定 使用FAVN法和犬的标准阳性血清对ELISA方法中小鼠标准阳性血清的效价进行测定,然后对小鼠标准阳性血清进行梯度稀释,测定其对应的OD450nm值,以OD450nm值为x轴、稀释度对应的阳性血清效价为y轴,绘制出表示两者线性关系的标准曲线。
1.5.4 方法与荧光抗体病毒中和试验(FAVN)法对比 使用已经建立的ELISA方法和FAVN方法分别对10份小鼠狂犬病阳性血清进行检测,分别计算出10份血清效价,比较两种方法的相关性。
2 结果与分析
2.1 G蛋白基因的扩增 以CVS-11株RV的cDNA为模版,用上下游引物进行扩增,扩增出G蛋白全长基因片段,大小为1575 bp(图1),符合预期大小。
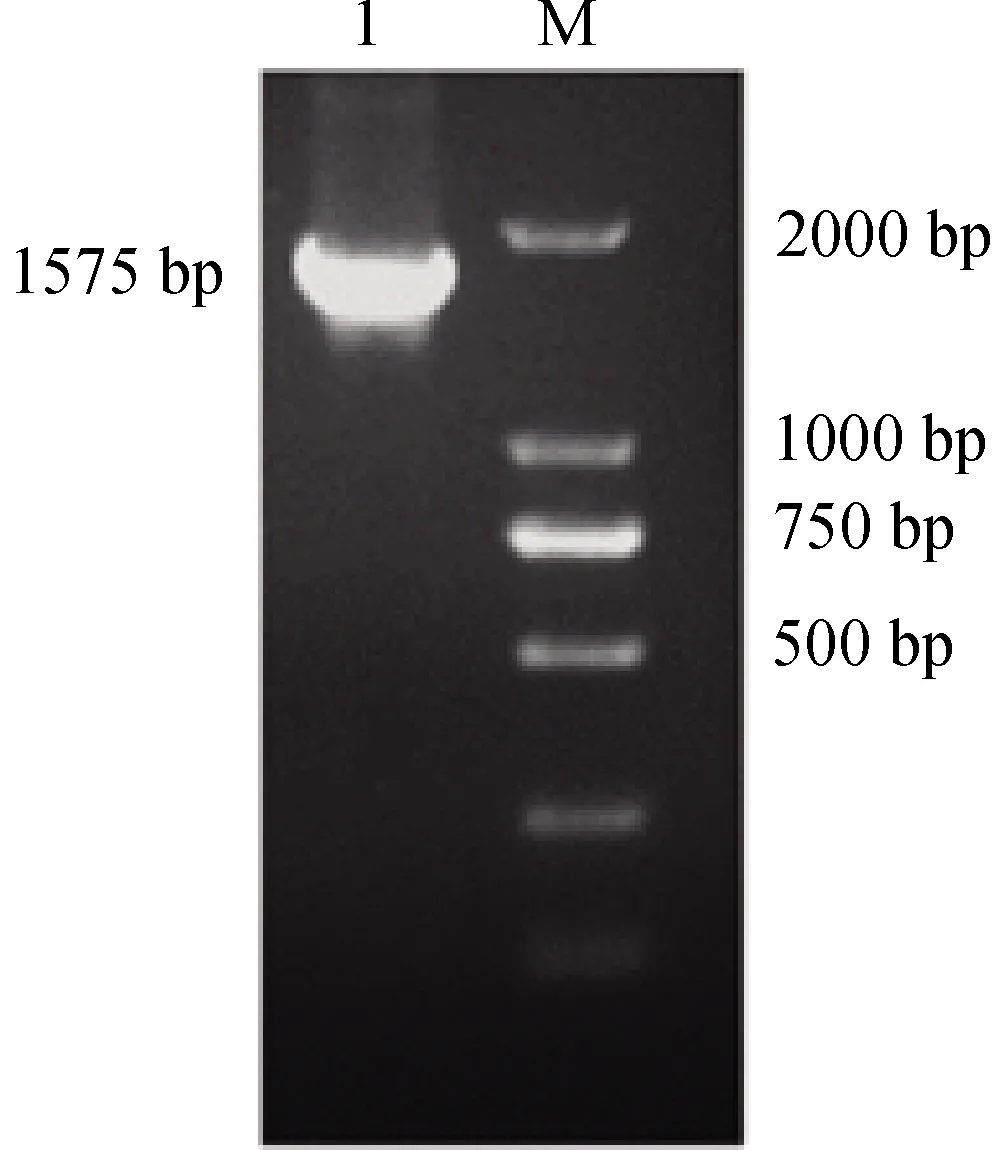
1: PCR product of G gene;M: DL2000 DNA Marker
2.2 G蛋白基因的克隆及鉴定 重组质粒pMD18-T-G经XhoI和EcoR I双酶切鉴定,得到1575 bp和2962 bp大小的两个片段(图2),证明G蛋白基因已经正确克隆到T载体上。

M: DL5000 DNA Marker;1: PCR product of G gene; 2: Double enzyme digestion product of pMD18-T-G
2.3 重组表达质粒pET-32a-G的构建及鉴定 用XhoI和EcoR I对目的片段进行双酶切后连接于酶切后的pET-32a载体上,对质粒进行双酶切鉴定,得到1575 bp和5900 bp大小的两个片段(图3),鉴定正确后送测序,测序结果正确。pET-32a-G构建成功。

M: DL5000 DNA Marker; 1: PCR product of G gene;2: Double enzyme digestion product of pET-32a-G
2.4 重组表达蛋白SDS-PAGE鉴定及其可溶性分析 重组菌经诱导表达后,在62 kD附近出现目的条带(图4),且多存在于包涵体沉淀中,表明蛋白以包涵体形式存在。

M: Protein Marker;1: Supernatant of pET-32a-G;2: Inclusion bodies of pET-32a-G
2.5 重组表达蛋白的纯化及其鉴定 对切胶纯化后的G蛋白进行SDS-PAGE电泳和Western Blot鉴定,结果显示纯化后的蛋白无杂蛋白,纯度较高(图5、图6)。
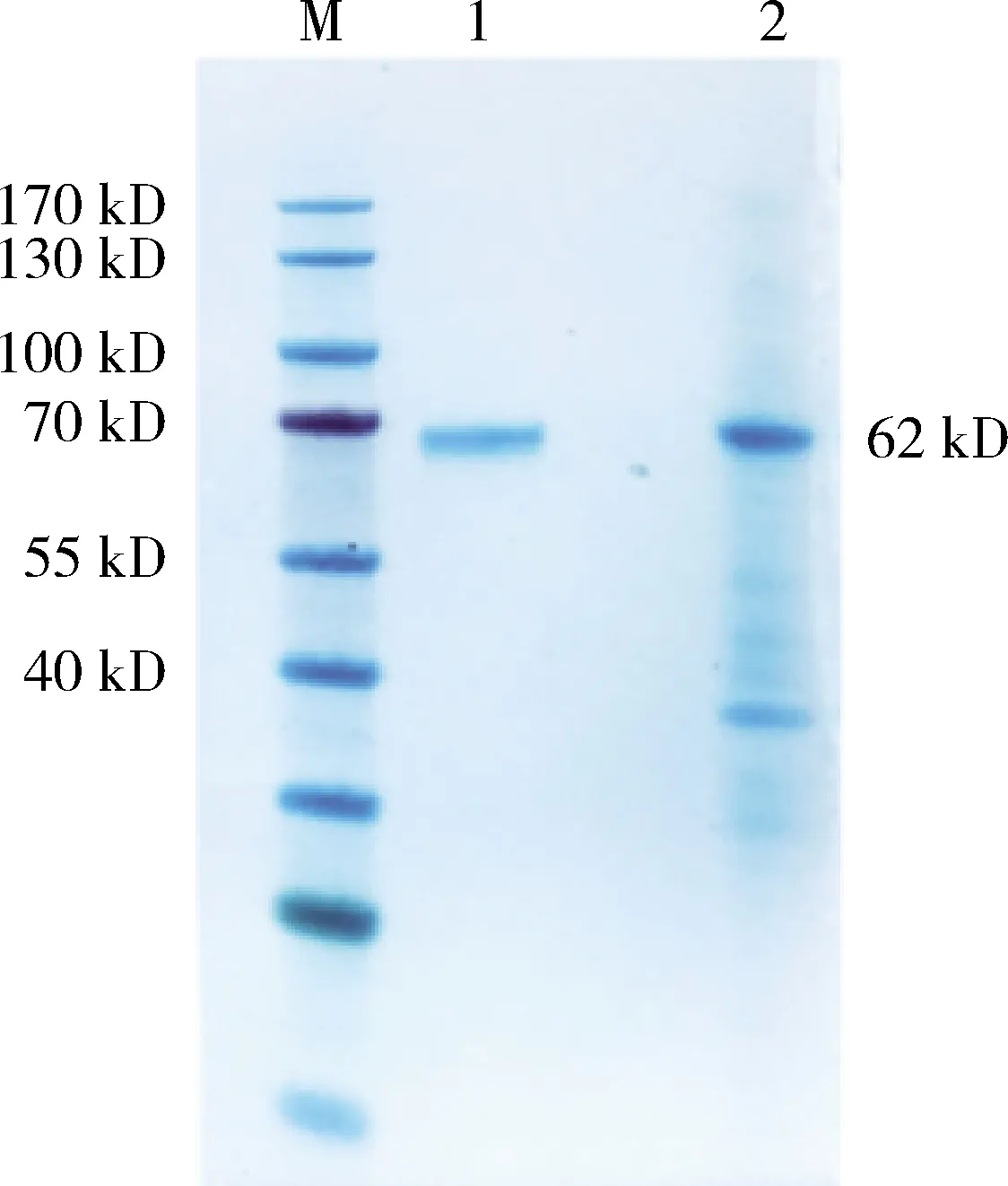
M: Protein Marker; 1: Purified protein; 2:Inclusion bodies

M: Protein Marker; 1-3: purified protein
2.6 间接ELISA最佳工作条件的确定 根据正交实验结果,当G蛋白抗原包被量为7.8125 ng/孔、血清稀释度为1∶100时,阳性血清接近1.0,此时阳、阴性血清OD450nm比值(P/N)最大。因此选择1∶100为最佳的阴阳性血清稀释度,7.8125 ng/孔为最佳的抗原包被量。使用4种封闭液分别封闭抗原,间接ELISA方法测定封闭效果,使用5%BSA作为封闭液时,阳性血清OD450nm值在1附近,且阳性、阴性血清OD450nm比值最高,故5%BSA为最佳封闭液。将HRP标记的羊抗鼠IgG抗体进行1∶1000、1∶2000、1∶4000、1∶8000倍稀释,按照间接ELISA方法测定阴阳性血清的OD450nm以及P/N值,酶标二抗的最佳稀释浓度为1∶8000。使用TMB底物显色液在避光条件下进行ELISA试验,分别在不同的时间终止显色,测定阴阳性血清OD450nm值,确定底物显色时间为室温下避光15 min。对已知的30份狂犬病病毒抗体阴性血清进行检测,计算OD450nm平均值为0.1648,标准差为0.0313,因此阴阳性临界值为0.2587。
2.7 ELISA方法敏感性试验 使用本试验建立的ELISA方法对不同稀释倍数的阳性血清样品进行敏感性检测。如表1所示,当血清在1∶16000倍稀释时,其OD450nm大于阴阳性临界值,且P/N值大于2。

表1 间接ELISA检测方法敏感性分析
2.8 ELISA方法特异性试验 用间接ELISA方法检测犬细小病毒小鼠阳性血清和犬瘟热病毒小鼠阳性血清,同时设置狂犬病病毒阳性血清、阴性血清和空白对照,试验结果如表2所示,犬细小、犬瘟热病毒以及空白小鼠血清OD450nm平均值均在阴阳性临界值之下,说明ELISA方法特异性较好。

表2 间接ELISA方法的特异性分析
2.9 ELISA方法标准曲线方程 使用ELISA方法以及已知效价的小鼠狂犬病阳性血清进行试验,如表3所示,以ELISA方法检测的血清中和抗体OD450nm值作为x轴,以已知的中和抗体滴度作为y轴,建立计算抗体滴度的标准曲线方程(图7),得出多项式方程y=0.839x2-1.1798x+0.51,其相关系数为0.98,接近1,表明两者的相关性较好。

表3 不同中和抗体滴度对应的OD450nm值

图7 不同中和抗体滴度对应的OD450nm值标准曲线
2.10 ELISA与FAVN试验结果比较 本试验中狂犬病病毒感染Vero细胞荧光照片如图8。当孔内出现类似如图所示的细胞内荧光显影时,即可将该孔判定为阳性,未出现细胞内荧光显影,可判定为阴性,如图9。
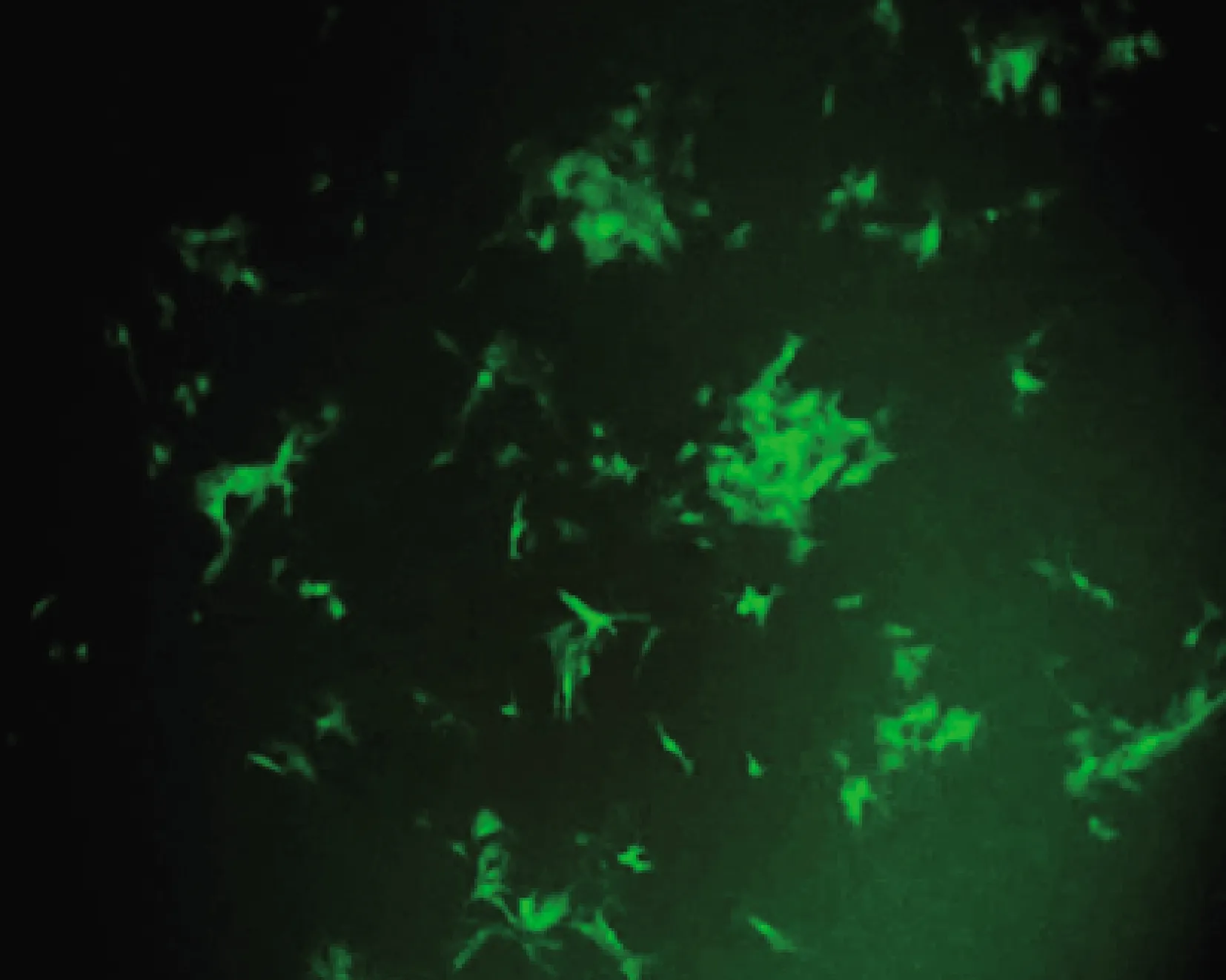
图8 CVS-11感染Vero细胞荧光图

图9 未被病毒感染Vero细胞荧光图
使用ELISA和FAVN方法检测10份阳性血清样品,分别计算其抗体含量,如表4所示,将两者的结果变化趋势以折线图表示(图10),计算两条折线的相关系数为0.986。两种方法检测10份血清的阳性率均为100%,表明本试验建立的ELISA方法与OIE推荐的FAVN法检测小鼠血清抗体效价具有较非常高的符合率。
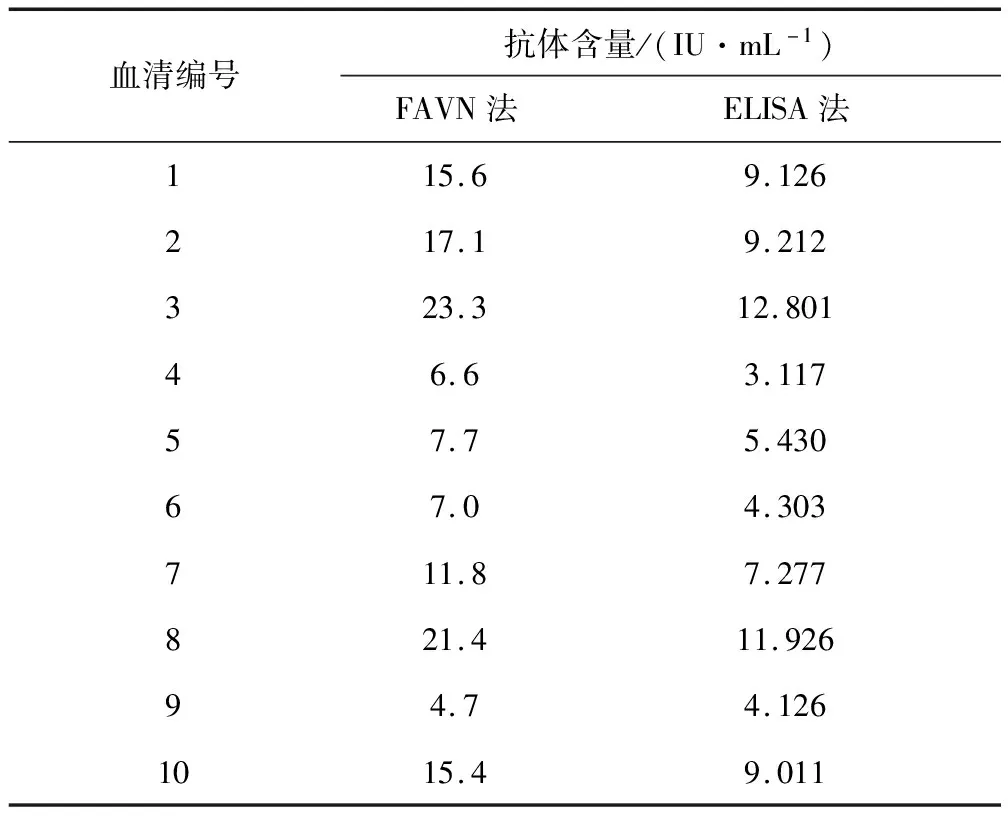
表4 FAVN法和ELISA检测10份血清样品的抗体含量

图10 ELISA和FAVN法检测10份血清样品中和抗体含量结果比较
3 讨 论
狂犬病严重危害着人类和动物的健康,我国是受其影响最严重的国家之一。目前针对人类的狂犬病,预防性接种和暴露后的接种是防治狂犬病的主要措施。狂犬病疫苗的使用效果需要通过免疫后的抗体效价监测来实现,目前WHO推荐的抗体监测方法为FAVN法,这种方法在试验过程中需要使用CVS-24毒株,存在一定的危险性[6]。而ELISA方法具有灵敏度高、快速、操作便捷、成本低的优点,除使用全病毒粒子之外,使用具有特异性抗体识别位点的G蛋白进行抗体的检测也具有一定的可行性[7]。RV中G蛋白的基因全长为1575 bp,由524个氨基酸组成,G蛋白与病毒的致病力有密切的关系,并且能够诱导细胞免疫,刺激机体产生对抗病毒的中和抗体。G蛋白是一种跨膜蛋白,具有三聚体结构,位于狂犬病病毒包膜和感染细胞的质膜中,包含胞质内区域,疏水性跨膜区域和胞外区域,三种单体的结合形成了三聚体[8]。研究表明G蛋白具有3个中和抗体结合位点,其中III号位点最为重要,是位于330~357位氨基酸序列,G蛋白变性后,III号位点随即消失,但除此之外,G蛋白还含有一些线性表位,这些表位不依赖于高级空间结构也能够存在,在变性的蛋白中能够存在,从而能够被抗体特异性识别。
本研究以原核系统表达的G蛋白作为包被原,使用免疫了狂犬病标准疫苗的小鼠血清作为阳性血清,以辣根过氧化物酶标记的山羊抗小鼠抗体作为二抗,摸索各个试验环节的最佳条件,最终建立了间接ELISA方法,可以用于检测小鼠血清样品中狂犬病病毒中和抗体的水平,也可以用于狂犬病病毒G蛋白单克隆抗体制备过程中,抗狂犬病病毒G蛋白抗体阳性杂交瘤细胞的筛选。本方法的特异性好,与常见的能够感染犬只的犬细小病毒和犬瘟热病毒均无交叉反应;本方法的敏感性高,在血清稀释度为1∶16000时仍然能够检测出阳性,这也说明虽然试验使用的包被抗原以包涵体形式存在,但其主要的抗原抗体结合位点并未受到空间构象的影响。
FAVN法具有很好的灵敏度和准确性,其结果在判定时较荧光灶试验受主观因素影响小,且试验周期较短,是广泛使用的抗体效价检测方法,也是国际公认的检测狂犬病病毒中和抗体的金方法之一[9-10]。使用荧光抗体病毒中和试验与本试验建立的ELISA方法同时检测10份小鼠血清,结果表明两种检测方法得出的结果相关性较好,阳性符合率为100%。进一步说明本试验建立的ELISA检测方法结果可靠。ELISA方法具有简便、快速、灵敏度高等优点,且对试验条件的要求低,相比于FAVN法,具有不用活毒、试验周期短、可检测样本量大等优点。因此ELISA方法更适用于疫苗效力检验中免疫小鼠血清中和抗体的测定。
本试验中使用G蛋白作为包被原建立的ELISA方法可用于检测小鼠血清抗体含量,也可用于狂犬病病毒G蛋白单克隆抗体制备过程中的阳性杂交瘤细胞筛选,当把本ELISA方法中辣根过氧化物酶标记的山羊抗小鼠抗体换作抗犬的抗体之后,经过优化试验条件,也可用于犬血清中狂犬病病毒中和抗体的检测,对疫苗免疫后的犬体内抗体含量变化情况进行监测,来评价疫苗的免疫效果[11]。
