家族性脑肿瘤多学科诊疗进展
2022-07-01贾牧原李泽刘羽阳刘嘉霖郑晓缺白云娟陈凌
贾牧原,李泽*,刘羽阳,刘嘉霖,郑晓缺,白云娟,陈凌
0 引言
家族性脑肿瘤疾病具有患病率低、临床症状隐匿复杂和确诊困难的特点,患者在接诊初期常常被误诊为散发性脑肿瘤,如何高效地通过多学科诊疗进行诊断是临床一线医生亟需学习的内容。本文总结常见家族性脑肿瘤疾病的颅内、颅外临床表现,通过思维导图的方式使读者们更加快速地形成诊断思路,结合相关研究进展阐述了各类家族性肿瘤疾病的管理办法并构建了相对应的多学科诊疗团队方案的思维导图。
1 家族性脑肿瘤概述
1.1 Ⅰ型神经纤维瘤病
Ⅰ型神经纤维瘤病(neurofibromatosis type 1,NF1)是由17q11.2的NF1基因致病变异所致,其标志性特征为多发咖啡色牛奶斑和神经纤维瘤。NF1患者的平均寿命为54.4岁[1]。NF1的经典发病顺序从咖啡牛奶斑、腋窝和腹股沟雀斑、Lisch结节(巩膜错构瘤)神经纤维瘤、骨发育不良症状至视路胶质瘤(optic pathway glioma,OPG)[2]。其中咖啡牛奶斑为早发症状,多见于1岁新生儿并且约有95%的NF1成年患者存在牛奶斑。NF1主要诊断方式为特征性临床诊断加基因检测,基因检测可用于证实有疑问病例的诊断,并帮助指导家族成员筛查。
1.2 Ⅱ型神经纤维瘤病
Ⅱ型神经纤维瘤病(neurofibromatosis type 2,NF2)是一种致病基因为NF2的多发性神经系统肿瘤综合征。患者常发病于20岁左右[3]。儿童期患者常出现眼球活动受限、无力、疼痛、视力下降,皮肤肿瘤或癫痫等症状。成年患者最常见的主诉症状是听力障碍和耳鸣。NF2最常见临床症状包括神经系统病变、眼部病变、皮肤病变[4]。NF2诊断依靠详尽的临床和家族病史、仔细的皮肤和眼部检查以及颅脊轴MRI检查。对于家族史阳性(包括识别出了NF2突变)的患者,需要进行分子检测发现是否存在突变。
1.3 施万细胞瘤病
施万细胞瘤病又称神经鞘瘤病,是第3种神经纤维瘤病,以多发性神经鞘瘤为特征,与NF2区别点在于不伴双侧前庭神经鞘瘤。在分子水平上,施万细胞瘤病常见于抑癌基因SMARCB1和LZTR1失活并且在SMARCB1突变阳性时常合并其他基因突变,其中包括NF2失活突变和22号染色体的全部或部分长臂丢失[5]。慢性疼痛是患者最常见的主诉症状,通常疼痛与肿瘤的大小以及位置不相关,患者几乎均存在一个或多个周围神经鞘瘤,常见于上下肢,其中大约75%的患者存在脊神经鞘瘤,而腰椎节段最易受累[6]。除此之外,施万细胞瘤病患者发生其他恶性肿瘤风险可能增加,在SMARCB1基因突变情况下,同时存在儿童横纹肌样瘤、黑色素瘤[6]、胶质母细胞瘤[7]、恶性周围神经鞘膜肿瘤[6]等病例均有报道。
1.4 Li-Fraumeni综合征
Li-Fraumeni综合征(Li-Fraumeni syndrome,LFS)是一种由抑癌基因p53基因(TP53)种系异常引起的一种肿瘤易感综合征。LFS常见脑肿瘤、乳腺癌、肉瘤、肾上腺皮质癌等。流行病学调查中,约80%患者可见多系统恶性肿瘤,在儿童和男性成年患者中,常见骨肉瘤、肾上腺皮质癌、中枢性神经系统肿瘤(高级别胶质瘤、脉络丛癌和髓母细胞瘤)以及软组织肉瘤[8]。在成年患者中,绝经前的年轻女性患者罹患乳腺癌的风险较高,且该类患者更易出现人类表皮生长因子受体2(HER2)扩增[9]。
1.5 结节性硬化病
结节性硬化病(tuberous sclerosis complex,TSC)由TSC1和TSC2两种独立基因突变引起。TSC常以多系统、多器官、多种良性肿瘤为特征,多累及脑、心脏、皮肤、眼、肾脏、肺和肝脏。TSC患者通常患有一处或多处特征性的皮肤病变,常见的皮肤病变有色素脱失斑、血管纤维瘤、鲨鱼皮样斑、纤维斑块[10]。TSC患者早期症状为癫痫、认知缺陷和学习障碍,儿童患者常以孤独症就诊[11]。TSC诊断多依靠临床诊断和基因诊断,患者基因检测中TSC1和TSC2的突变均支持诊断。
1.6 林奇综合征
林奇综合征(Lynch syndrome)是由于少数DNA错配修复基因(MMR)种系突变所造成,或由于ERCAM基因缺失导致MSH2表达缺失引起。Lynch综合征遗传异质性较高,多种基因突变可导致疾病发生。Lynch综合征最常见于遗传性结肠癌(CRC),其中20%罹患CRC的患者具有至少一名一级亲属患CRC,其次Lynch患者罹患其他系统恶性肿瘤也多见,包括子宫内膜癌、脑胶质瘤、卵巢癌、胃癌、小肠癌、胆管癌、皮肤癌等[12]。
1.7 VHL综合征
VHL综合征(von Hippel-Lindau,VHL)综合征是与VHL基因变异有关,VHL基因产物为肿瘤抑制蛋白,具有许多重要细胞功能[13]。VHL综合征多表现为各系统内多种良、恶性肿瘤。VHL综合征在中枢神经系统中最常见病变是血管母细胞瘤,在患病群体中常累及约80%的患者,初次临床症状也多见与小脑共济失调和视网膜功能障碍[14]。
1.8 努南综合征
努南综合征(Noonan syndrome)是一种常见的常染色体显性遗传病,由Ras-MAPK通路中的多个基因引起,其中PTPN11被认为是Noonan综合征最主要的候选基因,Noonan综合征的发病率为1/1000~1/2500。在新生儿及儿童中,心面部的特征多为首发临床症状[15],家族性脑肿瘤类型及其特征,见表1。

表1 家族性脑肿瘤概述Table 1 Overview of familial brain tumors
2 家族性脑肿瘤颅内病变
在NF1中,中枢神经系统肿瘤常见于神经纤维瘤和视路胶质瘤(optic pathway glioma,OPG),其中视路胶质瘤常在患者3岁左右出现[2]。在NF1患儿中枢神经系统肿瘤OPG约占60%,其余视路外胶质瘤常发生于脑干。OPG常为低级别毛细胞型星形细胞瘤,可出现在视神经通路至视放射任意位置,其中视交叉及眼眶内最常见。在NF2中,颅内病变常见前庭神经鞘瘤、脑膜瘤、室管膜瘤,并且NF2中前庭神经鞘瘤常为双侧,并出现耳鸣、听力丧失。约有50%的NF2患者患有脑膜瘤,其特征以多发性脑膜瘤多见,其次NF2合并脑膜瘤常为非典型或间变型。在施万细胞瘤病中,颅内病变常见多发性神经鞘瘤、脑膜瘤和高级别胶质瘤。约5%患者出现脑膜瘤和高级别胶质瘤,并有研究表明,LZTR-1基因的突变可促进高级别胶质瘤生长[18]。在LFS中,颅内病变常见高级别胶质瘤和髓母细胞瘤[19]。在TSC中,最具有特征的颅内病变是室管膜下巨细胞瘤,患病率为5%~20%,患者诊断年龄常在10~30岁[20]。在Lynch综合征中,多见胶质母细胞瘤、星形细胞瘤和少突胶质细胞瘤[21]。在Noonan综合征中,颅内病变常见胶质母细胞瘤、间变星形细胞瘤、髓母细胞瘤、松果体母细胞瘤[22-23]。在VHL中,颅内肿瘤常见血管母细胞瘤,通常发生在小脑、脑干、脊髓或视网膜,也有少数出现在幕上位置,平均被诊断年龄为29岁[14]。上述介绍的家族性脑肿瘤颅内病变均为临床常见病变,见表2,这对于年轻的神经外科医生来说,进一步丰富了诊断思路并拓宽了诊断眼界。如何高效地识别、诊断和组建MDT团队也是当今神经外科医生需要学习的内容。
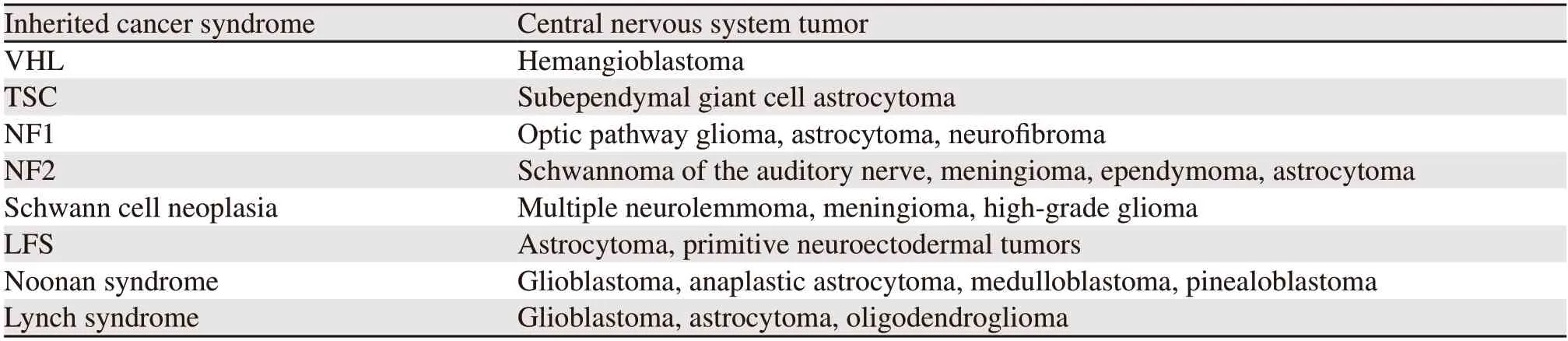
表2 家族性脑肿瘤颅内病变Table 2 Familial brain tumor intracranial lesions
3 家族性脑肿瘤颅外病变
在NF1中,颅外病变特征与首发症状年龄有关。0~2岁:常见咖啡牛奶斑、蝶骨翼发育不良、假关节病;2~6岁:常见腋窝雀斑、Lisch结节;6~10岁:常见脊柱侧弯、横纹肌肉瘤[24];青春期和成年:常见高血压病、乳腺癌、嗜铬细胞瘤等,并且因NF1基因患乳腺癌的恶性程度较大[25]。NF2中,颅外病变多见于眼部表现和皮肤表现。眼部症状多由于白内障、视网膜错构瘤、视神经脑膜瘤所导致的视力障碍。70%的NF2患者出现皮肤症状,常表现为斑块样、皮下结节[26]。20%~30%的施万细胞瘤患者出现皮下神经鞘瘤,数量通常不低于5个,触诊时皮肤可在肿块上自由滑动[27]。LFS患者中,绝经前女性常见乳腺癌,男性患者多见软组织肉瘤和骨肉瘤,横纹肌肉瘤多见5岁以下儿童,其次肾上腺皮质腺癌无论儿童和成年人都可见[9]。TSC患者中,81%~95%的患者存在特征性皮肤病包括叶状白斑、血管纤维瘤、鲨革样斑、前额特征性棕色纤维块、指(趾)甲纤维瘤。其中前额特征性棕色纤维块可用于诊断新生儿TSC,甲周和甲下的纤维瘤可能出现于青春期[28]。TSC可出现心脏横纹肌瘤、肾脏血管平滑肌脂肪瘤、肺部淋巴管平滑肌瘤病、视网膜错构瘤。肾脏血管平滑肌脂肪瘤进行性增大可影响肾功能,其病灶越大出血风险越高[29]。肺部淋巴管平滑肌瘤病在妊娠期可恶化致肺功能严重受限[30]。10%~47%Lynch综合征的患者患有CRC且卵巢癌、胃癌、小肠癌、肾盂输尿管癌的发病风险增加[31]。努南综合征患者颅外病变有先天性心脏病、身材矮小、颈部宽阔和蹼状、胸骨畸形、不同程度的发育迟缓、隐睾、出血倾向增加以及随年龄增长而演变的特征性面部特征[23]。通过学习、掌握常见的家族性脑肿瘤颅外病变临床表现联系常见颅内病变构成一套完整的诊断思路尤为重要,可以针对性地进行MDT团队组建,有效地提高MDT诊疗效率和用人成本。
4 家族性脑肿瘤多学科诊断思路
思维导图可以快速地利用图形形成一个思维路径,本文结合各类家族性脑肿瘤的颅内颅外临床症状和诊断标准构建了一个诊断思路的思维导图,见图1,可以使大家高效地诊断家族性肿瘤。
4.1 NF1多学科管理
NF1患者管理主要分为产前诊断和检测、治疗并发症。作为一种常染色体显性遗传病,NF1是完全外显的疾病,没有无症状携带者。那么患儿罹患Ⅰ型全身性神经纤维瘤病的风险为50%。当准父母中确诊了致病性NF1突变,需进行产前和植入前基因检测[32]。针对NF1的治疗目标是及早发现和治疗并发症。其中NF1的常见并发症有脑肿瘤、周围神经鞘瘤、骨骼异常、行为缺陷、嗜铬细胞瘤、白血病、胃肠道间质瘤。脑肿瘤常见毛细星形胶质细胞瘤和视路胶质瘤,毛细星形胶质细胞瘤提倡尽早手术切除治疗。一旦确诊为OPG,应进行连续的头颅MRI和眼科检查,通常在第1年每3个月进行1次,以评估肿瘤进展。最近,视路胶质瘤治疗重点已经转向保护视力,当出现视力恶化时,提倡使用化疗(卡铂和长春新碱)[33],需要注意的是放射治疗不适用于与NF1相关的视路胶质瘤,因为会增加发生血管病变和继发性恶性肿瘤的风险[34]。与NF1相关的周围神经纤维瘤患者常见主诉有:瘙痒、刺痛、疼痛、触痛、出血和美容问题,在大多数神经纤维瘤病专科诊所,周围神经纤维瘤的治疗手段包括手术切除、小病变的激光消融、电化、润肤剂(保湿剂)、伪装化妆和心理支持[35]。
4.2 NF2多学科管理
NF2患者需组建MDT团队诊治可能发生的多种并发症。MDT团队应至少包含神经外科、耳鼻喉科、放射科、神经内科、专科护士和遗传学医生[36]。对于已确诊患者随访应包括每年1次病史采集和体格检查,其中包括听力、眼科和皮肤检查。每年1次颅脑MRI检查并且应包括经内耳道的高分辨率增强成像。从10岁起开始每24~36个月1次脊柱MRI。若家族存在NF2先证者,有必要针对有风险的家族进行筛查和产前诊断。NF2患者最主要的并发症有前庭神经鞘瘤和脑脊髓膜瘤,治疗NF2个体前庭神经鞘瘤主要目的在于保留功能和维持生活质量。虽然贝伐珠单抗治疗特定病例有用,但是手术治疗仍为其主要的治疗手段。有回顾性病例系列研究和少量前瞻性单组研究支持贝伐珠单抗对NF2进展性前庭神经鞘瘤的疗效,可以诱导肿瘤缩小和听力改善,手术前使用贝伐珠单抗已作为一线药物治疗。对于NF2个体出现危及功能的快速生长性的脑脊髓膜瘤,应尽可能手术治疗。放疗被用于手术不能触及病灶或只能次全切的病灶[37]。
4.3 施万细胞瘤病多学科管理
施万细胞瘤病作为常染色显性遗传病,对于存在SAMRCB1或LZTR1种系突变的患者,遗传给下一代的风险为50%。如果家族中发现有基因突变,可通过全身MRI或者基因检测对无症状的家族成员进行筛查。建议施万细胞瘤病患者分别从10岁和15岁开始每2~3年复查1次脑和脊柱MRI[36]。疼痛是施万细胞瘤病最常见的症状,通常使用加巴喷丁或普瑞巴林结合短效阿片类药物或非甾体抗炎药控制爆发性疼痛。一般而言手术切除神经鞘瘤是患者最后手段,但应注意手术指征的把握。
4.4 Li-Fraumeni综合征多学科管理
Li-Fraumeni综合征多学科管理主要包括:家族基因检测筛查、癌症监测策略和肿瘤处理。对于已确诊TP53突变个体的家族可考虑进行易感性检测,对于风险妊娠需进行产前诊断。Li-Fraumeni综合征常见多器官恶性肿瘤,所以尽早进行癌症监测可有效延长患者生存期。监测主要包括1年1次体格检查(皮肤和神经系统查体);18~20岁的女性患者应每月1次乳房自检;1年2次医务人员临床检查和1年1次的影像学检查;25岁以上患者应接受2~5年1次肠镜检查;AACR指南推荐每年1次全身MRI检测并发症的出现。TP53突变患者肿瘤与非TP53突变肿瘤患者治疗方案一致。确诊TP53突变的乳腺癌患者提倡乳房切除术而非乳房肿瘤切除术加术后放疗。有研究表明,放疗可诱发女性患者乳腺癌复发和肿瘤发生风险[38]。
4.5 Lynch综合征多学科管理
Lynch综合多学科管理主要包括个体基因诊断、癌症监测、家族基因筛查咨询、并发症的处理。对于所有新诊断为CRC(遗传学非息肉性结直肠癌)患者且年龄低于70岁、60岁前发生子宫内膜癌的患者和家族中两代患有CRC的个体都应及时进行基因筛查。对于患有Lynch综合征的健康个体进行频繁和早期的结肠镜检查可以显著降低结直肠癌的发病率、结直肠癌相关死亡率和总死亡率。ASCO指南指出开始结肠镜筛查的最佳年龄是20~25岁。女性患者应尽早开始经阴道超声检查、子宫内膜活检和癌抗原125(CA125)肿瘤标志物检测[39]。大多数指南目前建议在生育结束或40岁出头时考虑降低风险的子宫切除术和输卵管卵巢切除术,并考虑在30~35岁时每年进行1次经阴道超声和子宫内膜活检直到降低风险的手术[40]。
4.6 结节性硬化病多学科管理
TSC病多学科管理主要包括家族基因检测筛查、肿瘤监测和对症处理。TSC患者多数被诊断为儿童期,由于TSC临床特征多样,时常出现无家族史的患儿,所以其父母也应进行基因筛查。即使父母智力正常且无发作癫痫史也不能排除诊断,并且其父母应接受全面的皮肤检查(Wood灯下)、眼科检查、颅脑MRI和腹部MRI(评估潜在的肾血管平滑肌脂肪瘤或肾囊肿)。如果家族中已有一名TSC患者,对于其家族准父母都应进行胚胎植入前或产前基因诊断。TSC的肿瘤监测如下:在TSC患者25岁前应每1~3年进行1次脑部影像学检查,用来监测室管膜下巨细胞瘤;婴儿期、学龄期、青春期和成年早期都应进行TSC相关的神经精神障碍评估[28];每年进行1次全面的皮肤检查并进行患者防晒教育(由于色素减退斑更易受到紫外线损伤,可能诱导血管纤维瘤恶化[41]);每3~6个月进行1次牙科检查(监测龋齿和口腔纤维瘤);每1~3年检查1次腹部MRI和肾功能检测;若产前诊断存在横纹肌腺瘤的患儿每1~3年进行1次心脏超声和心电图;每年进行完整的眼科检查,包括散瞳眼底检查。TSC治疗中最常见的是控制癫痫发作,提倡促皮质素作为TSC合并婴儿癫痫发作的首选治疗,奥卡西平推荐单纯性部分癫痫发作者使用[42]。上述抗癫痫治疗无效时可进行依维莫司辅助治疗和癫痫手术。TSC合并室管膜下巨细胞星形细胞瘤提倡尽早手术治疗[43],合并损容性皮肤病变可接受激光治疗以及外用mTOR抑制剂改善,合并认知行为问题时应及时就诊心理科进行个体干预教育计划。
4.7 VHL综合征多学科管理
VHL综合征多学科管理包括家族基因检测筛查、肿瘤监测和对症处理。VHL综合征作为一种常染色体显性遗传病,受累者有50%可能遗传给每个后代,所以其三级家属都应进行基因检测以明确家族史。肿瘤监测方案如下:0~4岁患者应进行眼科、神经科查体和每年检测血浆游离甲氧基肾上腺素水平;5~10岁在上述基础增加腹部超声检查和脑脊髓MRI,若出现听力下降、耳鸣、反复耳部感染史应每年进行耳听检查;10岁以上在上述基础增加每年1次腹部MRI评估肾脏、肾上腺和胰脏[44]。妊娠患者应在妊娠早中晚期均进行针对嗜铬细胞瘤检查,值得注意的是在妊娠第4个月明确颅脑脊髓情况,若存在病变则考虑行引产术[45]。血管母细胞瘤是VHL综合征最常见的病变,60%~84%的VHL综合征患者患有血管母细胞瘤,一项关于VHL的血管母细胞瘤回顾研究提示血管母细胞瘤具有不可预测性,强调了持续监测的必要性。在患者密切随访中,手术指征是出现神经功能影响或病灶加速生长,以此避免手术治疗相关并发症。不易切除的病灶可选用立体定向放射治疗[46]。VHL合并视网膜毛细血管血管母细胞瘤患者以保护视力治疗为主,提倡激光光凝术和冷冻疗法,有效率可达70%以上[47]。VHL合并肾囊肿或透明细胞癌与非VHL综合征合并的处理办法相同。对于已出现症状的嗜铬细胞瘤首选治疗办法是术前应用α-肾上腺素阻滞剂后手术切除肿瘤[48]。
4.8 努南综合征多学科管理
大多数患有Noonan综合征的成年人智力和身体能力是正常的,但有些人可能需要多学科评估和定期随访。大多数病例是散发的。在家族性病例中,常染色体显性遗传被证实。如果父母受到影响,受影响者的兄弟姐妹发生Noonan综合征的风险为50%,但如果父母不受影响,则低于1%。传染给受影响个体的后代的风险为50%。已知突变的家族性病例可提供植入前遗传学诊断[23]。努南综合征需要多系统多学科的联合管理,管理儿童努南综合征的关键方面是心血管监测和先天性心脏病的治疗,在青春期前需要进行生长激素和雌激素治疗以用于性发育和骨生长。生育能力和性发育通常是成年努南综合征患者需要管理的主要问题,孕前咨询和心脏超声心动图或磁共振成像(MRI)是备孕前必不可少的检查,除此之外还需要进行致动脉粥样硬化心血管危险因素(如高血压、糖尿病、高脂血症)的管理[49]。
5 总结与展望
家族性脑肿瘤患者常有头痛、耳鸣或局灶神经障碍等症状,神经外科医生常作为首要出诊医师,但由于各类综合征繁杂的临床症状且发病率偏低,常在临床上出现误诊的情况。本综述总结了几类常见的综合征,并使用思维导图的方式协助读者进行临床诊断思维构建。如何高效地识别和组建MDT团队进行诊疗和管理是当今临床医生重中之重。家族性脑肿瘤疾病主要治疗思路在于早预防、早诊断、早治疗,家族基因筛查和产前基因筛查均必不可少。目前对于家族性脑肿瘤疾病诊疗有以下待解决的问题:有效的治疗手段仍然有限、全组学基因测序费用较高、患者依从性不佳。未来可继续深入研究致病机制并重视MDT团队诊疗的优越性,最重要的是如何建立MDT团队与患者之间长期随访方式。
