磁共振成像在脑胶质瘤分级鉴别诊断中的应用价值
2022-06-30马庆友耿起龙王发芬
马庆友 耿起龙 王发芬
276500 山东省莒县中医医院影像科1,山东日照
276500 山东省莒县人民医院影像科2,山东日照
脑胶质瘤是源于中枢神经上皮的一类临床起病严重、预后差的颅脑肿瘤,约占所有脑肿瘤患者的50%[1-2]。根据临床分级,脑胶质瘤可分为Ⅰ~Ⅳ级,Ⅰ、Ⅱ级为低级别的颅脑胶质瘤,Ⅲ、Ⅳ级为高级颅脑胶质瘤,级别越高侵袭性越强,越危害患者的生命安全[3-4]。治疗方案也随着分级的不同而不同,正规的治疗和干预对延长患者生命有着重要的临床意义。因此,鉴别和区分脑胶质瘤的级别对于患者的治疗级预后至关重要。磁共振成像技术(MRI)具有软组织分辨率高、解剖背景清晰、无骨伪影及三维成像等优点,在诊断脑胶质瘤方面发挥了重要作用[5]。为探讨磁共振成像在颅脑胶质瘤分级鉴别诊断中的应用价值,本文收集96 例脑胶质瘤患者,对其磁共振成像鉴别诊断方面进行总结和分析,现报告如下。
资料与方法
选取2016年6月-2021年6月诊治的96 例脑胶质瘤患者,根据脑胶质瘤不同级别分为两组,分别为低级别脑胶质瘤组56 例和高级别脑胶质瘤组40 例。低级别脑胶质瘤组男30 例,女26 例;年龄29~67 岁,平均(52.5±4.5)岁;病程1个月~1年,平均(1.1±0.2)年;职业:工人18 例,农民7 例,个体12 例,公务员12例,无业7例。高级别脑胶质瘤组男23例,女17例;年龄31~66 岁,平均(52.4±4.4)岁;病程28 d~1年,平均(1.1±0.2)年;职业:工人10 例,农民3 例,个体13 例,公务员6 例,无业8 例。两组患者基本资料比较,差异无统计学意义(P>0.05),具有可比性。
纳入标准:①均符合脑胶质瘤的诊断标准;②自愿接受磁共振成像设备,对患者行颅脑横轴位T1WI、T2WI、T2_FLAIR 及DWI,和矢状位T1WI 磁共振平扫和横轴位、冠状位及矢状位增强扫描检查,且检查过程能够积极配合医务人员完成检查者;③患者临床资料完整,磁共振检查资料齐全,诊断确切;④自愿签署知情同意书者。
排除标准:①不能配合或不能主动配合进行磁共振检查者;②失去意识者;③伴有严重的精神疾患者;④磁共振检查资料不全者。
方法:使用西门子公司生产的Skyra3.0T 超导型磁共振成像设备,对患者行颅脑横轴位T1WI、T2WI、T2_FLAIR 及DWI,和矢状位T1WI 磁共振平扫和横轴位、冠状位、矢状位增强扫描,对比剂:二乙三胺五醋酸钆(Gd-DT-PA)。层厚:3 mm;矩阵:256 mm×256 mm;FOV:260 mm。常规扫描后,针对脑内正常区域、脑内病变区域,做氢质子磁共振波谱图像。
观察指标:观察患者行颅脑横轴位T1WI、T2WI、T2_FLAIR 及DWI,观 察矢状 位T1WI 磁 共振平扫和横轴位、冠状位、矢状位增强扫描结果,对N-乙酰天门冬氨酸(NAA)/肌酸(Cr)、胆碱(Cho)/Cr、Cho/NAA进行比较。根据瘤体边界、平扫信号不均程度、占位效应、区域水肿、囊变、坏死、肿瘤强化体积及接触脑室下区情况进行分析。
统计学方法:采用SPSS 24.0 统计学分析系统展开数据处理;计量资料用(±s)表示,采用t检验;计数资料用[n(%)]表示,采用χ2检验;以P<0.05 为差异有统计学意义。
结 果
不同级别脑胶质瘤磁共振表现:56 例低级别脑胶质瘤组中ADC高信号十分明显,DWI等信号25例,DWI 高信号31 例,高级胶质瘤ADC 低信号40 例,DWI 等信号12 例,DWI 高信号28 例。高级别脑胶质瘤磁共振波谱代谢产物比值:两组NAA/Cr 比较,差异无统计学意义(P>0.05);高级别脑胶质瘤组Cho/Cr和Cho/NAA 高于低级别脑胶质瘤组,差异有统计学意义(P<0.05),见表1。
表1 不同级别脑胶质瘤磁共振表现(±s)
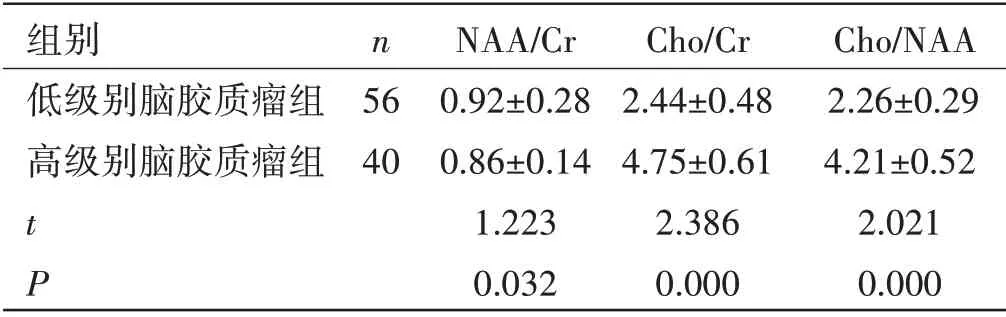
表1 不同级别脑胶质瘤磁共振表现(±s)
组别 n NAA/Cr Cho/Cr Cho/NAA低级别脑胶质瘤组 56 0.92±0.28 2.44±0.48 2.26±0.29高级别脑胶质瘤组 40 0.86±0.14 4.75±0.61 4.21±0.52 t 1.223 2.386 2.021 P 0.032 0.000 0.000
两组患者磁共振影像结果与脑胶质瘤级别的关系:高级别脑胶质瘤组患者病灶边界、平扫信号不均、占位效应、区域水肿、囊变、坏死、肿瘤强化体积及是否接触脑室下区方面明显重于低级别脑胶质瘤组,差异有统计学意义(P<0.05),见表2。

表2 两组患者磁共振影像结果与脑胶质瘤级别的关系
讨 论
颅脑结构复杂,内部空间狭小,若有病变发生,很容易压迫或侵袭脑组织,严重危害患者的生命安全。颅脑胶质瘤是目前脑部肿瘤的主要类型,多见于老年患者。有资料表明:脑组织发育异常、家族遗传、生活习惯不规律,以及有毒有害物质的长期接触是其致病的主要因素[6]。目前治疗最有效的方法是手术治疗,颅脑胶质瘤的分级是制定手术方案的主要依据,可见正确的临床分级意义极为重大[7]。低级别胶质瘤是细胞低速的分裂增生,高级别胶质瘤是高速的细胞分裂增生。随着磁共振等医疗技术的成熟,影像学鉴别颅脑胶质瘤成了新的研究热门课题,相对病理学诊断具有快捷有效的优点。研究表明,影像学检查表现为Cr稍微减低,NAA 下降,Cho上升,Cho/NAA倒置,在高级别与低级别胶质瘤之间,Cho/NAA 与Cho/Cr 上升趋势明显[8]。肿瘤不断恶化,呈加重趋势,Cho水平就会不断升高,浸润破坏高级别胶质瘤,增强肿瘤代谢能力。NAA这一指标能够良好反映出神经元状况,若是胶质瘤细胞,使神经元发生破坏、移位时,NAA 指标会随着胶质瘤不断升高的级别而明显减低。基于此,Cho/NAA与Cho/Cr在明确胶质瘤分级时,提供了较大的助力。另外脑胶质瘤组患者病灶边界、平扫信号不均、占位效应、区域水肿、囊变、坏死、肿瘤强化体积及是否接触脑室下区是区分颅脑胶质瘤患者级别的重要因素,与张光来等[9]报告的结果基本一致。
本组通过磁共振检查发现56 例低级别脑胶质瘤组中ADC 高信号十分明显,DWI 等信号25 例,DWI高信号31 例,40 例高级胶质瘤ADC 低信号十分明显,DWI 等信号12 例,DWI 高信号28 例。高级别脑胶质瘤磁共振波谱代谢产物比值:Cho/Cr和Cho/NAA增高,与高振辉[10]报告的结果基本一致。另外,在高级别脑胶质瘤组患者病灶边界、平扫信号不均、占位效应、区域水肿、囊变、坏死、肿瘤强化体积、是否接触脑室下区方面明显重于低级别脑胶质瘤组,与孙立智等[11]报告的结果基本一致。
综上所述,低级别脑胶质瘤组中ADC 高信号十分明显,高级胶质瘤ADC 低信号十分明显,不同级别的脑胶质瘤患者Cho/Cr 和Cho/NAA 存在较大的差异,脑胶质瘤组患者病灶边界、平扫信号不均、占位效应、区域水肿、囊变、坏死、肿瘤强化体积、是否接触脑室下区是区分颅脑胶质瘤患者级别的重要因素,磁共振成像可以鉴别颅脑胶质瘤患者级别,有助于指导临床选择合理的治疗方案并预测预后。
