MR 自动化测量对颞叶癫痫合并海马硬化的定量分析
2022-06-30胡洁申博兴李延静黄晓旗袁若涵贺程成郭敏
胡洁 申博兴 李延静 黄晓旗 袁若涵 贺程成 郭敏
颞叶癫痫(temporal lobe epilepsy,TLE)常合并海马硬化(hippocampal sclerosis,HS)[1,2],海马的病理学改变通常被认为是TLE 网络的主要致痫因素和重要节点[3]。海马体的渐进性硬化和瘢痕化最终可能发展为内侧颞叶硬化症(medial temporal sclerosis,MTS)[4],引发对侧癫痫发作和双侧病变[5],防止疾病进展是临床医师进行药物和手术干预的主要目标[6]。
既往研究应用扩散磁共振成像[7]、定量T1WI[8]、功能磁共振成像[9]等方法发现海马之间的组织差异是不对称的,这些序列由于成像时间较长,图像处理及数据分析过程繁琐,仍处于研究阶段。国内外学者对识别和开发便捷的HS 成像生物标志物的兴趣很高[9],这可以为尽早识别退化或变性的海马提供一定信息。人工智能和深度学习算法建立的神经影像全脑定量计算工具是当前的研究热点[10],本研究使用uAI-MR 脑结构智能分析系统(uAI Discover Brain,联影医疗科技有限公司,Version R001)测量TLE 患者的双侧海马体积。
资料与方法
1.一般资料
前瞻性纳入2020 年10 月~2021 年8 月在延安大学附属医院诊断的单侧TLE 患者50 例,HS的MR 诊断标准为海马萎缩、T2WI/FLAIR 信号增高和海马内部结构模糊,由两名神经影像学主治医师根据是否存在以上征象并结合内侧颞叶萎缩视觉评定量表(medial temporal lobe atrophy scale,MTA-scale)将患者分为HS(+)与HS(-)组[1],两位医师评估图像时采用双盲法,意见不一致时由一位副主任职称以上医师加入评估后3 人协商确定。癫痫定侧诊断依据神经生理学检查及视频脑电图。这50 例TLE 患者,根据视频脑电图癫痫定侧和是否合并海马硬化将患者又分为L-HS(+)、R-HS(+)、HS(-)三个亚组,分别为20 例、17 例和13 例,合并HS 的MTA 评分均大于等于1 级,未合并HS的MTA 评分均为0 级。对照组由30 名健康志愿者组成(表1)。
纳入标准:(1)符合国际抗癫痫联盟(International League Against Epilepsy,ILAE)和国际癫痫局(International Bureau for Epilepsy,IBE)[11]关于TLE的诊断标准;(2)视频脑电图(video-electroen cephalngram,V-EEG)显示单侧颞叶异常放电;(3)患者检查前24 h 内无癫痫发作。排除标准:(1)除海马以外的脑部病变的受试者、伴有遗传、精神或神经疾病(癫痫除外)的患者[12];(2)药物、酒精成瘾者、具有抑郁等情绪障碍及精神疾病而无法配合随访或扫描者。
本研究通过了延安大学附属医院伦理委员会审查(YAS-S01-202106001),所有受试者均签署知情同意书。
2.影像检查方法
使用Siemens Magnetom Verio 3.0 T MR 扫描仪进行海马薄层扫描和矢状位3D-T1WI 磁化准备快速获得梯度回波序列(3D-T1WI MPRAGE)序列扫描。(1)将3D-T1WI 数据传入uAI-MR 脑结构智能分析系统测量双侧海马体积及体积不对称指数(asymmetry index,AI)
AI=2×(左侧-右侧)×(左侧+右侧)
为确保自动测量的准确性,所有海马分割都经过一名神经影像主治医师审核,并在需要时手动调整界限。3D-T1WI MPRAGE 图像成像参数:TR 1900 ms,TE 2.48 ms,视野250 mm×250 mm,矩阵256×246,层厚1 mm,旋转9°。(2)海马扫描:采用海马薄层矢状位定位,平行和垂直于海马长轴进行轴位和斜冠状位的扫描,薄层扫描参数:TR 4000 ms,TE 381 ms,视野220 mm×220 mm,矩阵256×246,层厚0.9 mm;T2WI_tirm_tra/cor_dark_fluid序列(压水压脂轴位/冠状位)参数:TR 8500 ms,TE 94 ms,视野230 mm×230 mm,矩阵256×246,层厚3 mm。
3.图像分析
为检验人工智能软件的准确性,将3D-T1WI图像上传至图像后处理副台,由两名神经影像诊断医师逐层手动勾画海马区并叠加计算双侧海马体积,每人测量三次,取两名医师测量的平均值作为海马体积的金标准[13]和人工智能软件对比(图1)。
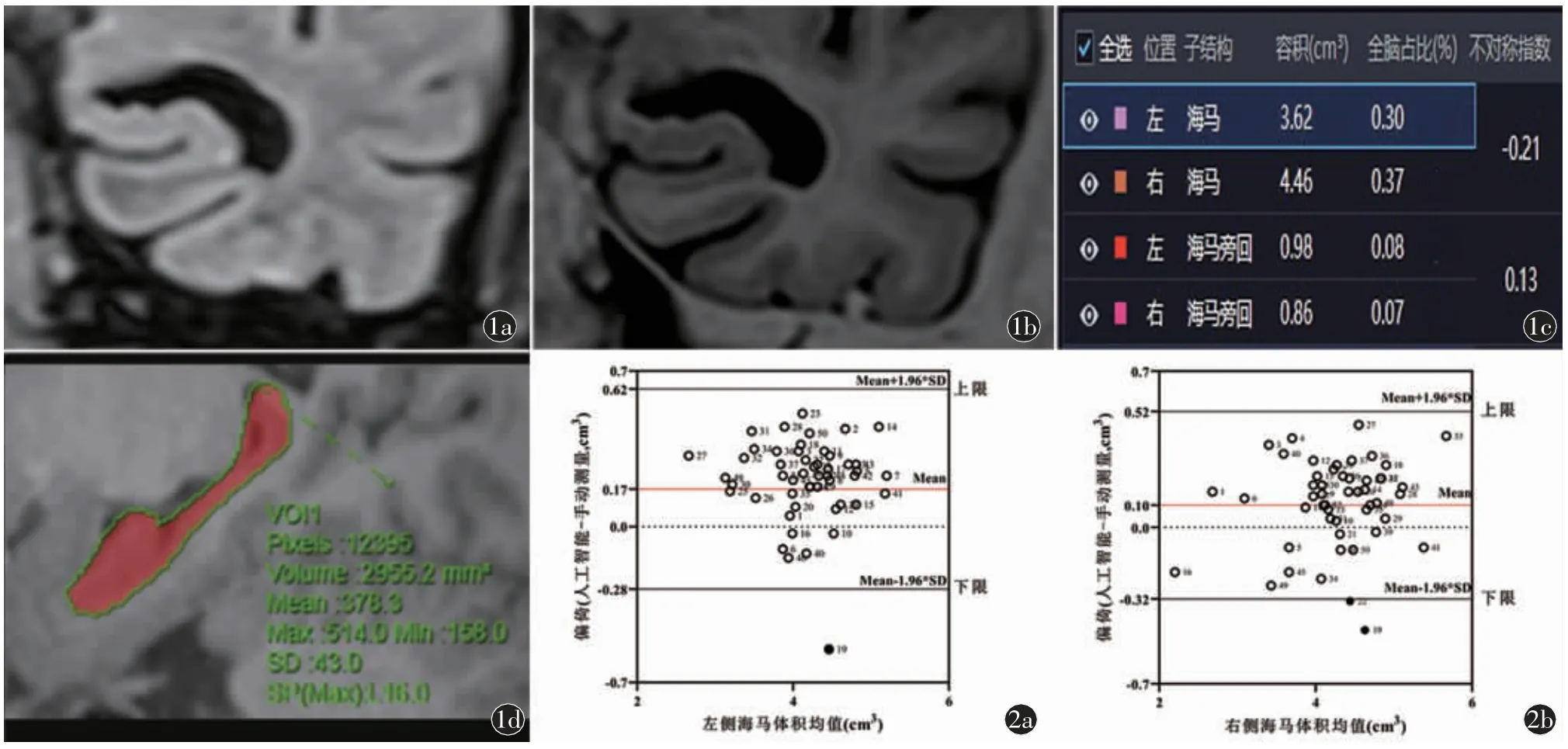
图1 男,64 岁,左侧海马硬化。a)左侧海马扫描FLAIR 序列冠状位;b)左侧海马扫描压水压脂序列冠状位,左侧脉络膜裂增宽,海马体积明显缩小;c)海马体积及AI 值的自动化测量结果;d)在3D-T1WI 序列上以手动测量结果作为金标准进行对比图2 人工智能MR 脑分割软件与手动测量海马体积的一致性检验
4.统计学分析
所有统计分析均使用SPSS 20.0 进行,计数资料以频数(百分比)表示,采用卡方检验进行分析。计量资料以均数±标准差()表示,符合正态分布的资料使用t 检验进行差异分析,不符合正态分布的资料使用非参数检验(Kruskal-Wallis H 检验、Mann Whitney U 检验、Wilcoxon 符号秩和检验)进行差异分析。MR 自动化测量与手动测量所得海马体积的相关性分析采用Spearman 法,一致性检验采用Bland-Altman 检验,以相关系数>0.75为强相关,<0.4 为相关性差,0.4~0.75 之间为一般相关。使用受试者工作特征(receiver operating characteristic curve,ROC)曲线评估海马体积、AI 值的诊断效能。P<0.05 为差异具有统计学意义。
结果
1.基线资料比较
HS(+)组、HS(-)组及对照组三组之间基本资料无统计学差异(表1)。
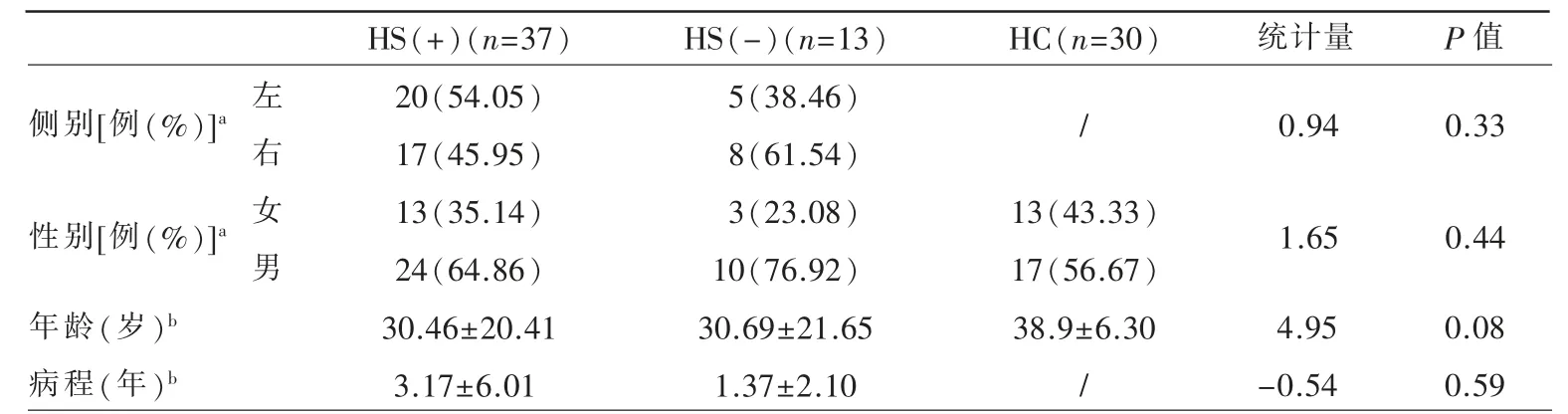
表1 受试者人口统计学信息与临床数据
2.MR 自动化测量与手动测量的结果比较
MR 自动化测量与手动测量所得的海马体积值相关性较强(表2),由Bland-Altman 图可知,有两个样本即4%(<5%)的样本超出了95%的一致性界限范围(左侧:-0.28~0.62,右侧:0.32~0.52),误差暂可接受,可认为人工智能MR 脑分割软件具备海马体积测量的准确性(图2)。

表2 MR 脑分割软件与手动测量所得海马体积的相关性分析
3.TLE 和对照组自身双侧海马体积组内比较
R-HS(+)组右侧海马体积小于左侧(P=0.00,图3a),L-HS(+)组左侧海马体积小于右侧(P=0.00,图3b),HS(-)及对照组双侧海马体积差异无统计学意义(P=0.15,P=0.12,图3c、3d)。
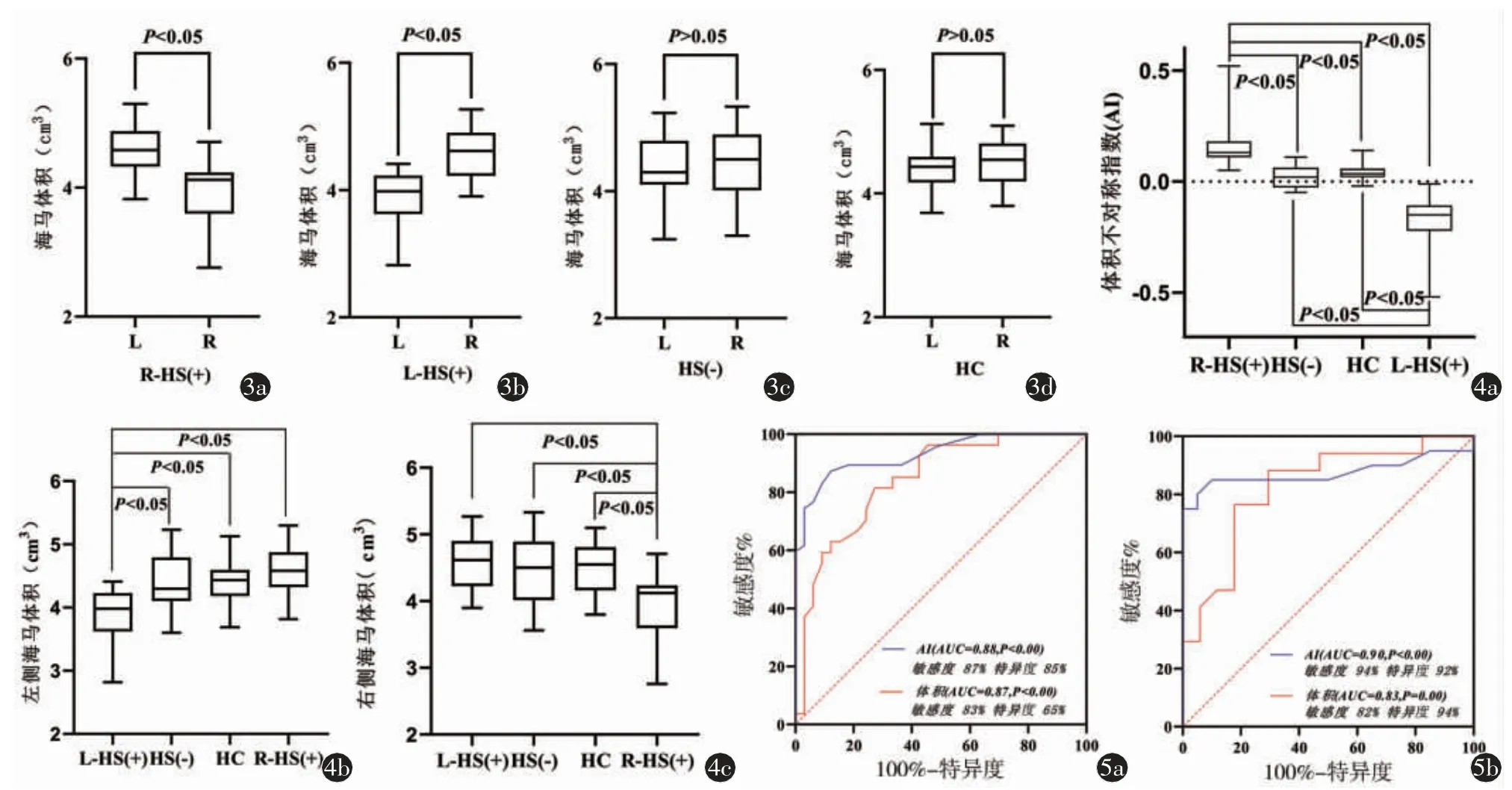
图3 TLE 患者及对照组双侧海马体积的比较图4 TLE 患者与对照组海马体积、AI 值的两两比较图5 TLE-HS(+)组体积及AI值的诊断效能分析
4.TLE 组及对照组的左侧、右侧海马体积和AI 值的组间比较
4 个亚组之间各指标的总体差异具有统计学意义(P 均=0.00,表3)。进行事后两两比较发现:L/R-HS(+)组的AI 值与HS(-)、对照组比较差异具有统计学意义(调整后P 均=0.00,图4a);L-HS(+)组的左侧海马体积较R-HS(+)、HS(-)及对照组小(调整后P=0.00,P=0.01,P=0.00,图4b),R-HS(+)组的右侧海马体积较L-HS(+)、HS(-)及对照组小(调整后P=0.00,P=0.02,P=0.00,图4c)。
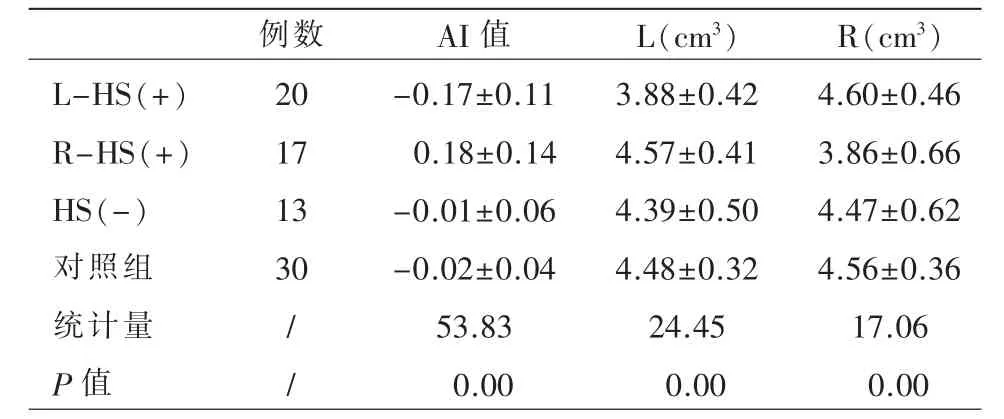
表3 受试者双侧海马体积及AI 值的多个独立样本总体比较
5.诊断效能分析
体积和AI 值对TLE-HS(+)的诊断效能分析显示:AI 值的曲线下面积(area under curve,AUC)最大,L-HS(+):AUC 为0.88(95%CI:0.78~0.98,图5a),临界值-0.05,R-TLE:AUC 为0.90(95% CI:0.77~1.00,图5b),临界值0.07。
讨论
本研究病例中视觉评估HS 占TLE 患者的74%,据Blümcke 报道[14],HS 是TLE 最常见病理学机制,术后病理中HS 的发生率从33.6%[15]~66%[16]不等。本研究所用的新型人工智能脑定量分析软件基于多图谱的三维深度卷积神经网络,通过对图像不同层次特征的抽取与重组可以全自动进行海马的分割,仅需上传3D-T1WI 图像即可实现自动化定量测定海马体积,程序相对简单,可重复性强,系统也支持医师在需要时手动调整海马解剖边界以达到精确描绘的目的。3D-T1WI 图像原则上要求薄层数据,1 mm 层厚为佳,非横断位数据层厚不大于3 mm。
1.MR 脑结构智能分析系统用于海马体积测量
本研究发现脑结构智能分析系统与手动测量所得的海马体积一致性较好且具有高度的线性相关关系:左右侧海马体积的相关系数分别为0.89、0.93。该系统克服了以往脑分割软件测量时间长、可重复性差等问题。虽然日常工作中医师经常通过MRI 目测是否发现海马硬化,但识别的准确性很大程度上取决于诊断医师的水平以及是否采用了合适的MRI 序列[17]。脑结构智能分析系统的引入能够准确、客观、快速地测量海马体积,为视觉评估提供重要的补充信息。
2.TLE 合并HS 者患侧海马体积缩小
本研究发现HS 患侧的海马体积缩小,HS 最主要的病理学改变是神经元细胞丢失和反应性胶质增生[18],这些因素是如何互相作用影响海马体积尚不明确,但反应性胶质细胞增生已被证明会导致正常细胞组织硬度增加从而引起形态学的萎缩[6]。所以有学者[19]将HS 称为Ammon 角硬化(Ammon’s horn sclerosis)。Masaki 等[20]在其研究中对海马CA1-4 区进行了建模和亚区的测量,发现视觉评估中HS 患者CA1-4 区体积均减少,以CA1 为主,而未合并HS 的患者仅在CA3 区发现了体积轻度下降的趋势,差异尚不具有统计学意义,这与本研究结果类似。此外,HS 也可能与海马形成初期时的发育异常有关,虽然传统的MRI 平扫是HS 活体检测的“金标准”,但MRI 定性和定量测量可能仍无法检测到病理意义上的轻度HS[21]。
3.TLE 未合并HS 者海马体积缩小并不显著
笔者尚未发现无HS 患者双侧海马体积的差异,但这也不能排除该群体海马内部的细微结构异常,既往有研究采用术中脑电图检测无HS 合并杏仁核体积增大的TLE 患者,发现在杏仁核切除后患者颅内依旧存在异常放电,直到海马切除后异常放电才消失[22]。此外,Scanlon 等[23]报道无HS TLE 患者中虽然海马体积萎缩不明显,但部分患者出现颞叶皮层的轻度萎缩,可能是由于颞叶脑区异常放电导致神经元缺血缺氧损伤,从而继发邻近脑组织的萎缩。扩大样本量,结合海马区建模[24]与自动化测量,以探究该类患者海马亚区的细微体积改变,应作为今后的研究内容。
4.海马体积和AI 值对TLE 并HS 的诊断效能
对TLE-HS(+)组的海马体积及AI 值进行诊断效能分析时发现,AI 值在诊断HS 时AUC 最大,推测该参数在量化双侧海马之间的不对称性时较单纯体积减少更敏感,以R-HS(+)为著。
张泽寅等报道[25],正常成年人存在轻度的右侧海马优势,故通常测得AI 值为负值,若患者为右侧HS,即右侧海马体积小于左侧,则所得结果就为正值,这可能使其在检测患者和对照组之间的群体差异时更加敏感。AI 值在HS 的诊断中作为一个比较易得的观察指标,有望成为与单纯体积测量互补的HS 影像生物学标志物。本研究尚未发现30 例对照组双侧海马体积的差异,原因可能是样本量较小。
本研究的局限性:首先,纳入病例为单中心数据,对该测量系统的泛化能力有待进一步验证。其次,自动化测量软件的可靠性依赖于3D-T1WI 数据,原始数据质量欠佳或体位不对称时仍需要医师手动调整边界。
综上所述,海马体积不对称指数在识别双侧海马的不对称性方面敏感度较高,可作为视觉评估的重要补充。
