丝氨酸/精氨酸蛋白激酶1在放射性肺纤维化中的作用及其机制研究
2022-06-29张旭涛张迁王瀚王斌刘峰舟吴侃阮柏张敏王小成
张旭涛,张迁,2,王瀚,王斌,2,刘峰舟,2,吴侃,阮柏,张敏,王小成,2
放射性肺纤维化(radiation-induced pulmonary fibrosis,RIPF)是临床上胸部肿瘤放疗后常见的一种严重并发症[1],其特点是肺组织内成纤维细胞持续活化,过度分泌胶原等细胞外基质(extracellular matrix,ECM),对肺组织造成不可逆破坏及导致肺功能恶化,最终导致患者呼吸衰竭甚至死亡[2]。研究表明,在RIPF发生过程中巨噬细胞发挥了重要作用,在放射性肺损伤前期即放射性肺炎阶段巨噬细胞以M1型极化为主,而在放射性肺损伤后期即RIPF阶段巨噬细胞以M2型极化为主[3]。M2型巨噬细胞可分泌转化生长因子β(transforming growth factor-β,TGF-β),从而刺激成纤维细胞活化,这是诱发RIPF的关键因素[4]。本课题组前期构建了一种新型抗纤维化多肽Ac-SDDKDP,发现其能够通过抑制丝氨酸/精氨酸蛋白激酶1(serine/arginine rich protein specific kinase 1,SRPK1)磷酸化来发挥抗肝纤维化、特发性肺纤维化的作用[5],但SRPK1与组织纤维化之间的关系尚不明确,SRPK1在RIPF中的作用亦不清楚。因此,本研究以SRPK1为突破口,重点研究SRPK1在RIPF中的作用及其机制,以期为RIPF的防治提供新的治疗策略。
1 材料与方法
1.1 实验时间 本实验时间为2021年3月至2022年2月。
1.2 实验动物 2月龄C57BL/6J雌性小鼠30只,平均体质量(20.2±8.1)g,购自空军军医大学实验动物中心。所有小鼠饲养在空军军医大学实验动物中心,且符合空军军医大学实验动物饲养条件,环境温度保持26 ℃,湿度为50%,噪声控制在60 dB以下,常规饲料饲养,饲养间的光照强度控制在15~20 LX,明暗交替为12 h/12 h。本研究通过空军军医大学伦理委员会批准。
1.3 实验材料 水合氯醛、4%多聚甲醛购自西安科昊生物工程有限责任公司,SRPIN340购自上海陶素生物科技有限公司,苏木素染色液、伊红染色液、ELISA试剂盒购自碧云天生物技术有限公司,Masson试剂盒购自北京雷根生物技术有限公司,羟脯氨酸试剂盒、CD45、精氨酸酶1(arginase-1,Arg-1)、SRPK1、α平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA)购自英国Abcam公司。
1.4 实验方法
1.4.1 分组及干预方法 将30只小鼠随机分为对照组、模型组和干预组,各10只。对照组小鼠不进行干预;模型组和干预组小鼠均构建RIPF模型,具体方法为:采用水合氯醛麻醉小鼠,采用铅板遮挡小鼠头部和腹部,仅保留胸部位置,进行X射线辐照,照射总剂量为17.5 Gy,剂量率为1.9 Gy/min[6]。建模成功后干预组小鼠腹腔注射SRPK1抑制剂——SRPIN340,800 μg·kg-1·次-1,3次/周;模型组小鼠给予相同剂量的PBS;两组均干预16周,其中模型组小鼠死亡5只,干预组死亡3只。干预结束后,处死各组小鼠并收集其全肺组织及肺泡灌洗液。
1.4.2 HE染色观察小鼠肺组织结构 取各组小鼠全肺组织,PBS冲洗后采用4%多聚甲醛固定24 h,EDTA脱钙,常规石蜡包埋,并将包埋标本切成4 μm的薄片,依次进行石蜡切片脱蜡至水、苏木素染色、伊红染色、脱水封固操作,采用显微镜随机选取10个不重叠的视野,放大20倍,观察肺组织结构。
1.4.3 Masson染色观察小鼠肺组织ECM沉积情况 取各组小鼠肺组织进行石蜡包埋、切片,随后进行脱蜡处理;切片依次用蒸馏水和去离子水进行冲洗,按照试剂盒说明书进行Masson染色:切片常规脱蜡、至水,核染液染色1 min,冲洗液冲洗30 s;质染液染色10 s,冲洗液冲洗30 s;分化液分色8 min;弃去分色液后直接用复染液染色3 min,采用100%乙醇溶液洗净浮色,二甲苯透明,中性树胶封固;采用显微镜随机选取10个不重叠的视野,放大20倍,观察肺组织蓝色染色区域情况即ECM沉积情况。
1.4.4 羟脯氨酸试剂盒检测小鼠肺组织羟脯氨酸水平称取各组小鼠肺组织100 mg,置于安瓿瓶,加入2.5 ml纯水和2.5 ml浓盐酸封瓶,置于105 ℃烘箱中水解18 h,采用滤纸过滤获得肺组织水解液。取10 μl肺组织水解液,加入10 μl内标溶液(10 mg/L),用72%乙腈水溶液定容至10 ml;取稀释液1 ml,15 000×g离心10 min,取上清液,采用羟脯氨酸试剂盒检测羟脯氨酸水平。
1.4.5 ELISA检测小鼠肺泡灌洗液中IL-6、IL-8、IL-13、TGF-β1水平 取各组小鼠肺泡灌洗液,用包被缓冲液稀释抗原至最适宜浓度(15 μg/ml),在微反应板每个凹孔中分别滴加0.3 ml溶液;在每个凹孔中加入用含有0.05%吐温的稀释缓冲液稀释的被检血清各0.2 ml,于37 ℃下作用1.5 h;在每个凹孔中加入稀释缓冲液稀释的酶结合物0.2 ml,于37 ℃下作用1.5 h;在每个凹孔中加入底物溶液0.2 ml,室温作用30 min;在每个凹孔中加入2 mol/L的H2SO4或2 mol/L的枸橼酸0.05 ml。用酶标比色计测定450 nm处的OD值,即IL-6、IL-8、IL-13、TGF-β1水平。
1.4.6 免疫荧光法检测小鼠肺组织CD45+T淋巴细胞计数 取各组小鼠肺组织,吸去组织液,用PBS洗2次;加入4%多聚甲醛,固定15 min;用PBS洗3次,5 min/次;加入0.3% TritonX-100破膜15 min;用PBS洗3次,5 min/次;加入5% BSA封闭液室温封闭30 min;用PBS洗3次,5 min/次;按1∶400的比例用PBS稀释CD45抗体,于4 ℃孵育过夜;用PBS洗3次,5 min/次;按1∶150的比例用PBS稀释FITC标记的二抗,室温孵育2 h;用PBS洗3次,5 min/次;加入DAPI孵育5 min,进行细胞核染色;用PBS洗3次,5 min/次。用共聚焦显微镜拍摄图像,采用Image J软件分析CD45+T淋巴细胞计数。
1.4.7 免疫组化法检测小鼠肺组织Arg-1、SRPK1、α-SMA表达水平 取各组小鼠肺组织进行石蜡包埋、切片,依次进行脱蜡至水、抗原修复、阻断内源性过氧化物酶、血清封闭、加一抗、加二抗、DAB显色、复染细胞核、脱水封固及显微镜镜检拍照等操作,采用Image J软件计算累积光密度,即Arg-1、SRPK1、α-SMA表达水平。
1.5 统计学方法 采用SPSS 18.0统计学软件进行数据分析。计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用Tukey法。以P<0.05为差异有统计学意义。
2 结果
2.1 肺组织结构 HE染色结果显示,对照组小鼠肺组织结构完整,肺泡结构清晰可见;模型组小鼠肺组织出现明显的损伤和结构紊乱,肺泡壁增厚扭曲,可见大量病灶形成;干预组小鼠肺组织出现轻微损伤,肺组织结构较模型组完整,肺泡壁增厚现象减少,见图1。
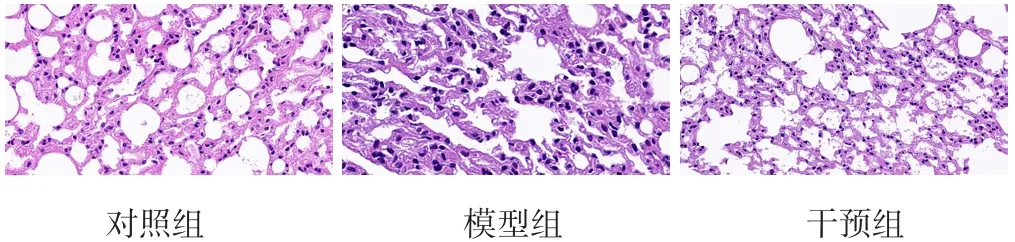
图1 HE染色观察各组小鼠肺组织结构(×20)Figure 1 The lung tissue structure of mice in each group observed by HE staining
2.2 肺组织ECM沉积情况 Masson染色结果显示,对照组小鼠肺组织仅见少量ECM沉积;模型组小鼠肺组织中出现大量ECM沉积;与模型组相比,干预组小鼠肺组织ECM沉积明显减少,见图2。

图2 Masson染色观察各组小鼠肺组织ECM沉积情况(×20)Figure 2 Deposition of ECM in lung tissue of mice in each group observed by Masson staining
2.3 肺组织羟脯氨酸水平 对照组、模型组、干预组小鼠肺组织羟脯氨酸水平分别为(512.7±165.2)、(1 765.4±432.1)、(987.0±231.6)μg/mg。三组小鼠肺组织羟脯氨酸水平比较,差异有统计学意义(F=37.920,P<0.001);模型组、干预组小鼠肺组织羟脯氨酸水平高于对照组,差异有统计学意义(t值分别为8.696、3.292,P值分别为<0.001、0.004);干预组小鼠肺组织羟脯氨酸水平低于模型组,差异有统计学意义(t=5.403,P<0.001)。
2.4 肺泡灌洗液中IL-6、IL-8、IL-13、TGF-β1水平 三组小鼠肺泡灌洗液中IL-6、IL-8、IL-13、TGF-β1水平比较,差异有统计学意义(P<0.05);模型组、干预组小鼠肺泡灌洗液中IL-6、IL-8、IL-13、TGF-β1水平高于对照组,差异有统计学意义(P<0.05);干预组小鼠肺泡灌洗液中IL-6、IL-8、IL-13、TGF-β1水平低于模型组,差异有统计学意义(P<0.05),见表1。
表1 三组小鼠肺泡灌洗液中IL-6、IL-8、IL-13、TGF-β1水平比较(±s,pg/ml)Table 1 Comparison of the levels of IL-6,IL-8,IL-13 and TGF-β1 in the bronchoalveolar lavage fluid of mice in the three groups

表1 三组小鼠肺泡灌洗液中IL-6、IL-8、IL-13、TGF-β1水平比较(±s,pg/ml)Table 1 Comparison of the levels of IL-6,IL-8,IL-13 and TGF-β1 in the bronchoalveolar lavage fluid of mice in the three groups
注:TGF-β=转化生长因子β;a表示与对照组比较,P<0.05;b表示与模型组比较,P<0.05
组别 只数 IL-6 IL-8 IL-13 TGF-β1对照组 10 32.4±7.7 73.6±10.0 37.0±7.5 298.0±102.4模型组 5 123.6±9.0a209.8±11.3a164.6±9.1a2 756.2±327.7a干预组 7 65.5±9.5ab107.9±16.4ab74.0±8.0ab1 543.0±167.6ab F值 189.758 199.892 427.165 288.245 P值 <0.001 <0.001 <0.001 <0.001
2.5 肺组织CD45+T淋巴细胞计数 对照组、模型组、干预组小鼠肺组织CD45+T淋巴细胞计数分别为(5.84±0.12)、(27.54±7.96)、(13.96±2.64)个/mm3。三组小鼠肺组织CD45+T淋巴细胞计数比较,差异有统计学意义(F=50.601,P<0.001);模型组、干预组小鼠肺组织CD45+T淋巴细胞计数高于对照组,差异有统计学意义(t值分别为10.048、3.760,P值分别为<0.001、0.001);干预组小鼠肺组织CD45+T淋巴细胞计数低于模型组,差异有统计学意义(t=6.288,P<0.001),见图3。

图3 免疫荧光法检测各组小鼠肺组织CD45+ T淋巴细胞计数(免疫荧光染色,×20)Figure 3 The number of CD45+ T lymphocytes in lung tissue of mice in each group detected by immunofluorescence
2.6 肺组织Arg-1、SRPK1、α-SMA表达水平 三组小鼠肺组织Arg-1、SRPK1、α-SMA表达水平比较,差异有统计学意义(P<0.05);模型组小鼠肺组织Arg-1、SRPK1、α-SMA表达水平高于对照组,差异有统计学意义(P<0.05);干预组小鼠肺组织Arg-1、SRPK1表达水平高于对照组、低于模型组,α-SMA表达水平低于模型组,差异有统计学意义(P<0.05),见表2。
表2 三组小鼠肺组织Arg-1、SRPK1、α-SMA表达水平比较(±s)Table 2 Comparison of the expression levels of Arg-1,SRPK1 and α-SMA in the lung tissue of mice in the three groups

表2 三组小鼠肺组织Arg-1、SRPK1、α-SMA表达水平比较(±s)Table 2 Comparison of the expression levels of Arg-1,SRPK1 and α-SMA in the lung tissue of mice in the three groups
注:Arg-1=精氨酸酶1,SRPK1=丝氨酸/精氨酸蛋白激酶1,α-SMA=α平滑肌肌动蛋白;a表示与对照组比较,P<0.05;b表示与模型组比较,P<0.05
组别 只数 Arg-1 SRPK1 α-SMA对照组 10 6.3±1.9 5.6±0.4 8.3±2.6模型组 5 28.9±8.5a 38.9±3.6a 31.0±14.9a干预组 7 19.1±6.4ab 12.7±8.6ab 17.4±8.8b F值 30.445 72.629 11.617 P值 <0.001 <0.001 0.001
3 讨论
RIPF是一种肿瘤放疗严重并发症,严重者常危及患者生命,是造成患者预后差甚至发生非原发病死亡的主要原因之一[7]。肿瘤患者放疗时辐射可诱发肺组织内成纤维细胞持续活化并过度分泌胶原等ECM,造成肺组织发生不可逆损伤,甚至导致患者死亡。目前RIPF发生发展的机制尚不清楚,且没有明确的治疗靶点和临床治疗药物,因此阐明RIPF的具体发生机制,对RIPF的防治具有重要意义。本课题组前期研究发现,Ac-SDDKDP能够通过抑制SRPK1磷酸化来发挥抗肝纤维化作用[5],但SRPK1与组织纤维化之间的关系尚不明确,SRPK1在RIPF中的作用亦不清楚。本研究旨在分析SRPK1在RIPF中的作用及其机制。
本研究HE染色结果显示,模型组小鼠肺组织出现明显的损伤和结构紊乱,肺泡壁增厚扭曲,可见大量病灶形成;干预组小鼠肺组织出现轻微损伤,肺组织结构较模型组完整,肺泡壁增厚现象减少。Masson染色结果显示,模型组小鼠肺组织中出现大量ECM沉积;与模型组相比,干预组小鼠肺组织ECM沉积明显减少。提示抑制SRPK1表达可以减轻RIPF模型小鼠肺组织损伤和纤维化程度。本研究结果还显示,模型组、干预组小鼠肺组织羟脯氨酸水平高于对照组,干预组小鼠肺组织羟脯氨酸水平低于模型组,提示抑制SRPK1表达可有效抑制羟脯氨酸表达,进而抑制胶原的过度分泌。纤维化的发生伴随着慢性炎症的长期刺激,IL-6、IL-8、IL-13是主要的引起纤维化的炎性因子[8],而CD45是炎性细胞白细胞的表面标志物,且CD45+T淋巴细胞越多说明炎症程度越严重[9]。本研究结果显示,模型组、干预组小鼠肺泡灌洗液中IL-6、IL-8、IL-13水平高于对照组,干预组小鼠肺泡灌洗液中IL-6、IL-8、IL-13水平低于模型组;模型组、干预组小鼠肺组织CD45+T淋巴细胞计数高于对照组,干预组小鼠肺组织CD45+T淋巴细胞计数低于模型组,提示抑制SRPK1表达可以减轻RIPF模型小鼠的炎性反应。上述结果均提示SRPK1与RIPF的发生密切相关,但其相关调控机制并不明确。
巨噬细胞作为机体主要的炎症效应细胞,与RIPF的形成密切相关[10]。巨噬细胞经不同刺激可分别向M1型和M2型极化[11],二者在机体中发挥不同作用。在内毒素刺激下巨噬细胞可向M1型极化,释放大量促炎因子而发挥促炎作用[12]。在IL-6、IL-13等作用下巨噬细胞可向M2型极化[13],M2型巨噬细胞是RIPF发生过程中重要的效应细胞[14],其可分泌大量Arg-1、TGF-β1等细胞因子,其中Arg-1是M2型巨噬细胞活化的标志物,TGF-β1是成纤维细胞活化的关键因子,是肺纤维化形成的关键因素[15]。因此,抑制肺组织内巨噬细胞向M2型极化,能够减少Arg-1、TGF-β1的持续分泌,抑制成纤维细胞的活化,减少肺组织内ECM的沉积。成纤维细胞激活是造成肺组织纤维化的终端因素,而α-SMA是成纤维细胞激活的标志[10]。本研究结果显示,模型组、干预组小鼠肺泡灌洗液中TGF-β1水平高于对照组,干预组小鼠肺泡灌洗液中TGF-β1水平低于模型组;模型组小鼠肺组织Arg-1、α-SMA表达水平高于对照组;干预组小鼠肺组织Arg-1表达水平高于对照组、低于模型组,α-SMA表达水平低于模型组;提示抑制SRPK1表达可以抑制巨噬细胞向M2型极化,进而缓解RIPF的进展。以上研究结果提示SRPK1通过促进巨噬细胞向M2型极化激活成纤维细胞,从而发挥促纤维化作用,但SRPK1是如何促进巨噬细胞向M2型极化的尚不清楚,这将是下一步研究的重点。
综上所述,SRPK1可促进RIPF的发生发展,其可能机制为SRPK1促进肺组织内巨噬细胞向M2型极化,激活成纤维细胞,进而促进肺纤维化。但本研究仅揭示了SRPK1与M2型巨噬细胞的关系及其在RIPF中发挥的作用,并未深入研究SRPK1调控巨噬细胞向M2型极化的具体机制。
作者贡献:张旭涛、王小成进行文章的构思与设计;张旭涛进行研究的实施与可行性分析,撰写论文;张迁进行数据收集;王瀚进行数据整理;王斌进行统计学处理;刘峰舟进行结果的分析与解释;张旭涛、吴侃、阮柏进行论文的修订;张敏、王小成负责文章的质量控制及审校;王小成对文章整体负责,监督管理。
本文无利益冲突。
