乳腺浸润性恶性腺肌上皮瘤临床病理学分析
2022-06-29屈传贵董晨羽
屈传贵,董晨羽
(1郓城县人民医院,山东 郓城 274700;2中山大学附属第三医院,广东 广州 510630)
乳腺腺肌上皮瘤(AME)是由腺上皮和突出增生的肌上皮构成的双相型肿瘤,成分之一或同时恶性则为恶性AME[1]。该类肿瘤罕见,占乳腺肿瘤的1%以下,组织学表现复杂,组织构型模式异质性大,故极易导致误诊[2-4]。本文报告1例恶性AME,对其临床病理特征进行分析,旨在提高大家对该病的认识,精准诊断,为临床治疗提供依据。
患者女,49岁。左侧乳腺肿块3年,近期生长快,伴胀感和不时隐痛。专科查体双乳对称,形态如常。左乳头轻度内陷,无糜烂和溢液,皮色正常,无橘皮样外观。于内下象限触及直径约 3 cm大小的包块,质硬、界清、活动可,触痛不明显,腋侧淋巴结未扪及肿大。钼靶X线:左乳内下象限局限性高密度影,边界不清,范围3.3 cm×2.9 cm,密度不均,左乳头下方可见粗大钙化灶,结论:左乳BI-RADS:4C。B超:于左乳7-9点探及3.3 cm×2.3 cm囊实性团块,实性为主,边界尚清,形态欠规则,实性区点状强回声(图1),CDFI示血流信号,结果提示:左乳腺囊实性包块,BI-RADS:4B。临床诊断:左乳癌?于2018年3月29日行术中冰冻检查,快速病理报告:左乳癌,类型待常规。临床遂行改良根治性手术,术后标本送常规病理。
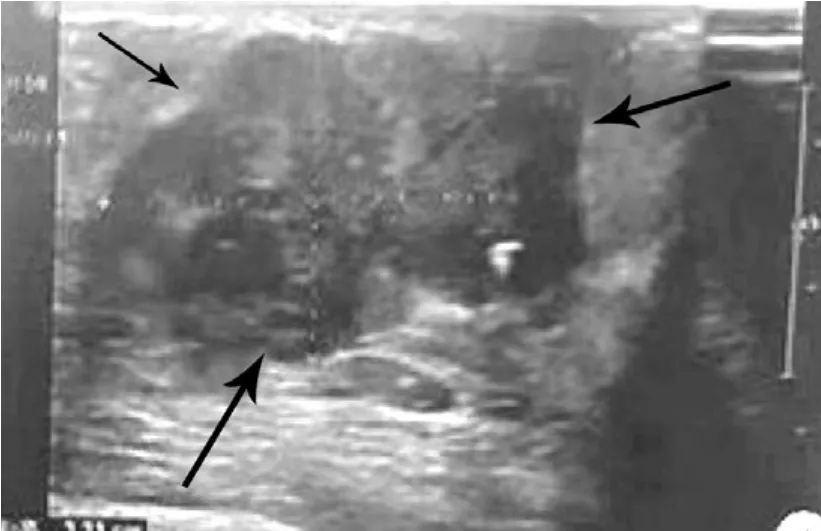
图1 B超示囊实性团块,边界清,形态欠规则
检查方法及结果:冰冻后标本及改良根治乳腺标本,经10%中性甲醛充分固定,常规石蜡切片,HE染色。免疫组化采用EnVision两步法,一抗购自迈新公司,按说明书操作。(1)巨检:快速组织1块,体积4 cm×3 cm×2 cm,附淡黄色脂肪,切面见肿瘤3 cm×2.5 cm大小,灰白,粗糙,有裂隙和小囊腔,质脆,无包膜。常规改良根治标本中所附乳头轻度内陷,其下方手术缺损区边缘见残存瘤组织,约0.5 cm大小,灰白色。腋窝侧检出淋巴结15枚,长径0.3 cm~1.0 cm,灰红色,质细腻。(2)镜检:乳头下方残存肿瘤未累及乳腺导管,未见paget样浸润乳头部位皮肤,组织学大致同肿瘤主体周边瘤组织,由腺上皮和肌上皮构成双相套管样结构,小叶状或腺病样分布(图2)。腺上皮立方或扁平,胞质红染。肌上皮胞质透明,核异型性小,单层或多层绕以腺上皮周围,管腔内有红染物。部分缺少腺上皮,由纯的透明细胞肌上皮围成空管或为实性透明细胞小巢团(图3)。肿瘤的主体由大小不一的实性巢团和伴囊腔裂隙的瘤组织构成。呈分叶结节状和乳头状构型,部分结节融合,可见侵犯脂肪组织(图4)。部分瘤巢着色浅淡,主要由胞质透明的多边形细胞构成,核增大,中度异型,瘤细胞间见纤细的嗜酸性玻璃膜样物沉积,伴有粘液变性和坏死(图5)。部分瘤巢着色较深,巢团融合,其内瘤细胞密度大,胞质少,半透明或嗜酸,核异型显著,核质比高,染色质空泡状或块状,核仁明显,形似上皮样和浆样肌上皮,或为基底样细胞。分裂相可见(3~5个/10HPF)。见粗细不一的纤维血管芯,构成乳头状结构和鹿角样腺样腔隙。瘤巢内假腺腔充以淡蓝色粘液。还见到微囊腔、粘液上皮化生、鳞化、灶状泡沫样细胞(图7-9)。肿瘤间质为纤维结缔组织,宽窄不等,伴粘液变性和淋巴细胞浸润。未见脉管和神经侵犯,腋侧淋巴结无转移(0/15)。(3)免疫组化:ER(-)、PR(-)、HER2(0)、Ki67(+,30%~50%)。腺上皮不同程度表达CK8/18、CK5/6、Cam5.2、E-cadherin、GATA3、CD117, 肌 上 皮 表 达 P63、S-100、Calponin、SOX-10,基底样细胞不表达肌上皮标记。
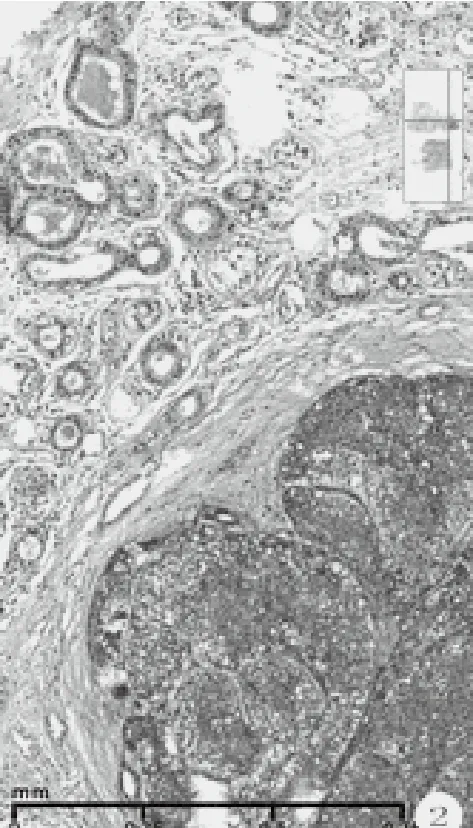
图2 周边病变双相套管样结构,叶状分布,管腔内嗜酸性物(HE染色,中倍放大)
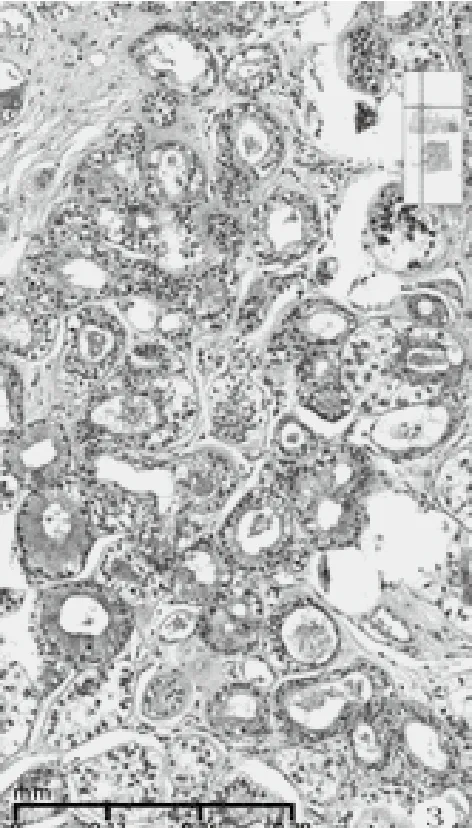
图3 双相套管样结构、实性小巢团和粘液柱状上皮化生(HE染色,中倍放大)
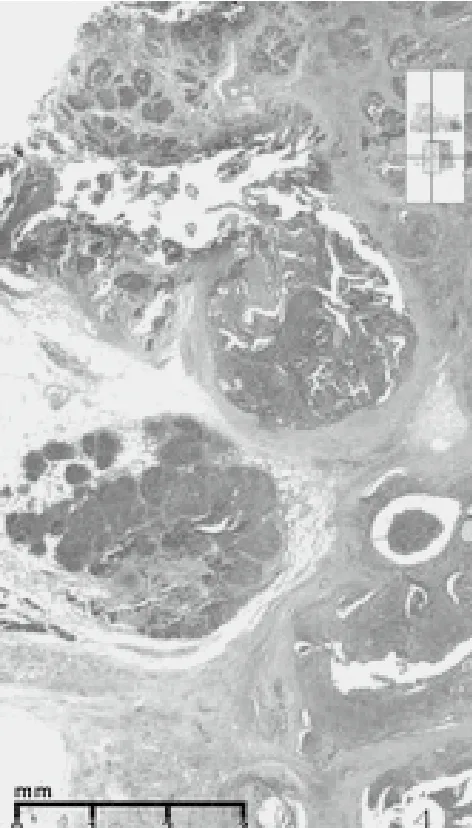
图4 实性巢团、囊腔裂隙,结节融合和脂肪侵犯(HE染色,低低倍放大)
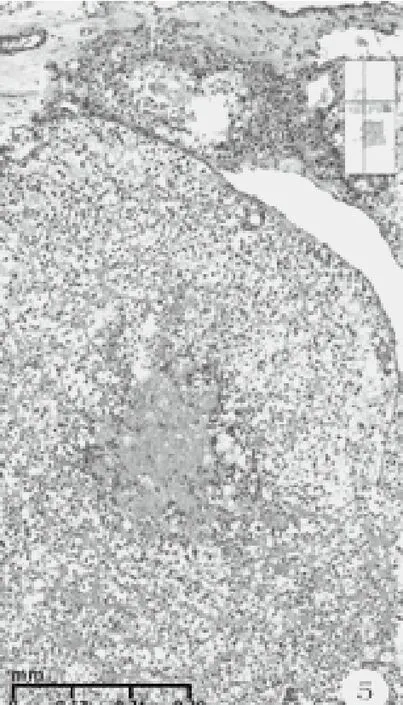
图5 胞质透明中度异型多边形细胞,纤细的嗜酸性玻璃膜样物,伴粘液变性和坏死(HE染色,中倍放大)
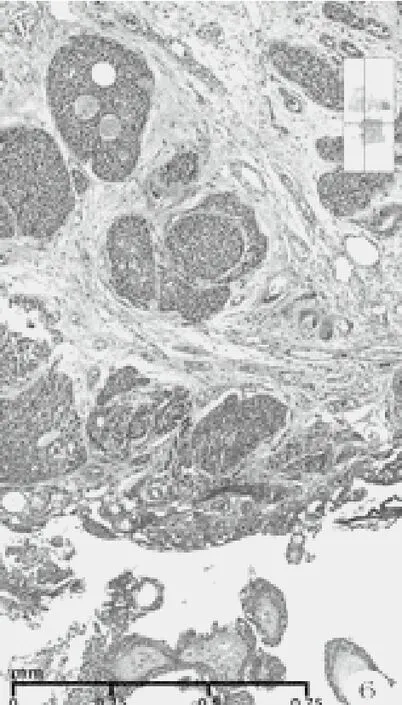
图6 着色深瘤巢和假小管,纤维间质粘液变性和粗芯的乳头状结构(HE染色,低倍放大)
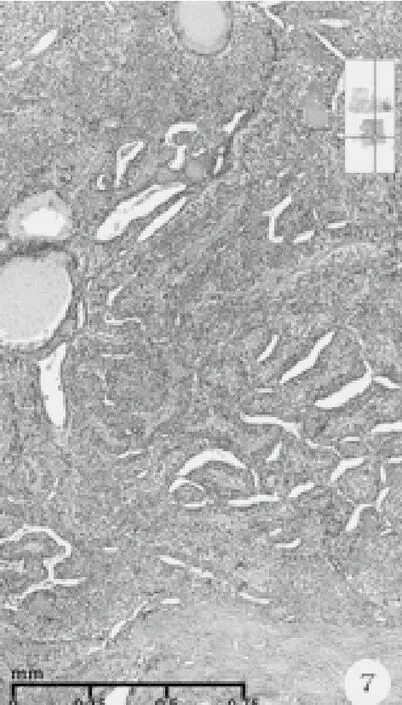
图7 实性乳头结构、鹿角样腔隙的腺管及粘液柱状上皮化生(HE染色,中倍放大)
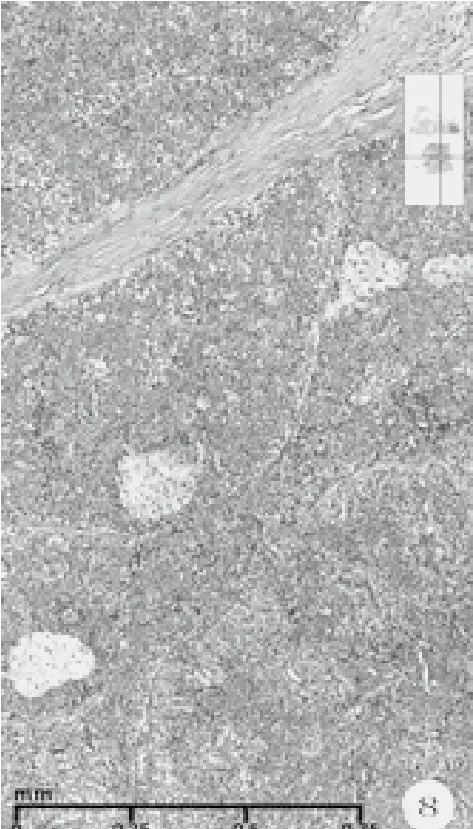
图8 实性乳头结构、灶状泡沫样细胞(HE染色,中倍放大)
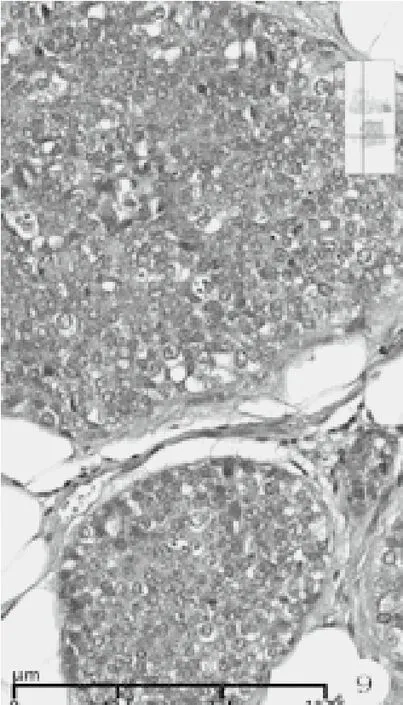
图9 实性瘤巢,肌上皮细胞密度大,异型显著,核仁明显,或为基底样细胞,可见核分裂(HE染色,高倍放大)
病理诊断:左乳腺浸润性恶性腺肌上皮瘤。
术后AC方案化疗,随访至今4年余,无复发转移,健康状况良好。
讨论
AME大多为良性,少数复发,可以恶变,甚至发生转移。恶性AME系乳腺导管腺上皮和突出增生的肌上皮成分之一或同时呈现恶性。该类肿瘤临床罕见,文献多为个案报道[3-4],未见发病率的统计报道。恶性AME好发于中老年女性[5]。两侧乳腺均可受累,多位于乳腺中部,临床触及单发肿块,最大径达10 cm,偶伴乳头溢液。影像学B超探及实性或囊实性分叶状块影,低回声或复杂回声。钼靶X线通常显示单发肿块,界限清楚,有时与纤维腺瘤难以区分。本例患者相对年轻(49岁),肿瘤位于内下象限,乳头根部受累,至乳头轻度内陷,但瘤组织未侵犯输乳管道和乳头皮肤,临床表现无乳头溢液和湿疹,有其病理学基础。
乳腺腺肌上皮肿瘤含有腺上皮和肌上皮两类细胞。腺上皮呈立方形或扁平,胞质嗜酸,可黏液柱状上皮化生,鳞化、皮脂腺分化和大汗腺化生,恶性腺上皮可表现为非特殊浸润性癌、小叶癌、特殊类型乳腺癌的形态。肌上皮形态多样,表现为透明、梭形、上皮样、浆细胞样,还见有失去肌上皮免疫表型的基底样细胞。上述细胞构成管状、分叶状、梭形细胞和腺病变异型四种组织构型模式,还可出现乳头状、巢团状和混合型的结构模式,故该类肿瘤组织学表现复杂,组织构型模式异质性大。相关文献[2]将该类肿瘤更加细化。全部满足以下5个条件的为恶性AME,仅部分具有的为非典型AME,都不具备则为AME。这5个条件是腺上皮或肌上皮成分过度生长;细胞重度异型;浸润性生长;核分裂象>3个/10HPF;肿瘤性坏死。恶性AME包括3种亚型:原位型、浸润性和AME伴浸润性癌(碰撞)。在恶性AME总能见到典型的AME成分。本例可见经典的AME区域,肿瘤浸润脂肪组织,肌上皮过度增生,细胞密度大,异型显著,可见坏死,分裂象3~5/10 HPF,Ki67指数高(30%~50%),符合浸润性恶性AME诊断标准,诊断本病成立。
恶性AME多呈三阴表型,Ki67指数高。本例腺上皮不同程度表达CK8/18、CK5/6、Cam5.2、E-cadherin、GATA3、CD117,肌上皮表达 CK5/6、P63、S-100、Calponin、SOX-10, 基底样细胞失去肌上皮免疫标记。本例也观察到腺上皮和肌上皮形态与免疫表型不一致的情况[1-2]。
多种乳腺病变和皮肤肿瘤都可伴有肌上皮增生,或组织结构模式与本瘤相似,应注意与如下病变相鉴别:(1)非典型微腺性腺病:微腺性腺病表现为单层S-100阳性的腺上皮围成小管,弥散于纤维脂肪组织中。当其复杂增生伴细胞异型,呈现非典型性,甚至发展为浸润性癌[6]时,其组织学构型与本病相似,但其缺少肌上皮是鉴别要点。(2)乳腺腺样囊性癌:属于恶性上皮肌上皮肿瘤的特殊类型[1],由上皮、肌上皮和嗜酸性基底膜样物按不同比例混合,表现为管梁状、筛状和实体型,具有真小管和假腺腔特征。乳腺浸润性恶性腺肌上皮瘤也可出现局灶性的“真小管和假腺腔”,实性巢状结构近似腺样囊性癌的实体型。尽管两者形态结构有重叠,但本瘤缺少经典的筛状结构,且具有经典的AME形态。C-myb(+)支持腺样囊性癌。文献[7-8]中有恶性AME表现为腺样囊性癌组织学形态的报道,也有报道起源于AME的乳腺腺样囊性癌案例。(3)乳腺肌上皮肿瘤:完全由肌上皮构成的肿瘤,可为肌上皮瘤或为恶性肌上皮瘤(癌),或归类于梭形细胞化生性癌中。此类肿瘤缺少腺上皮成分,没有典型的AME背景。(4)乳腺多形性腺瘤:和发生在涎腺的多形性腺瘤组织学表现大致相同,有典型的软骨粘液样区域,组织学构成与本瘤不同。(5)乳腺腺病、管状腺瘤、导管内乳头状肿瘤等,此类病变中均可呈现腺上皮和肌上皮的增生,有时肌上皮增生相当明显,但均不如腺肌上皮肿瘤中肌上皮增生的那么显著和突出,他们有自身独特的组织学图像,与之不难区分。(6)表现为透明细胞的肿瘤:非特殊型透明细胞型浸润性癌、小叶癌、皮脂腺癌、脂质腺癌、腺泡细胞癌、透明细胞汗腺瘤等。前5种均为腺上皮恶性肿瘤,缺少肌上皮。后者尽管有分泌腺上皮和肌上皮两种成分,但属于小汗腺肿瘤,与皮肤关系密切,位置表浅,非乳腺实质发生。
乳腺腺肌上皮肿瘤治疗手段应首选手术[1]。AME多数为良性,预后好,少数有复发和恶性潜能或恶变。恶性AME有肺转移和死亡报道[9-10]。准确诊断的不典型AME,扩大手术切除范围是合理的,但不宜过度治疗。恶性AME应该判断属于原位、浸润性、AME伴浸润性癌中的哪种情况以及恶性成分。依据恶性AME的种类和病期的不同,行改良根治、保乳手术或扩切手术以及术后是否放化疗,选择不同的治疗策略。选择治疗方案时,要注意恶性AME多呈三阴表型,与常见乳癌分子分型中的基底细胞样型三阴是不等同的。ER阳性患者,可考虑内分泌激素抑制剂治疗[1,2]。本例行改良根治术后,再行AC常规化疗,病程已达7年之久,系统查体未见复发和转移,健康状况良好,提示该例为非高度恶性。
