核受体在肿瘤放疗增敏中作用机制的研究进展
2022-06-29李晓倩蒋胜张舒羽
李晓倩 蒋胜 张舒羽,
1 四川大学华西基础医学与法医学院,成都 610041;2 核工业四一六医院(成都医学院第二附属医院)核医学科,成都 610051
放疗在肿瘤治疗中起着十分重要的作用,约2/3 的肿瘤患者需接受放疗[1]。肿瘤放疗的原理是利用不同种类或剂量的射线照射肿瘤部位,通过直接或间接作用损伤DNA,进而有效抑制癌细胞的生长或杀灭癌细胞。但临床上相当一部分肿瘤存在辐射抗性,且正常组织存在辐射耐受剂量问题,因此,探索安全、有效的辐射增敏策略,提高肿瘤的辐射敏感性尤其重要。近年来的研究结果显示,多种核受体及其配体在肿瘤疾病的发生发展过程中发挥重要的作用[2-5]。越来越多的研究者认为,核受体及其相关配体可能参与了肿瘤的放疗抵抗,因此,核受体可能是肿瘤放疗增敏的新靶点[6-10]。笔者就核受体及其相关配体在肿瘤放疗增敏方面的研究进展展开综述。
1 核受体概述
核受体是具有配体依赖性的转录因子超家族之一,相较于其他转录因子超家族,其可直接与亲脂性配体结合。核受体在多细胞生物体内的含量丰富,参与发育、代谢、昼夜节律、免疫调控、增殖与分化等多种病理生理过程,约有14%的临床用药以核受体为作用靶点[2]。人类基因组中包含48 种核受体[6]。
核受体的研究始于人们对脂溶性激素(如类固醇、维甲酸和甲状腺激素等)作用机制的探索。与水溶性激素结合于细胞膜表面受体不同,脂溶性激素可通过简单扩散的方式穿过细胞膜的脂质双分子层进入细胞质。20 世纪70 年代末,放射性核素标记配体技术的发展初步揭开了核受体活化机制的实质,即脂溶性激素进入细胞质后,与一些特异性受体蛋白结合后转位入细胞核,调控基因转录[11]。
自1985 年起,研究者采用分子克隆技术揭示了核受体结构的高度相似性[11]。核受体家族分子包含4 个典型结构域:N-末端反式激活结构域(AF-1)、高度保守的含锌指DNA 结合结构域(DBD)、含有核定位信号肽的铰链结构(NLS)以及相对保守的C 末端配体结合结构域(LBD)。随着核受体家族不断被发现,可依据配体不同将其分为类固醇激素受体家族、非类固醇激素受体家族和尚未明确内源性配体的孤儿核受体家族3 类,各核受体家族以不同的作用模式参与机体的多种病理生理过程(图1)。
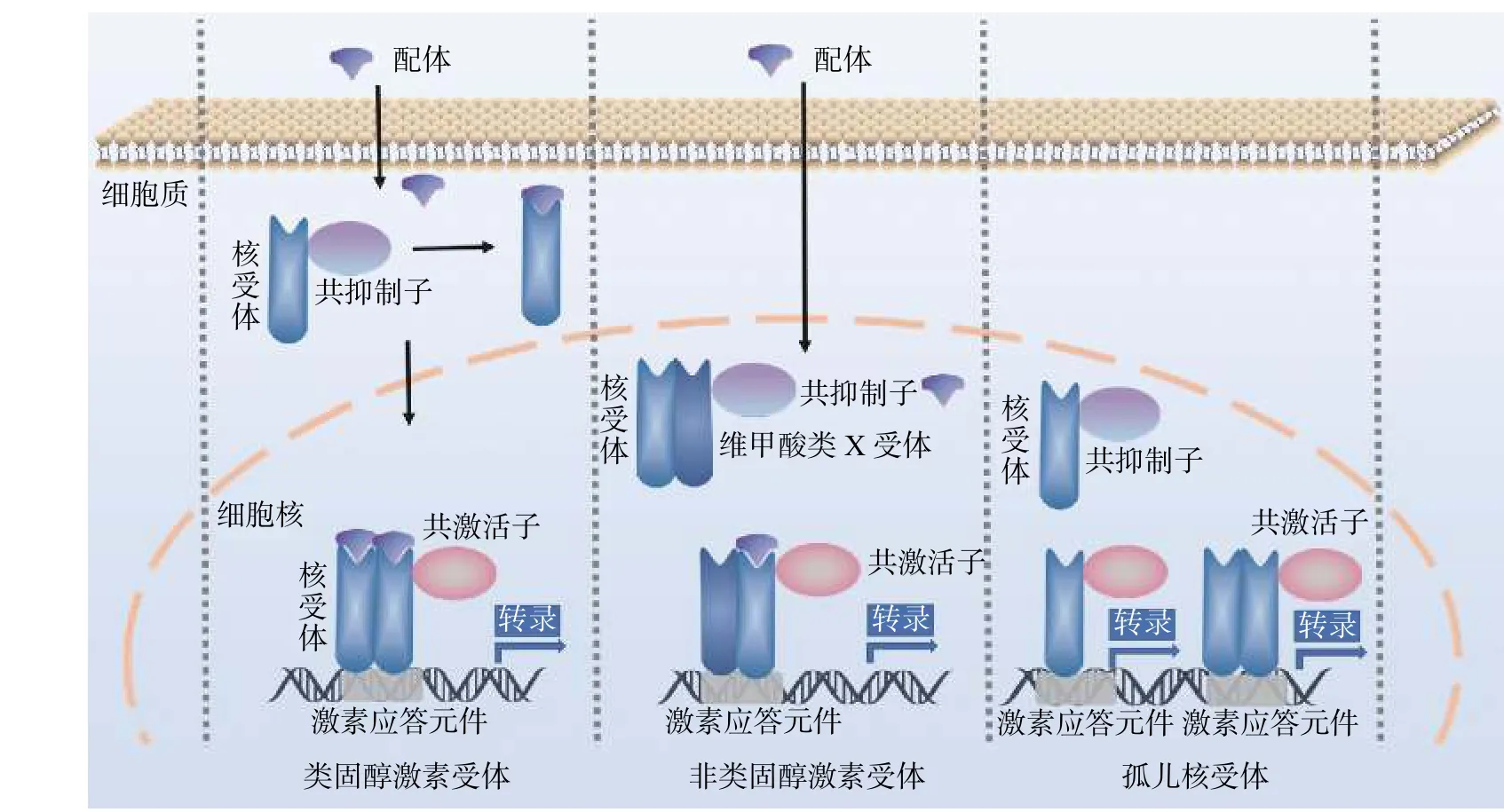
图1 核受体的3 种转录激活作用模式图Figure 1 Three transcriptional activation patterns of nuclear receptors
类固醇激素受体家族成员结合配体前,一般在细胞质中与共抑制子(如热休克蛋白HSP)构成复合体,结合配体后构象改变,配体受体复合体从共抑制子上分离并转位入细胞核,形成同型二聚体后与靶基因的相应激素应答元件(HREs)结合,募集共激活子,调控靶基因的转录表达。在结合配体前,非类固醇激素受体家族成员一般与维甲酸类X 受体(retinoid X receptor,RXR)以异二聚体的形式与共抑制子构成复合物存在于细胞核内,当非类固醇激素受体家族成员与配体结合后,配体-异二聚体复合物游离并同共激活子构成复合体后结合于相应激素应答元件,从而调控靶基因的表达。孤儿核受体家族成员无明确的内源性配体,一般以单体或同型二聚体形式结合于靶基因的激素应答元件,激活相应靶基因转录。
将类固醇激素应用于乳腺癌和前列腺癌的研究开启了核受体在肿瘤领域研究的新篇章[2-3]。有研究结果表明,组织中核受体的表达可能与肿瘤的发生发展相关[2]。Long 和Campbell[3]对癌症基因组图谱(TCGA)数据库中1 905 例原位乳腺癌患者和113 名健康受试者的乳腺组织进行数据分析,结果显示,相较于正常组织,肿瘤中有42 种核受体存在异常表达,且表达下调的核受体数量居多;他们同时对膀胱癌、结直肠癌、头颈部癌、肝癌和前列腺癌的数据进行分析,也得到了相似的结果,但核受体的异常表达存在组织特异性(表1)。上述数据分析结果显示,大多数核受体的表达下调可能是肿瘤发生发展的关键因素之一。因此,核受体已成为肿瘤治疗的潜在靶点,激活或抑制核受体可能是一种潜在的抑制肿瘤策略。值得注意的是,有一部分核受体激动剂和(或)拮抗剂已被用于开展肿瘤治疗相关的Ⅰ、Ⅱ、Ⅲ期临床试验,如雄激素受体拮抗剂阿帕他胺(ARN-509)、脱氢表雄酮和视黄酸相关的孤儿核受体γ 激动剂辛蒂罗贡、过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptor, PPAR)γ 激动剂伊诺列宗和雌激素受体拮抗剂氟维司群等[4-5,12-14]。

表1 肿瘤相关核受体的名称及其表达分布Table 1 Names and expression distribution of tumor-associated nuclear receptors
2 核受体与肿瘤放射敏感性
放疗是肿瘤治疗的主要方法之一,但相当一部分肿瘤存在辐射抗性,这可能与核受体的异常表达有关。已有较多研究结果表明,恢复核受体在肿瘤中的表达可以提高放疗疗效(表2)[7,9,15-27]。目前已有报道的与肿瘤放射敏感性相关的核受体有以下6 种:类固醇激素受体家族成员中的雌激素受体(estrogen receptor, ER)和雄激素受体(androgens receptor, AR);非类固醇激素受体家族成员中的PPAR、维甲酸受体(retinoic acid receptor, RAR)、RXR 和肝X 受体(liver X receptor, LXR)。
随着市场竞争越来越激烈,企业自身需要不断发展,物资供应工作价值取向的首要任务已由过去的及时供应转变为安全、及时、经济。物资供应部门成为了降低企业成本,提高企业效率,增强企业市场竞争力的重要部门。降低物资储备,减少积压物资的产生就显得尤为重要。下面就企业物资造成的原因进行分析并提出改进对策。
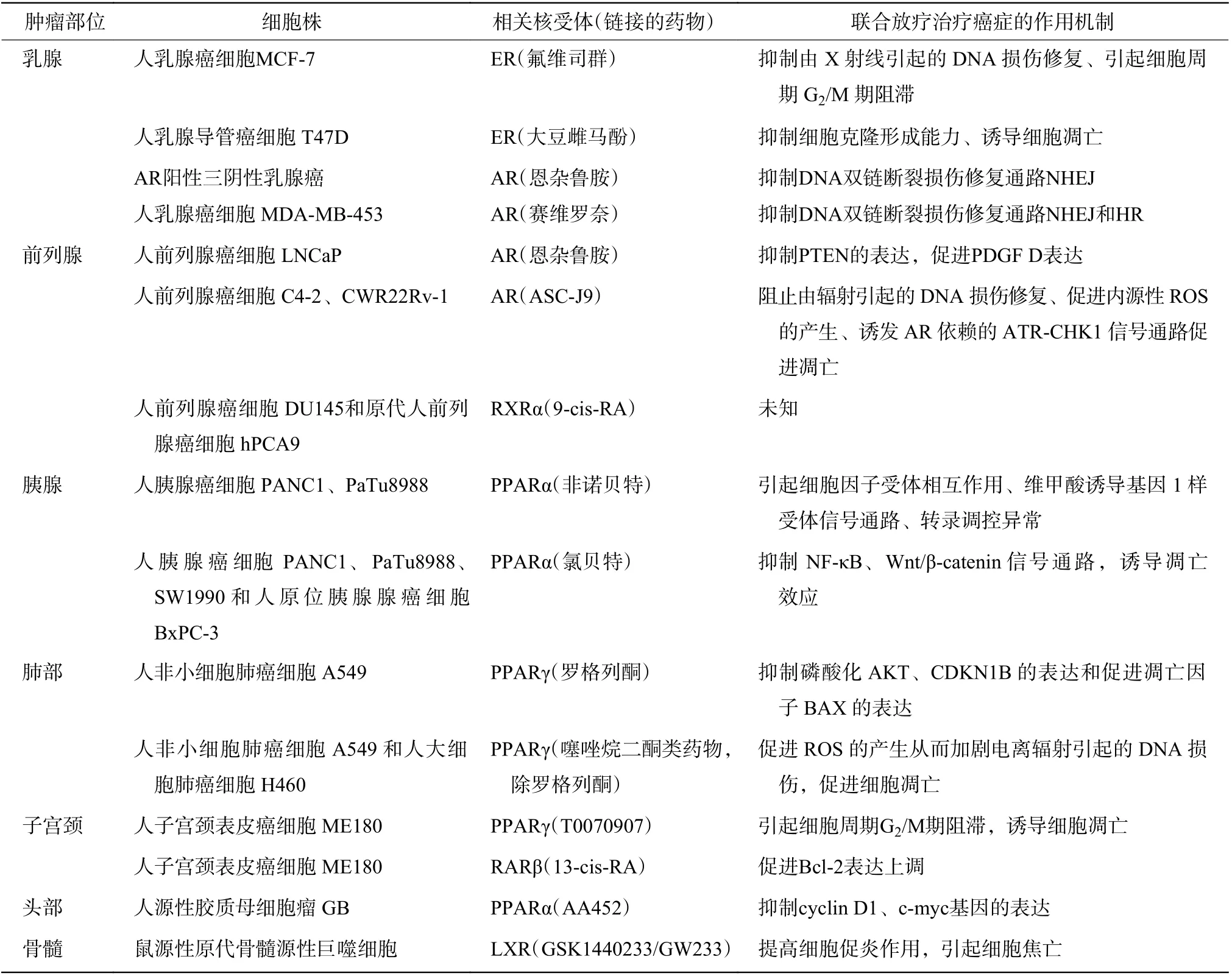
表2 肿瘤放射敏感性相关的核受体Table 2 Nuclear receptors associated with tumor radiosensitivity
2.1 ER 与肿瘤放射敏感性
ER 包含α、β 2 种经典核受体类亚型,但这2 种亚型的发现时间相差10 年,且两者的组织分布和表达量差异较大。骨组织、子宫及与学习记忆相关脑区中的ERβ 高表达,而在卵巢、与生殖相关的脑区中ERα 高表达。ERα 在多种早期肿瘤中高表达,而ERβ 在肿瘤中表达水平降低或缺失,其再表达可促进肿瘤细胞的凋亡,这提示ERα 高表达与ERβ 表达缺失可能与肿瘤的发生有关[28]。
氟维司群是一种选择性ER 抑制剂,可竞争性抑制内源性雌激素与ER 结合、降解ER 蛋白、阻断ER 信号通路,从而发挥抗肿瘤作用,对激素依赖性的乳腺癌具有较好的抑制作用,是ER 阳性的已绝经的乳腺癌晚期患者的一线用药。有研究者探讨了氟维司群对人乳腺癌细胞MCF-7 放射敏感性的影响,发现100 nmol/L 氟维司群可显著提高肿瘤细胞的放射敏感性,其作用机制是氟维司群可阻止由X 射线引起的DNA 损伤的修复,并明显影响肿瘤细胞的周期分布,具有G2期阻滞作用[15]。但氟维司群的直接作用靶点还不清楚。有文献报道,氟维司群可通过泛素蛋白酶体途径诱导ERα 降解,可显著抑制人乳腺癌细胞MCF-7 内的ERα蛋白的表达[29]。因此,笔者推测,氟维司群是通过ERα 提高人乳腺癌细胞MCF-7 的辐射敏感性。大豆雌马酚(equol)是大豆代谢物,为一种异黄酮。有研究结果表明,大豆雌马酚可增强电离辐射对高表达ERα 的人乳腺导管癌细胞T47D 的辐射损伤,其机制主要是抑制细胞的克隆形成能力、诱导细胞凋亡,但具体机制尚不清楚[7]。
因此,ER 与配体结合后的辐射增敏机制有多种,主要包括抑制辐射引起的DNA 损伤修复、抑制细胞的克隆形成能力、诱导细胞凋亡及细胞周期阻滞等,但具体的作用机制尚待进一步的探索。
2.2 AR 与肿瘤放射敏感性
AR 只存在于脊椎动物中,人AR 基因定位于X 染色体,在人体内分布广泛,在生殖器官中的表达量最高,睾酮和双氢睾酮可以直接与AR 结合发挥其生物学作用,如青春期第一性征、第二性征等。另外,AR 在前列腺癌和AR 阳性的三阴性乳腺癌的发生发展中都发挥重要作用。
新一代非甾体AR 拮抗剂具有相似的作用机制,如恩杂鲁胺、阿帕他胺等。一方面,它们竞争性抑制雄激素与AR 的结合,从而抑制AR 进入细胞核与DNA 应答元件结合,进而抑制其下游靶基因的表达,最终抑制肿瘤生长,延长癌症晚期患者的生存期。在60Co 照射前,采用10 μmol/L恩杂鲁胺处理人前列腺癌细胞LNCaP,其细胞克隆形成能力明显减弱,其放疗增敏机制可能与细胞内人第10 号染色体上检出的磷酸酶及张力蛋白同源蛋白(PTEN)的表达缺失后上调血小板源生长因子D(PDGF-D)的表达有关[16]。另一方面,新一代非甾体AR 拮抗剂可明显抑制辐射后细胞内DNA 修复关键分子DNA 依赖蛋白激酶催化亚基(DNAPKcs)的磷酸化水平,从而通过非同源末端连接(NHEJ)修复通路抑制辐射后AR 阳性的三阴性乳腺癌细胞及去势抵抗性前列腺癌细胞的DNA 双链断裂损伤的修复[8,17]。
二甲基姜黄素(ASC-J9)是首个被认证的雄激素受体降解增强剂,其为一种姜黄素双甲氧基衍生物,可以抑制前列腺癌、膀胱癌、肝癌和肾癌等多种AR 相关肿瘤的生长,安全性较高。有研究结果表明,二甲基姜黄素通过阻止由辐射引起的DNA 损伤修复,提高内源性活性氧的产生,以加剧辐射引起的基因组DNA 损伤及诱发AR 依赖的共济失调毛细血管扩张Rad3 相关蛋白-细胞周期检查点激酶1(ATRCHK1)信号通路促进人前列腺癌细胞C4-2 和 CWR22Rv-1的凋亡,从而抑制去势抵抗性前列腺癌的进展[18]。
赛维罗奈(INO-464)是一种细胞色素P450 家族成员CYP17 裂解酶和AR 双重抑制剂,结合于DNA 损伤修复基因的AR 结合域后,不仅可调控DNA 蛋白激酶催化亚基(DNA PKcs)的表达,还可调控Rad51 家族蛋白基因X 射线修复交叉互补蛋白(XRCC)2 和3 的表达,从而通过非同源末端连接(NHEJ)修复通路和同源重组(HR)修复2 条通路加剧因辐射引起的DNA 损伤。赛维罗奈与放疗联合用于人乳腺癌细胞MDA-MB-453 移植瘤的体内实验结果表明,两者可以协同作用,减小辐射后的肿瘤体积、延长肿瘤体积倍增的时间[19]。综上所述,DNA 损伤修复基因的AR 结合域在治疗相关癌症中发挥了重要作用。
采用AR 拮抗剂是治疗雄激素依赖性前列腺癌的主要方法之一,但治疗1~3 年内大多数患者会进展为雄激素非依赖性前列腺癌,治疗效果急剧下降。因此,有研究者猜测并在细胞水平验证:恢复前列腺癌细胞内AR 的表达水平以提高细胞对雄激素的敏感性有助于治疗雄激素非依赖性前列腺癌。研究者将AR 的cDNA 转染入雄激素非依赖性人前列腺癌细胞PC3 后进行辐射,细胞的克隆形成能力明显降低,这说明AR 可以激活细胞凋亡相关通路,促进细胞凋亡,从而发挥放疗增敏作用[30]。
2.3 PPAR 与肿瘤放射敏感性
1990 年,英国学者Issemann 等[31]在筛选肝cDNA 时发现一种可被脂肪酸样化合物过氧化物酶体增殖物激活的物质,命名为PPAR。PPAR 主要分为α、β 和γ 3 种亚型,但在结构上,三者仅有60%~ 80%的同源性。依据靶基因和组织分布的不同,3 种PPAR 亚型呈现出不同的病理生理学和药理学功能,其中,α 和γ 2 种受体亚型与肿瘤放疗增敏相关。
2.3.1 PPARα 与肿瘤放射敏感性
PPARα 是人体糖代谢、脂肪代谢和氨基酸代谢的关键调控因子,在胰腺癌、肾癌、肝细胞癌、乳腺癌和胶质母细胞瘤等肿瘤的发生发展中发挥重要作用[9,20]。
贝特类药物是特异性PPARα 和PPARγ 的双重激动剂,用于糖尿病和心血管疾病的治疗,也是降低血清甘油三酯水平的一线药物,包括非诺贝特、氯贝特等。微阵列分析结果表明,非诺贝特和X 射线联合作用于人胰腺癌细胞PANC1 和PaTu8988 后,细胞内TAO 激酶2(TAOK2)、酪氨酸蛋白激酶3(JAK3)、SHISA 家族成员2(SHISA2)、嗅觉受体4M1(OR4M1)、辣椒素受体(TRPV1)和锌转运体7(ZIP7)等基因存在异常表达[20]。京都基因与基因组百科全书(KEGG)信号通路分析结果表明,非诺贝特使胰腺癌细胞对X 射线的敏感性增强,可能涉及的机制包括细胞因子受体相互作用、维甲酸激活基因1 样受体信号通路和致癌错误转录等[20]。氯贝特可能通过抑制核因子激活的B 细胞的κ-轻链增强(NF-κB)和Wnt/β-catenin 信号通路,加强X 射线对人胰腺癌细胞PANC1、PaTu8988、SW1990 和人原位胰腺腺癌细胞BxPC-3的促凋亡效应。另外,X 射线与氯贝特联合使用使人胰腺癌细胞PANC1 和PaTu8988 停滞在 G2期,明显提高了肿瘤细胞的杀伤效应[9]。
N-(甲磺酰基)酰胺(AA452)是一种N-苯磺酰基酰胺衍生物,是PPARα 拮抗剂。克隆形成实验结果显示,N-(甲磺酰基)酰胺与放疗联用可明显抑制人源性胶质母细胞瘤(GB)的增殖,其辐射增敏机制可能与胞内细胞周期蛋白D1(cyclin D1)和c-myc 基因表达水平降低有关[21]。
2.3.2 PPARγ 与肿瘤的放射敏感性
PPARγ 是研究最为深入的核受体亚型,其广泛存在于许多正常组织及肿瘤中,参与机体内糖和脂肪的正常代谢及其他生理功能,是治疗代谢性疾病的重要作用靶点[32]。
人工合成的激动剂主要为噻唑烷二酮类生物化合物,如曲格列酮、罗格列酮、吡格列酮以及CAY 系列药物等,其可作用于胰岛细胞治疗糖尿病。有研究结果表明,经罗格列酮处理后进行γ 射线辐照可诱导人非小细胞肺癌细胞A549 凋亡,其发生机制与磷酸化丝氨酸/苏氨酸蛋白激酶(AKT)、细胞周期蛋白依赖性激酶抑制剂1B(CDKN1B)表达的下调和促凋亡因子B 淋巴细胞瘤2 基因相关X 的蛋白质(BAX)的表达上调有关[22]。而其他噻唑烷二酮类生物化合物[10 μmol/L 噻格列酮、20 μmol/L 米格列酮(CAY10415)、20 μmol/L 硫辛酸噻唑烷二酮衍生物 (CAY10506)]和γ 射线联合作用于人非小细胞肺癌细胞A549 和人大细胞肺癌细胞H460 后,细胞内的活性氧增加,从而加剧电离辐射引起的DNA 损伤,进而上调细胞凋亡相关基因(如caspase 3、caspase 8 和caspase 9 等)的表达,其中,噻格列酮的效果更明显[23]。综上所述,噻唑烷二酮类生物化合物可能通过加强射线对肿瘤细胞的诱导凋亡效应增强辐射杀伤肿瘤的作用。
T0070907 是PPARγ 选择性拮抗剂,已有研究结果证实其具有抑制肿瘤细胞增殖的作用[24]。有研究探讨了T0070907对子宫颈癌细胞放射敏感性的影响,结果显示,其通过阻滞细胞周期G2/M 期,以及加强电离辐射通过p53 信号通路诱导肿瘤细胞的凋亡效应,进而提高人子宫颈表皮癌细胞ME180 的辐射敏感性,但其对于人子宫颈癌细胞HeLa 和人子宫颈鳞癌细胞SiHa 却没有产生辐射增敏效果,这提示该药物具有细胞特异性[24]。
综上,由于肿瘤类型及微环境的不同,PPARs 的表达及活化可提高或抑制不同肿瘤细胞的辐射敏感性。因此,应根据不同类型的细胞选择合适的PPARs 激动剂或拮抗剂来提高肿瘤细胞的放射敏感性,基于PPARs 的肿瘤细胞辐射增敏策略还有待进一步的深入研究。
2.4 RAR 和 RXR 与肿瘤放射敏感性
RAR 和RXR 2 种核受体均可介导维甲酸在分子水平的多样效应。其中,RXR 是第一个被鉴定为内源性配体的核受体,其既可自身构成同型二聚体,又可与其他核受体构成异型二聚体参与信号传导通路。RAR 基因型的功能与急性早幼粒细胞白血病的发病机制有关。RAR 和RXR 各包含α、β、γ 3 种受体亚型,但能增强肿瘤放射敏感性的受体亚型仅包含RARβ 和RXRα 2 种。但有研究结果显示,内源性RXRα 的C 末端配体结合结构域(LBD)片段的存在,会抑制受体激动剂发挥辐射增敏作用[33]。
2.4.1 RARβ
RARβ 是RAR 的一种受体亚型,与维甲酸结合后可抑制肿瘤发生发展的进程。有研究结果显示,RARβ 基因在头颈部鳞癌、肺癌、子宫颈癌和脑胶质母细胞瘤等肿瘤中的表达明显下调,启动子异常甲基化是基因表达缺失的主要原因,这提示RARβ 基因启动子甲基化可作为肿瘤标志物用于癌症的诊断[34]。
2.4.2 RXRα
RXRα 是RXR 的3 种受体亚型之一,以同型二聚体或异型二聚体的形式参与机体的多种病理生理过程,在肝细胞、皮肤、前列腺及脂肪组织的生长发育中起重要作用,敲除RXRα 具有胚胎致死性[35]。
维甲酸可作为RAR 和RXR 的激动剂激活靶基因的转录,是维生素A 在体内发挥重要作用的活性成分,由环己烯、疏水侧链和极性基团组成,其衍生物包含全反式维甲酸(ATRA)、9-顺式维甲酸(9-cis-RA)和13-顺式维甲酸(13-cis-RA)等,是一类疗效确切的抗肿瘤药物。13-顺式维甲酸可诱导高表达RARβ 基因的人子宫颈表皮癌细胞ME180 的凋亡,明显提高137Cs 的放疗疗效,其作用机制可能与B 淋巴细胞瘤2(Bcl-2)基因表达的上调有关,而不表达RARβ基因的人子宫颈癌细胞HeLa 在转染RARβ 后再照射,细胞的存活率明显下降,这提示细胞内高表达RARβ 可抑制肿瘤的生长[25]。
9-顺式维甲酸是第一个被鉴定的RXRα 天然配体。在照射前,利用9-顺式维甲酸培养人前列腺癌细胞DU145 和人原代前列腺癌细胞hPCA9,结果显示,辐射对肿瘤细胞的杀伤效应得到了明显提高,但其具体机制尚待探索[26]。
2.5 LXR 与肿瘤放射敏感性
LXR 最初从人肝cDNA 文库中分离得到,因其在肝组织中丰富表达而被命名。LXR 包含α 和β 2 种亚型,LXRβ广泛分布于人体,LXRα 高表达于脂质代谢相关组织中。研究者最初认为LXR 均为孤儿核受体,后发现其可被内源性氧化型固醇类物质如 24(S) -羟胆固醇等激活,驱动靶基因载脂蛋白E(ApoE)及其他参与调控胆固醇、脂肪酸和糖代谢基因的转录活性,与巨噬细胞(人类、鼠类肿瘤细胞的主要成分)的多种生物学过程相关[10]。
采用LXR 合成激动剂GW3965 培养永生化鼠骨髓源性巨噬细胞,经照射后,野生型细胞的存活率较LXR 基因双亚型敲除细胞提高20%,这提示LXR 高表达降低了巨噬细胞的放射敏感性[10]。
LXR 拮抗剂GSK1440233A(GW233)与γ 射线联合作用于鼠源性原代骨髓源性巨噬细胞后,细胞内M1 型巨噬细胞标志物白细胞介素1β(IL-1β)、诱导型一氧化氮合酶(iNOS)及白细胞介素6(IL-6)的表达增加,这提示细胞的促炎作用提高,肿瘤微环境改变,从而通过细胞焦亡的方式降低细胞的存活率[27]。
3 总结与展望
放疗在肿瘤治疗中发挥着极其重要的作用,为了更好地控制肿瘤、减轻其对正常组织的损伤,提高患者长期生活质量,探索安全、有效的辐射增敏策略具有重要价值。综上所述,核受体联合电离辐射可以通过细胞周期阻滞、增强辐射对肿瘤细胞的诱导凋亡效应、抑制辐射引起的DNA 损伤应答及改善肿瘤微环境等多种机制提高肿瘤细胞的辐射敏感性,促进电离辐射对肿瘤细胞的杀伤。尽管核受体激动剂或抑制剂已开始被用于临床试验,但是尚未见将这些药物联合放疗用于临床肿瘤患者的报道。新型核受体激动剂或抑制剂未来有望应用在临床肿瘤的放疗增敏中。目前,对于核受体增加肿瘤放射敏感性的研究和了解仍十分匮乏,相信随着研究的深入,会对核受体在肿瘤放疗增敏中的作用有更多的了解,并为肿瘤放疗增敏提供新的靶点和策略。
利益冲突 所有作者声明无利益冲突
作者贡献声明 李晓倩负责文献的收集、综述的撰写;蒋胜负责综述的修订;张舒羽负责命题的提出、综述撰写的指导及修订
