新型冠状病毒Omicron变异株利用多种动物ACE2作为受体侵入细胞的能力
2022-06-28邱雅若李星霖陈丹瑛刘永梅宋焱君李国力赵学森
邱雅若 李星霖 陈丹瑛 刘永梅 宋焱君 李国力 宋 川 王 玺 赵学森
(1. 北京大学地坛医院教学医院,北京 100015;2. 首都医科大学附属北京地坛医院传染病研究所,北京 100015 )
截至2022年3月1日,新型冠状病毒肺炎疫情在全球累计确诊病例超过4亿,累计死亡病例达到590多万[1-2]。新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)是一种单股正链RNA病毒,其基因组长度为30 kb[3]。结构蛋白包括刺突蛋白S、包膜蛋白E、基质蛋白M和核衣壳蛋白N[3]。刺突蛋白S由S1和S2亚基组成,可以利用来自不同动物的血管紧张素转换酶Ⅱ (angiotensin-converting enzyme Ⅱ,ACE2) 侵入宿主细胞[4-5],该过程是病毒成功侵入细胞的关键步骤。
SARS-CoV-2在传播的过程中不断产生突变,Omicron(B.1.1.529)变异株于2021年11月24日首次由南非报告给世界卫生组织 (World Health Organization, WHO),此后该变异株迅速成为南非的主要流行株,并传播至全球多个国家和地区,截至2022年2月全球共有80多个国家和地区报告了Omicron株感染病例[6]。目前已有研究[6-7]表明,与其他关切变异株(variant of concern, VOC)相比,Omicron变异株出现免疫逃逸和再次感染的风险增加,这对全球新型冠状病毒肺炎(COVID-19) 疫情防控提出了新的挑战。
与之前发现的变异株相比,Omicron变异株具有更多的突变位点,其中Spike蛋白上的突变位点为32个[8];而2020年在印度和其他国家引发大流行的Delta变异株,在Spike蛋白上仅有8个突变[9]。因此,Han等[10]认为Omicron株和ACE2之间的亲和力将会发生改变。此外,在Omicron株中检测到的突变,有很多在之前的SARS-CoV-2变异株中几乎没有被报道过,这让人们对Omicron的进化和来源产生了一些争议[11],即Omicron株的变异过程具体是发生在哪些动物身上[12]。由此可见,验证Omicron变异株可能存在的中间宿主是有必要的。
已有研究[4]证明Omicron变异株可利用来自人类、果子狸、大鼠、穿山甲等哺乳动物的ACE2受体侵入细胞,但是否可以利用其他哺乳动物(如兔、浣熊狗)的ACE2受体侵入细胞仍有待研究。为了研究Omicron株可能存在的潜在中间宿主,证明其潜在的种间传播能力,本研究利用本实验室所建立的Omicron假病毒感染系统,验证Omicron株利用13种不同哺乳动物来源的ACE2受体的能力,现报道如下。
1 材料与方法
1.1 实验材料
人类ACE2质粒、果子狸ACE2质粒、中华菊头蝠ACE2质粒、猪獾ACE2质粒、雪貂獾ACE2质粒、猫科动物ACE2质粒、大鼠ACE2质粒、墨西哥无尾蝠ACE2质粒均由本实验室提供;浣熊狗ACE2质粒由加拿大西安大略大学Dr. Hanxin Lin馈赠;293T细胞系由本实验室提供;细胞培养皿、12孔板、 96孔板、磷酸缓冲液(phosphate buffered saline, PBS)、胎牛血清均购自美国Corning公司;0.05%(质量分数)胰蛋白酶与DMEM培养基购自美国Gibco公司;Turbo转染试剂盒购自美国Thermoscientific公司;荧光素酶报告基因检测试剂盒购自美国Promega公司。
1.2 实验方法
1.2.1 构建蛋白表达质粒
首先将来自13种不同哺乳动物的ACE2分子被克隆至修饰后的pcDNA3.1载体(pcDNA3.1-N-Myc/C-C9)。从该载体表达的ACE2蛋白在氨基(N)末端含有Myc标签,在羧基(C)端含有C9标签。再从美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI) GenBank数据库下载VSV-G蛋白及新型冠状病毒野生型的DNA序列,进行密码子优化后合成至pSecTag2载体上,获取单克隆质粒后大量扩增,测序鉴定其序列正确。随后将密码子优化后的Omicron株S蛋白序列送至生物公司合成至pSecTag2载体上。通过PCR定点突变以及分子克隆,构建新型冠状病毒D614G株、Delta株的S蛋白表达质粒,测序鉴定其序列正确。
1.2.2 包装D614G株、Delta株及Omicron 株VSV-ΔG-luc假病毒
用0.05%(质量分数)胰酶消化并接种293T细胞至6孔板中,置37 ℃培养箱中培养16~18 h;待6孔板细胞密度达到80%~90%时,按照Lipo 2000转染方法转染新型冠状病毒Spike蛋白表达质粒。6 h后每孔以3.0×104TCID 50/mL的浓度感染VSV-G/VSV-ΔG-luc假病毒,并补充2 mL新鲜培养基;转染24 h后,每孔更换4 mL新鲜培养基;收取转染后48 h及72 h的细胞上清液,经0.45 μm的聚醚砜(polyethersulfone,PES)滤膜滤过,分装后于-80 ℃储存,即获得SARS-CoV-2 D614G株、Delta株及Omicron株的VSV-ΔG-luc假病毒。
1.2.3 假病毒感染实验
用0.05%(质量分数)胰酶消化并接种293T细胞至12孔板中,置37 ℃培养箱中培养16~18 h;待12孔板中的293T细胞密度达到80%~90%时,按照Turbofect转染方法转染不同动物来源的ACE2质粒和pcDNA3.1空载质粒;转染24 h后,将细胞消化并接种至96孔板,37 ℃ 培养箱中过夜培养;待96孔板中的细胞密度达到80%时,弃掉培养基,将病毒按1∶5比例进行稀释,每孔加入100 μL假病毒稀释液;感染24 h后,弃掉病毒液。每孔加入30 μL细胞裂解液,室温下放置10 min,待细胞充分裂解后,每孔加入50 μL荧光素酶底物,立即置于荧光素发光仪器上读数。
1.3 统计学方法

2 结果
2.1 Omicron的Spike蛋白高度突变
根据全球共享流感数据库(Global Initiative on Sharing all Influenza Data, GISAID)[13-14]发布的Omicron变异株基因组序列信息显示,Omicron株和其他已知的VOC基因序列存在显著差异,其在Spike蛋白上有32个氨基酸发生了突变,主要集中于受体结合域(receptor-binding domain, RBD)和N段(N-terminal domain, NTD)(图1)。
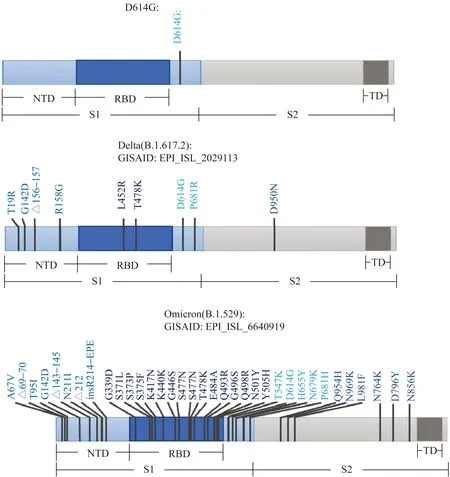
图1 SARS-CoV-2 D614G、Delta、Omicron变异株Spike蛋白的示意图概括和结构域分布Fig.1 Overview and domain distribution of spike proteins of SARS-CoV-2 D614G, Delta, and Omicron variantsGISAID: Global Initiative on Sharing all Influenza Data; NTD:N-terminal domain; RBD:receptor-binding domain; TD:terminal domain.
2.2 新型冠状病毒Omicron变异株可有效利用多种动物的ACE2进入细胞
结果显示,不同ACE2的表达并不影响 Lassa virus (LASV) 对细胞的侵入,但却明显增强了D614G株、Delta株和Omicron株对细胞的侵入(图2)。与D614G株和Delta株相比,Omicron利用中华菊头蝠和
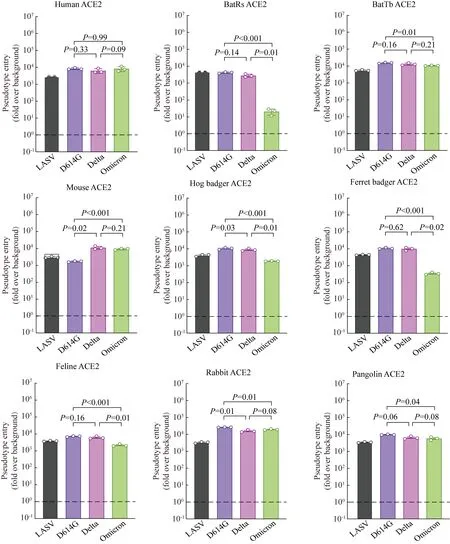
图2 与D614G和Delta spike相比,Omicron spike以不同的效率介导进入细胞系,有效利用不同动物的ACE2受体侵入细胞Fig.2 Compared to D614G and Delta spikes, Omicron spike mediate entry into cell lines with different efficiencies, effectively utilizing ACE2 receptors from different animals to invade cellsn=3; ACE2:angiotensin-converting enzyme Ⅱ;LASV: Lassa virus.
雪貂獾的ACE2的能力显著减弱(P<0.05)。此外,与D614G株相比,Omicron株利用中华菊头蝠、墨西哥无尾蝠、雪貂獾、猪獾、猫、兔和穿山甲的ACE2受体侵入细胞的能力降低(P<0.05);与Delta株相比,Omicron株利用中华菊头蝠、雪貂獾、猪獾和猫的ACE2受体侵入细胞的能力降低(P<0.05)。
3 讨论
目前对新冠肺炎疫情防治而言,最大的困难即是病毒不断地发生突变,产生新的变异株,这些变异株都出现了不同程度的免疫逃逸,以及毒力和传染性的增强。目前WHO一共命名了5种VOC,分别是Alpha株(B.1.1.7)、Beta株(B.1.351)、Gamma株(P.1)、Delta株(B.1.617.2)和Omicron株(B.1.1.529)。与之前发现的变异株相比,Omicron变异株具有更多的突变位点[8-9],其中不乏一些从未出现过的位点,RBD是病毒中首先与细胞接触的部分,RBD与ACE2的亲和力决定了SARS-CoV-2 的传染性[15]。Chen等[16]在Omicron的RBD上共发现了15个突变,包括K417N、S477N、T478K、E484A、N501Y、G339D、S371L、S373P、S375F、N440K、G446S、Q493R、G496S、Q498R和Y505H,突变位点远超于之前发现的VOC,这意味着Omicron变异株的毒力和传染性可能发生了显著的变化[6, 14]。RBD中的一些突变是Omicron株特有的,比如G339D、S371L、S373P、S375F[4],这可能提示在Omicron株进化的过程中,存在特有的中间宿主或潜在扩增宿主。
研究[12]表明,Omicron变异株的Q493R和Q498R突变在别的VOC中不曾出现,却在小鼠来源的突变体中被发现,因此怀疑小鼠是Omicron变异株的重要中间宿主,推进了Omicron株的突变。本研究结果表明,在13种不同哺乳动物来源的ACE2受体中,Omicron株利用小鼠ACE2受体的能力并没有显著优势,这提示在Omicron株的进化过程中存在不止一个关键中间宿主。
目前已有研究[6-7]表明,Omicron变异株会造成康复患者的再次感染[6],并且出现了明显的免疫逃逸[7]。因此,不少人都认为Omicron株将给世界带来新一轮的疫情风暴。Omicron变异株的出现给全球疫情防治带来了新的挑战,其传播能力、毒力、致病性均发生了改变。Du等[11]推测Omicron株出现的原因可能是某种动物群体感染了SARS-CoV-2,病毒在动物群体传播过程中发生了适应性进化,突变速率远高于人类,随后溢出传染到人类。因此,本研究选取了Omicron变异株作为研究对象,且以在全球广泛传播的D614G株和Delta株作为对照,探讨Omicron株利用不同动物受体侵入细胞的能力,以进一步探索其进化来源及其跨物种传播的特性。本研究利用本实验室获得的多种动物来源的ACE2受体分子,结合VSV假病毒感染系统,证实Omicron株除了可利用人类、果子狸、穿山甲等动物的ACE2受体之外,还可以有效利用兔、小鼠、浣熊狗等动物的受体分子侵入细胞,这提示Omicron株在进化过程中可能利用了多种动物作为中间宿主。总的来说,本研究结果表明,Omicron株在Spike蛋白的大量突变并不影响其利用多种动物的ACE2作为受体分子侵入细胞的能力,这意味着Omicron存在多种可能的跨宿主传播途径来感染人类。
