鱼藤素上调Kruppel样因子15表达影响卵巢癌SKOV细胞的增殖和凋亡
2022-06-28赵莹丁俊姗杨慧丽
赵莹,丁俊姗,杨慧丽
作者单位:1河南省胸科医院体检中心,河南 郑州 450000;2郑州市妇幼保健院,a妇科二区,b产科二区,河南 郑州 450000
卵巢癌是常见的女性生殖系统恶性肿瘤,严重威胁女性生命健康。卵巢癌的治疗以手术切除和以铂类为基础的化疗为主,化疗耐药是卵巢癌复发和治疗失败的主要原因之一[1]。因此,寻找安全有效的抗肿瘤药物迫在眉睫。鱼藤素是一种从豆科植物中提取的黄酮类化合物,具有抗肿瘤活性。研究显示,鱼藤素可诱导胃癌SGC7901/VCR 细胞程序性坏死[2],抑制非小细胞肺癌细胞迁移和侵袭[3]。Kruppel 样因子(KLFs)作为一个转录因子家族,在DNA 结合以及核定位中发挥着关键作用。Kruppel样因子15(KLF15)是KLFs家族成员之一,从人肾脏cDNA 文库中获得。KLF15 表达于人体多个组织,如肝脏、肾脏和骨骼肌等[4]。近年来研究显示,KLF15在肿瘤的发生发展中起关键作用。如高温杰等[5]研究表明,KLF15 基因在乳腺癌组织中呈低表达,上调其表达可抑制癌细胞增殖及克隆能力,对癌细胞周期进程起到阻滞作用,可作为乳腺癌治疗的潜在分子靶点。但目前,有关KLF15 对卵巢癌细胞增殖及凋亡影响的研究甚少。本研究于2019年3月至2020 年3 月进行,探讨了鱼藤素是否能通过调控KLF15而影响卵巢癌SKOV3细胞增殖及凋亡,旨在为鱼藤素用于卵巢癌的治疗奠定实验基础。
1 材料与方法
1.1 材料与试剂卵巢癌SKOV3 细胞由中国科学院上海细胞库提供,鱼藤素(纯度>97%)购自美国Selleck 公司,RPMI 1640 培养基由北京索莱宝科技有限公司提供,细胞计数试剂盒-8(CCK-8)及二喹啉甲酸(BCA)试剂盒由上海碧云天生物技术有限公司提供,LipofectamineTM2000 试剂盒及Trizol 试剂由美国Invitrogen 公司提供,KLF15 的小干扰RNA(si-KLF15)、乱序无意义阴性序列(si-NC)以及KLF15过表达载体(pcDNA-KLF15)、空载体(pcDNA)由上海吉玛制药技术有限公司提供,细胞凋亡试剂盒由江苏凯基生物技术股份有限公司提供,兔抗人细胞周期蛋白依赖性激酶抑制剂1(P21、)细胞周期蛋白D1(CyclinD1)、B 淋巴细胞瘤-2(Bcl-2)以及B 淋巴细胞瘤-2 相关X 蛋白(Bax)单克隆抗体均由武汉博士德生物技术有限公司提供,兔抗人甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体和山羊抗兔二抗多克隆抗体由武汉博士德生物技术有限公司提供,羊抗人KLF15 多克隆抗体由美国Abcam 公司提供,逆转录、PCR 试剂盒均由深圳晶美生物工程有限公司提供,PCR引物由上海生工生物工程有限公司提供。
1.2 实验方法
1.2.1SKOV3细胞培养和转染 复苏SKOV3细胞,用含10%胎牛血清的RPMI 1640 培养基培养,常规在37 ℃、5%二氧化碳、97%湿度的培养箱培养,当细胞融合至90%时,常规进行细胞清洗、消化及传代培养。取对数生长期SKOV3细胞,1×105个/孔接种于6孔板,细胞融合达到60%时,以不含胎牛血清的RP‑MI 1640 培养基进行更换。将pcDNA-KLF15、pcD‑NA、si-KLF15和si-NC转染至SKOV3细胞。转染6 h后,以含10%胎牛血清的RPMI 1640 培养基进行更换,于转染48 h 时进行qRT-PCR 验证无误后再收集细胞进行后续实验,均严格按试剂盒说明进行操作。
1.2.2细胞分组 未转染的SKOV3 细胞根据鱼藤素剂量分为低剂量鱼藤素组(Deguelin-L)、中剂量鱼藤素组(Deguelin-M)、高剂量鱼藤素组(Deguelin-H)及对照组(Control)。对照组细胞用常规培养基进行培养,Deguelin-L、Deguelin-M、Deguelin-H 组细胞分别用含2.5 µmol/L、5 µmol/L、10 µmol/L[6]鱼藤素的培养基培养。转染pcDNA-KLF15、pcDNA 的细胞常规培养基正常培养,分别记为pcDNA-KLF15 组和pcDNA 组。用含10µmol/L 鱼藤素的培养基对转染si-KLF15、si-NC 的细胞进行培养,分别记为Degue‑lin+si-KLF15组和Deguelin+si-NC组。
1.2.3CCK-8 检测细胞增殖 未转染及转染后的SKOV3 细 胞 以0.5×104个/孔 接 种 于96 孔 板,按“1.2.2”中分组方法进行分组处理,每组3 个复孔。在培养48 h 时,每孔加入CCK-8 工作液100µL。继续培养2 h 后,应用酶标仪对450 nm 处光密度值(OD)进行测定。OD值越小表明细胞活性越低。
1.2.4流式细胞仪检测细胞凋亡 未转染及转染后的SKOV3 细胞以2.5×104个/孔接种于24 孔板,按“1.2.2”中分组方法进行分组处理,每组3个复孔。在培养48 h时,吸弃培养基,用0.25%胰蛋白酶进行消化,并收集细胞。取1.0×106个细胞,用PBS进行2次清洗,并与500µL结合缓冲液混匀。依次加入10µL的膜联蛋白V-FITC(Annexin V-FITC),5 µL 碘化丙啶(PI),混匀后室温下避光孵育10 min,用流式细胞仪严格按凋亡检测试剂盒说明检测细胞凋亡情况。
1.2.5Western blotting 法检测细胞中相关蛋白表达 未转染及转染后的SKOV3 细胞以2.5×104个/孔接种于24 孔板,按“1.2.2”中分组方法进行分组处理,每组3 个复孔。在培养48 h 时,吸弃培养基,用0.25%胰蛋白酶进行消化,并收集细胞。常规加入RIPA细胞裂解液对细胞蛋白进行提取,BCA蛋白试剂盒对蛋白含量进行检测,取适量蛋白溶液进行蛋白变性后,进行SDS-PAGE,将分离的蛋白凝胶转移至PVDF 膜,常规室温封闭2 h。分别加入P21(兔抗人单克隆抗体,1∶1 000)、CyclinD1(兔抗人单克隆抗体,1∶2 000)、Bcl-2(兔抗人单克隆抗体,1∶2 000)、Bax(兔抗人单克隆抗体,1∶2 000)、KLF15(羊抗人多克隆抗体,1∶1 000)及GAPDH(兔抗人多克隆抗体,1∶2 000)一抗,4 ℃进行24 h 孵育。TBST 洗膜。加入辣根过氧化酶标记的二抗(山羊抗兔多克隆抗体,1∶5 000),室温孵育1 h。TBST洗膜。加入ELC,暗室显影、拍照。以GAPDH 为内参,应用Image J软件对各蛋白条带灰度值进行分析,并计算各蛋白相对表达水平。
1.2.6实时荧光定量PCR(RT-qPCR)检测KLF15 mRNA 表达 未转染的SKOV3 细胞以2.5×104个/孔接种于24孔板,按照“1.2.2”中分组方法进行分组处理,每组3 个复孔。在培养48 h 时,吸弃培养基,用0.25%胰蛋白酶进行消化,并收集细胞。Trizol试剂对细胞总RNA 进行提取,应用紫外分光光度计对RNA的纯度及浓度进行定量检测。按逆转录试剂盒说明快速将RNA 逆转录为cDNA。PCR 扩增条件:95 ℃预变性5 min,95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,共35 个循环。引物序列:KLF15 正向引物5'-GCGTAGA GTCHAGCTGCTGAACG-3',反向 引 物 5'-CGAAAGCTGCGAACCGTCGATGC-3';GAPDH 正向引物5'-CGAGAGAATCCGCGGACAT-3',反 向 引 物5'-TTGTGCAATACAGCGTGGAC-3'。以GAPDH 为内参,2-ΔΔCt法计算KLF15mRNA 的相对表达水平。
1.3 统计学方法应用SPSS 22.0 软件对实验数据进行分析。计量资料均符合正态分布,以xˉ±s表示。两组间比较采用两独立样本t检验。多组间比较采用单因素方差分析及两两比较的SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 鱼藤素对卵巢癌细胞增殖的影响与对照组比较,鱼藤素组SKOV3 细胞活性及CyclinD1 蛋白表达水平降低(P<0.05),P21 蛋白表达水平升高(P<0.05),且具有剂量依赖性(P<0.05)。见图1,表1。
表1 鱼藤素对SKOV3细胞活性及CyclinD1和P21蛋白表达的影响/±s

表1 鱼藤素对SKOV3细胞活性及CyclinD1和P21蛋白表达的影响/±s
注:Control为对照组,Deguelin-L为低剂量鱼藤素组,Deguelin-M为中剂量鱼藤素组,Deguelin-H 为高剂量鱼藤素组,P21 为细胞周期蛋白依赖性激酶抑制剂1,CyclinD1为细胞周期蛋白。
?

图1 鱼藤素对SKOV3细胞中CyclinD1和P21蛋白表达的影响
2.2 鱼藤素对卵巢癌细胞凋亡的影响与对照组比较,鱼藤素组SKOV3细胞凋亡率、Bax蛋白表达水平升高(P<0.05),Bcl-2 蛋白表达水平降低(P<0.05),且具有剂量依赖性(P<0.05)。见图2,表2。
表2 鱼藤素对SKOV3细胞凋亡及Bax和Bcl-2蛋白表达的影响/±s

表2 鱼藤素对SKOV3细胞凋亡及Bax和Bcl-2蛋白表达的影响/±s
注:Control为对照组,Deguelin-L为低剂量鱼藤素组,Deguelin-M为中剂量鱼藤素组,Deguelin-H 为高剂量鱼藤素组,Bcl-2 为B 淋巴细胞瘤-2,Bax为B淋巴细胞瘤-2相关X蛋白。①与Control 组比较,P<0.05。②与Deguelin-L 组比较,P<0.05;③与Deguelin-M组比较,P<0.05。
?

图2 鱼藤素对SKOV3细胞凋亡及Bax和Bcl-2蛋白表达的影响:A为流式细胞术检测鱼藤素作用SKOV3细胞后细胞凋亡情况;B为Western blotting检测鱼藤素作用SKOV3细胞后细胞中Bax和Bcl-2蛋白表达
①与Control 组比较,P<0.05。②与Deguelin-L 组比较,P<0.05。③与Deguelin-M组比较,P<0.05。
2.3 鱼藤素对卵巢癌细胞KLF15 表达的影响与对照组比较,鱼藤素组SKOV3细胞中KLF15蛋白表达水平升高(P<0.05),且具有剂量依赖性(P<0.05)。见图3,表3。
表3 鱼藤素对SKOV3细胞中KLF15表达的影响/±s

表3 鱼藤素对SKOV3细胞中KLF15表达的影响/±s
注:Control为对照组,Deguelin-L为低剂量鱼藤素组,Deguelin-M为中剂量鱼藤素组,Deguelin-H 为高剂量鱼藤素组,KLF15 为Krup‑pel样因子15。①与Control 组比较,P<0.05。②与Deguelin-L 组比较,P<0.05。③与Deguelin-M组比较,P<0.05。
?

图3 鱼藤素对SKOV3细胞中KLF15蛋白表达的影响
2.4 上调KLF15 表达对卵巢癌细胞增殖和凋亡的影响与pcDNA 组比较,pcDNA-KLF15 组SKOV3细胞活性、CyclinD1 及Bcl-2 蛋白表达水平降低(P<0.05),细胞凋亡率、P21及Bax蛋白表达水平升高(P<0.05)。见表4,5。
表4 上调KLF15表达对SKOV3细胞活性及CyclinD1和P21蛋白表达的影响/±s

表4 上调KLF15表达对SKOV3细胞活性及CyclinD1和P21蛋白表达的影响/±s
注:KLF15 为Kruppel样因子15,pcDNA 为空载体,pcDNAKLF15 为KLF15 过表达载体,P21 为细胞周期蛋白依赖性激酶抑制剂1,CyclinD1为细胞周期蛋白D1。
?
2.5 下调KLF15 表达降低了鱼藤素对卵巢癌细胞增殖和凋亡的影响与鱼藤素+si-NC 组比较,鱼藤素+si-KLF15 组SKOV3 细胞活性、CyclinD1 及Bcl-2蛋白表达水平升高(P<0.05),细胞凋亡率、P21 及Bax蛋白表达水平降低(P<0.05)。见表6,7。
表5 上调KLF15表达对SKOV3细胞凋亡及Bax和Bcl-2蛋白表达的影响/±s

表5 上调KLF15表达对SKOV3细胞凋亡及Bax和Bcl-2蛋白表达的影响/±s
注:KLF15 为Kruppel 样 因 子15,pcDNA 为 空 载 体,pcDNAKLF15 为KLF15 过表达载体,Bcl-2 为B 淋巴细胞瘤-2,Bax 为B 淋巴细胞瘤-2相关X蛋白。
?
表6 下调KLF15表达对鱼藤素作用的SKOV3细胞活性及CyclinD1和P21蛋白表达的影响/±s

表6 下调KLF15表达对鱼藤素作用的SKOV3细胞活性及CyclinD1和P21蛋白表达的影响/±s
注:KLF15为Kruppel样因子15,Deguelin+si-NC为鱼藤素+乱序无意义阴性序列,Deguelin+si-KLF15为鱼藤素+LF15的小干扰RNA,P21为细胞周期蛋白依赖性激酶抑制剂1,CyclinD1为细胞周期蛋白D1。
?
表7 下调KLF15表达对鱼藤素作用的SKOV3细胞凋亡及Bax和Bcl-2蛋白表达的影响/±s
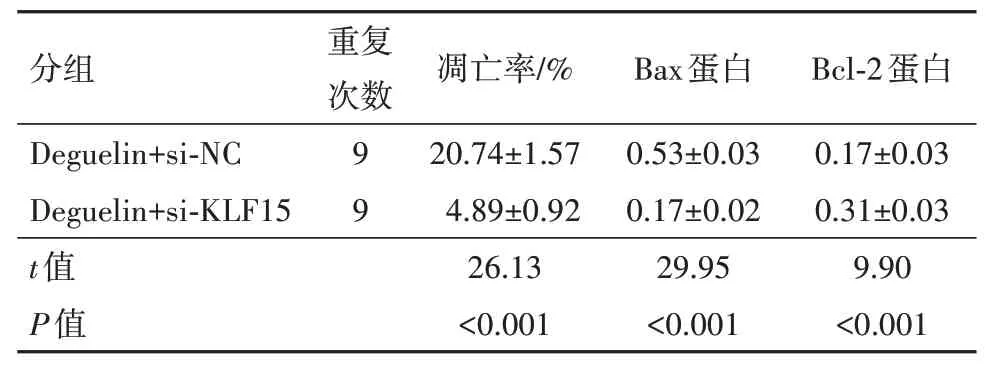
表7 下调KLF15表达对鱼藤素作用的SKOV3细胞凋亡及Bax和Bcl-2蛋白表达的影响/±s
注:KLF15 为Kruppel 样因子15,Deguelin+si-NC 为鱼藤素+乱序无意义阴性序列,Deguelin+si-KLF15 为鱼藤素+KLF15 的小干扰RNA,Bcl-2为B淋巴细胞瘤-2,Bax为B淋巴细胞瘤-2相关X蛋白。
?
3 讨论
近年来研究显示,鱼藤素可通过调控多条信号通路调控肿瘤细胞的生物学行为,并且对正常组织细胞无明显损伤,具有良好的应用前景[7-8]。如Chen等[9]研究显示,鱼藤素能通过时间及剂量依赖性发挥其抑制结肠癌细胞系SW620及RKO增殖的作用,并诱导细胞凋亡,其机制与激活p38 MAPK 途径有关。Li 等[10]研究显示,鱼藤素通过下调B 细胞特异的莫洛尼白血病毒插入位点1(Bmi1)表达抑制非小细胞肺癌细胞的生长。Ye等[11]研究显示,鱼藤素通过下调半乳糖凝集素-1(Galectin-1)的表达诱导肺鳞状细胞癌细胞凋亡。但目前,鱼藤素对卵巢癌细胞增殖和凋亡的影响及机制还未知。
细胞增殖异常是恶性肿瘤生物学特征之一,抑制肿瘤细胞增殖可延缓肿瘤进展。CyclinD1作为一种细胞周期调控因子,其高表达能加速细胞分裂由G1期向S期转化,从而促进细胞的增殖[12-13]。而P21作为一种肿瘤抑制因子,其高表达能抑制细胞增殖[14]。本研究显示,2.5µmol/L、5µmol/L、10µmol/L的鱼藤素作用于卵巢癌SKOV3细胞后,细胞活性及CyclinD1 蛋白表达降低,P21 蛋白表达升高,这表明鱼藤素对SKOV3细胞增殖具有抑制作用。诱导肿瘤细胞凋亡是肿瘤临床治疗的一种途径。促凋亡蛋白Bax 及抗凋亡蛋白Bcl-2 共同参与细胞凋亡的调控,Bax 表达增加诱导细胞凋亡,而Bcl-2 表达增加则会抑制细胞凋亡[15-16]。本研究中鱼藤素可提高SKOV3细胞凋亡率及Bax蛋白表达,抑制Bcl-2蛋白表达,并存在剂量依赖性,说明鱼藤素具有诱导SKOV3细胞凋亡的作用,可能是潜在的治疗卵巢癌的药物。
KLF15 作为KLFs 家族成员,N 端的丝氨酸和脯氨酸,能发挥转录激活功能,有研究表明,KLF15 参与了多种肿瘤的发生及发展,可能作为肿瘤分子治疗的潜在靶点[17-18]。研究显示,KLF15 蛋白在肺腺癌组织中呈低表达,且生存率也随其表达的降低而降低,上调其表达对肺腺癌细胞生长具有明显抑制作用,可作为肺腺癌病人的潜在治疗靶点和预后分子标志物[19]。KLF15 蛋白在胃癌组织中呈低表达,其表达水平与病人临床分期呈负相关,且表达水平越低,淋巴结及远处转移风险越高,上调KLF15 表达可抑制胃癌细胞增殖[20]。本研究通过转染KLF15过表达载体上调KLF15 表达后,SKOV3 细胞的活性降低,细胞凋亡率升高,表明上调KLF15 表达对SKOV3 细胞增殖具有抑制作用,并能促进细胞凋亡,可作为卵巢癌分子治疗的潜在靶点。本研究还显示,鱼藤素可促进卵巢癌SKOV3细胞中KLF15蛋白及mRNA 的表达,而下调KLF15 表达能逆转鱼藤素抑制SKOV3细胞增殖及促进细胞凋亡的作用,提示鱼藤素能通过上调KLF15 表达抑制SKOV3 细胞的增殖,同时诱导SKOV3细胞的凋亡。
综上所述,鱼藤素可有效抑制卵巢癌SKOV3细胞增殖,并诱导细胞凋亡,其可能通过上调细胞中KLF15 表达发挥作用,具有开发为治疗卵巢癌药物的潜在价值。
