基于转录组数据开发福建柏EST-SSR标记
2022-06-28苏顺德
苏顺德
(福建省林业科学研究院、国家林业和草原局南方山地用材林培育重点实验室、福建省森林培育与林产品加工利用重点实验室,福建 福州 350012)
福建柏(Fokieniahodginsii(Dunn) Henry et Thomas)是一种广泛分布于越南北部及浙江、福建、江西、湖南、广东、贵州、四川等中国东南部至西南部的优良针叶材用树种[1]。分布于海拔500~1000 m的山地中,喜潮湿环境,最适湿度为80%~89%,降水量为1600~2000 mm,年平均气温在11.5~16.5 ℃。从福建沿海东部至云贵高原东南部的南岭山脉均有福建柏的分布[2]。由于其良好的用材特性,福建柏被当地居民和林业企业过度开发,造成福建柏在次生林中离散分布。因此,福建柏在1999年被列为国家二级重点保护野生植物,2004年被列入中国濒危物种红色名录,2021年仍为国家二级重点保护野生植物[3]。自1996年起,学者对现存的中国野生福建柏开展了相关遗传育种研究[4-6],但是由于其种群数量少、且缺少该种的遗传多样性信息,仍很难确定其最佳的保护策略与育种方式。截至目前,仅发现8个ISSR(Inter-simple Sequence Repeat)分子标记可用于研究福建柏(越南种源)的遗传变异[7]。这在很大程度上限制了可监控其种群变化与开展保护性遗传检测的空间。简单重复序列又称为微卫星标记(SSR),是以1~6个核苷酸为重复单位串联而成的长度为几十个核苷酸的重复序列,广泛分布于整个基因组,按照其来源可分为表达序列标签SSR(EST-SSR)和基因组SSR(gSSR),基于表达序列标签的微卫星标记相较于其它分子标记具有良好的重复性、多态性和共显性等优点,且有利于已知基因的定位[8-9]。同时,EST分析在生物信息学分析中占据重要地位,EST分析数据为基因组研究、遗传分析和种质资源鉴定提供了保证。目前,基于转录组数据的SSR标记开发已被广泛应用,技术及流程已日渐成熟,如在红松(Pinuskoraiensis)、杉木(Cunninghamialanceolata)等物种的应用中[10-11]足以证明利用转录组测序技术开发裸子植物SSR标记的高效性,尤其是对于缺乏基因组背景信息的大量非模式植物。因此,本研究利用Illumina技术对福建柏RNA测序并对转录组组装,通过开发转录组数据库建立了一套双核苷酸或三核苷酸即密码子的微卫星标记系统。开发的EST-SSR分子标记丰富了福建柏的基因库,可为该物种的遗传多样性和种群结构的进一步分析及其生境适应机制研究提供参考。
1 材料与方法
1.1 样本采集
2018年12月,在福建省南靖国有林场(福建省漳州市南靖县)1998年营建的福建柏种源试验林中采集福建柏新鲜幼嫩叶片装入自封袋中,标记后迅速置于液氮罐中冷冻保存,带回实验室供后续实验使用。福建柏3个种群(湖南道县种群、江西上犹种群、福建安溪种群)共57个个体测序,其植物标本保存于北京林业大学植物标本室(BJFC)。主要试剂和仪器见表1和表2。

表1 CTAB提取RNA主要试剂

表2 CTAB提取RNA主要仪器设备
1.2 提取叶片RNA
使用十六烷基三甲基溴化铵法(Cetyltrimethylammonium Ammonium Bromide,CTAB)提取福建柏新鲜叶片的RNA,在研磨阶段加入聚乙烯吡咯烷酮(PVP)和β-巯基乙醇去除酚类化合物。CTAB是一种阳离子去污剂,用其裂解福建柏叶片组织细胞,在离子浓度较高的溶液中,容易与多糖及蛋白质聚形成复合物,但不足以沉淀核酸。利用有机溶剂去除酚类、多糖以及蛋白等物质,再用无水乙醇沉淀分离核酸。
具体步骤为:①取CTAB缓冲液800 μL及β-巯基乙醇20 μL加入1.5 mL的RNase-free离心管中,充分混匀,置于65 ℃水浴中预热10 min;②取约100 mg福建柏新鲜叶片用锡箔纸包好置于液氮中冷冻5~10 min后取出并放入研钵中,加入PVP,用液氮研磨至粉末状;③将研磨后的福建柏叶片粉末加入经过65 ℃水浴预热10 min的CTAB缓冲液中,用漩涡震荡仪充分震荡30 s,65 ℃水浴加热20 min,每间隔5 min充分震荡1次,共计震荡3次;④ 4 ℃条件下,12000 r·min-1离心15 min,将上清液转移至1.5 mL的RNase-free离心管中,加入等体积的异戊醇,充分混匀4 min;⑤ 4 ℃条件下,12000 r·min-1离心10 min,取上层清液转移到新的1.5 mL的RNase-free离心管中,加入相同体积氯仿抽提、混匀,冰浴5 min;⑥ 4 ℃条件下,12000 r· min-1离心10 min,取上层清液转移到新的1.5 mL的RNase-free离心管中,并加入2倍上清液体积的预冷后的无水乙醇,经上下颠倒混匀2 min,于-20 ℃沉淀2 h;⑦ 4 ℃条件下,12000 r· min-1离心15 min,吸除上清液,用75%乙醇洗涤至底部乳白色沉淀弹起,并充分颠倒混匀;⑧ 4 ℃条件下,10000 r· min-1离心10 min,吸除上清液,并用移液枪吸除离心管内残留的少量上清液,置于超净台上吹干沉淀,直至沉淀呈无色透明状;⑨向RNase free离心管中加入水20~50 μL用于溶解沉淀,并用移液枪缓慢吸打沉淀,待RNA完全溶解后,吸取5 μL进行检测,检测其OD值和电泳情况,将合格的RNA样品(OD260/OD280>1.8;28 S和16 S条带完整,且28 S条带的亮度应显著超过16 S条带)放入-70 ℃中保存备用,对质量检测不合格的RNA样品进行重新提取。
1.3 文库构建、转库组测序及分析
采用CTAB法提取RNA后,利用NEBNext Library Preparation Kit(Illumina)试剂盒构建转录组文库,并用Illumina HiSeq 2500系统对RNA进行测序(HonorTech Co.,Beijing,China)。下机后的原始数据使用Urinity软件进行质控,并合并所有样本中的有效数据对其进行双向拼接[12]。利用默认设置的MISA软件的微卫星识别工具(MIcroSAtellite identification tool,MISA)对组装后的片段进行SSR的识别与检测。从EST中筛选出最小重复数为6、最小长度为150 bp的微卫星,并从中选择双核苷酸、三核苷酸或四核苷酸位点进一步评估。
1.4 EST-SSR位点的PCR筛选
为了验证EST-SSR位点的扩增效率,使用3个福建柏种群中4个混合DNA进行PCR分析(表3)。使用植物基因组DNA试剂盒(中国北京天根)从冰冻叶片中提取总基因组DNA,将一个M13尾部(FAM、HEX、TAMRA和ROX)连接到正向引物[13]上用于显示。PCR的最终反应体积为20 μL,内含约1 μL(10 ng)基因组DNA、0.3 μL正向和0.6 μL反向引物、0.4 μL荧光染料标记的M13引物(4 pM)和10 μL 2×Screening Fire Taq Master Mix(中国北京天根)。根据片段大小的不同,采用不同的PCR热循环条件,分别为:95 ℃变性45 s,55 ℃退火性45 s,72 ℃延伸45 s;或是95 ℃预变性5 min,95 ℃变性30 s,53 ℃退火性30 s,72 ℃延伸30 s。2种PCR条件均需营95 ℃预变性5 min,最后72 ℃延伸10 min,循环30次。PCR产物通过1 %TBE琼脂糖凝胶进行电泳检测。
1.5 EST-SSR标记在基因座中多态性的分析
SSR标记在指纹图谱构建中的效率与其在研究对象中的多态性密切相关,一般多态性高的标记效率高。为了确定每个基因座的多态性,对来自不同种群的8个个体(表3),使用不同引物(表4)进行扩增,在ABI 3730测序仪(美国马萨诸塞州沃尔瑟姆应用生物系统公司)上进行最后毛细管电泳分析后,用GeneMarker 2.20版本(美国宾夕法尼亚州州立大学)进行SSR等位基因的分析。
1.6 EST-SSR基因座遗传参数的分析
对2个近缘种千头柏和圆柏进行12对引物的交叉扩增结果,使用GenAlEx 6.5计算基因多样性参数,例如每个基因座的等位基因数(A)、观察杂合度(Ho)、期望杂合度(He)[14]。使用CERVUS 3.0计算等位基因多态性信息含量(PIC)[15]。
2 结果与分析
通过转录组测序共计获得63883382个原始序列片段(63 Mbp,GenBank Short Read Archive accession SRP190969,BioProject ID PRJNA531067)。组装后获得45257个相似片段,共检测出4941个SSR标记,其中109个符合EST-SSR的筛选标准。进一步对获得的109个EST-SSR标记进行扩增效率的检测发现总计84个位点能被检测到。在这84个基因座中,71个基因座清晰可见,其中12个基因座在最初筛选的8个个体中具有较高多态性,这12个位点产生1~2条带(表4)。

表4 基于福建柏开发的12个多态性微卫星特点
12个多态性EST-SSR基因座计算后的遗传参数见表5,每个基因座等位基因数2~6个不等,平均每个基因座有3.026个等位基因。观察杂合度(Ho)和期望杂合度(He)分别在0~1和 0.051~0.775之间,3个种群的总平均值分别是0.277和0.420。另外,PIC的值在0.139~0.784之间,平均值为0.482。而据报道湖南、广西、福建的3个福建柏种群中各15个个体共计45个个体开发的EST-SSR标记平均观察杂合度为0.540,平均期望杂合度为0.480[16]。

表5 福建柏12个微卫星的遗传多样性参数

表5(续)
在对2个亲缘种(来自河南郏县的侧柏和来自奥林匹克森林公园的圆柏,表3)进行12对多态性引物的跨种扩增中,除FJB5和FJB42基因座外,均成功扩增了侧柏和圆柏并产生清晰条带。最终,用10个引物对2个近缘种进行特异性扩增。在侧柏和圆柏中,未能成功扩增的引物对分别为FJB6-2和FJB91-2(表6)。种间扩增影响可能与种间的系统发育有部分关系[17]。一些引物对(FJB63和FJB73)能特异扩增侧柏的2条不同带,一些引物对(FJB7、FJB23、FJB63和FJB83)能特异扩增圆柏的2条不同带。
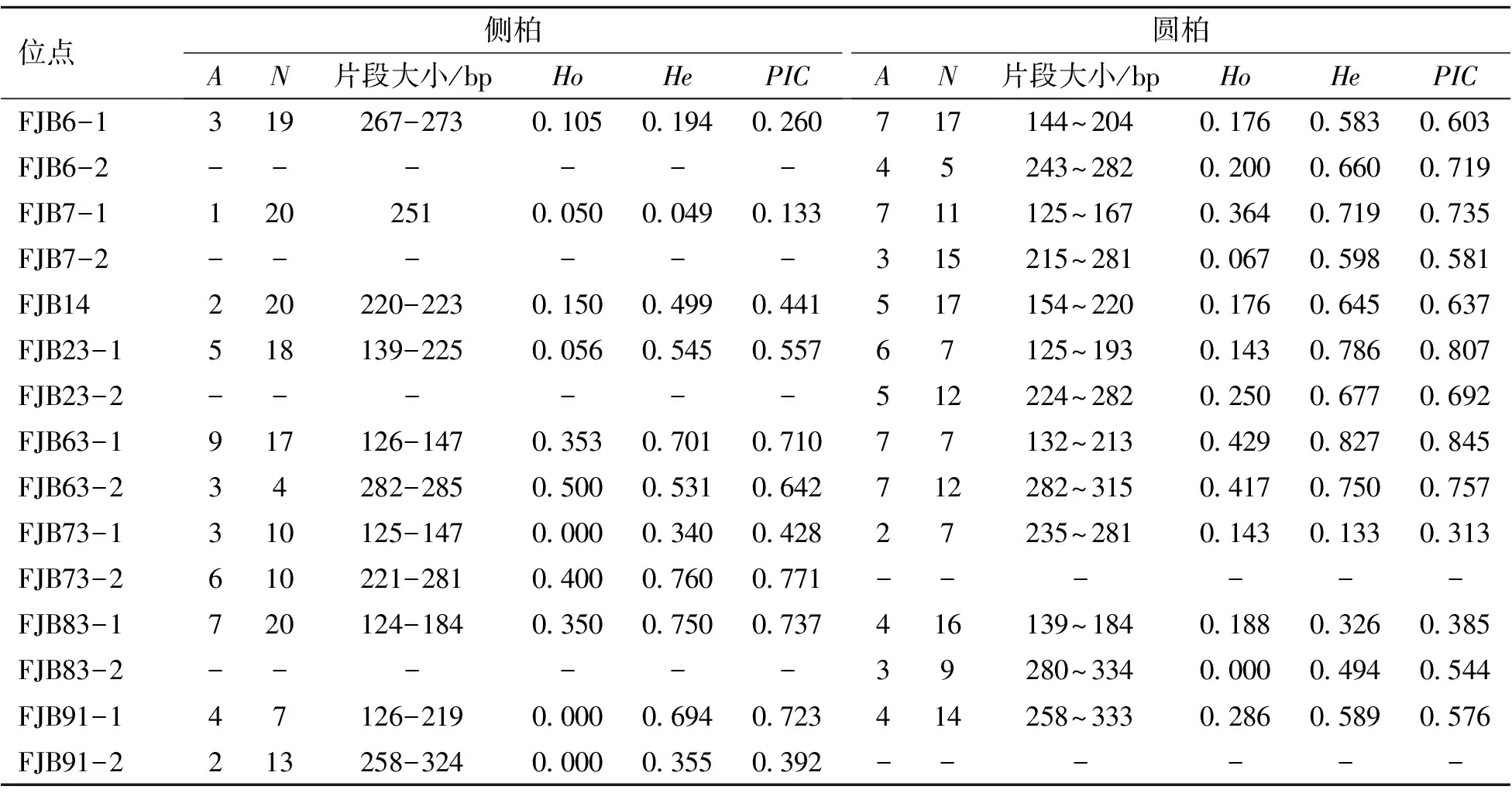
表6 福建柏11个微卫星多态位点在侧柏和圆柏中交叉扩增结果
3 结论与讨论
相比于基因组SSR标记,EST-SSR标记对于无参考基因组序列的物种而言,开发成本低廉、高效。EST-SSR标记来源于相对保守的转录区域,具有更高的通用性和保守性,可在相近种属中使用。其次与特定功能的基因联系密切,更容易与表型性状相关联[18-19]。而基于转录组测序的EST-SSR开发,省时廉价,性价比高,特别是对于缺乏遗传背景的非模式生物具有显著优势[20]。福建柏因其良好的用材性能,近年来被过度采伐,致使天然林面积日益缩小,更新能力减弱,因而被列为我国二级保护植物,也被国际自然保护联盟列为易危植物。
本研究中,12对引物的平均等位基因数是3.026个,观察杂合度(Ho)和期望杂合度(He)的平均值分别为0.277和0.420,EST-SSR位于基因转录组序列,相对保守。PIC是评估基因变异程度的重要指标,研究表明,高度多态性的引物PIC>0.5,中度多态性引物0.25
