湘西石漠化区3种造林模式土壤真菌群落结构差异
2022-06-27刘立玲周光益邱丽琼朱宁华1
刘立玲,周光益,党 鹏,陈 洁,尚 海,邱丽琼,朱宁华1, ,*
1 中南林业科技大学林学院,长沙 410004 2 中国林业科学研究院热带林业研究所,广州 510520 3 武陵山石漠化综合治理国家长期科研基地,吉首 416000
石漠化是我国西南山地突出的环境问题,岩石裸露率高,生态系统脆弱,植被退化是石漠化发展的重要原因和标志[1—2],而植被恢复是控制石漠化发展的重要途径。已有学者对石漠化地区植被恢复过程开展了一些研究,如植被恢复模式[3]、次生林群落特征及林分结构[4]、植物多样性及分布[5—7]以及土壤养分变化[8—10]等,但有关石漠化区不同造林模式下土壤微生物群落结构尚研究较少。
土壤微生物是土壤生态系统的重要组成成分,与土壤氮、磷等营养元素含量密切相关,进而影响地上植被组成及结构[11],而地上植被通过有机物输入等调节地下微生物群落结构,使土壤微生物组成及多样性存在差异,植被与微生物在不同土壤养分条件下形成反馈调节[12—15]。土壤微生物对环境的变化十分敏感,能提高对抗土壤生态环境恶化的缓冲能力[16—17]。土壤真菌作为分解者,广泛参与森林生态系统中有机质和大分子物质的分解,尤其是酸性森林土壤,能有效改善土壤质地和结构,参与营养元素的生物化学循环,同时也会影响植物根际微生物的结构[18],与细菌相比,土壤真菌更能有效利用碳源,对干旱环境更具有适应性优势。研究表明,土壤真菌可以作为森林干扰中土壤健康的指标[19],真菌群落结构主要受到植被类型[20]或土地管理措施[21]的影响,不同林型土壤真菌群落组成和多样性存在明显差异。
目前有关石漠化地区森林土壤真菌群落特征及其影响机制的研究相对匮乏,探究石漠化区不同造林模式对真菌群落组成特征及多样性对揭示石漠化区不同植被恢复模式下土壤质量的演变及其驱动因子具有重要意义。本研究以湘西自治州森林生态研究实验站石漠化区的植被恢复地作为研究对象,利用高通量测序技术对不同造林模式林地的土壤真菌群落进行测定,研究不同造林模式对土壤真菌群落的影响,旨在揭示不同造林模式下土壤真菌多样性和群落组成的差异及其主要土壤环境影响因子,研究结果可进一步增强对石漠化生态系统中土壤微生物群落组成的认识,为预测生态系统对环境变化的响应提供理论依据。
1 材料与方法
1.1 研究区概况
试验区位于湖南省湘西自治州森林生态研究实验站(109°10′E,27°44.5′N),大陆性季风气候明显,境内年平均降水量1300—1500 mm,年平均温度16.3 ℃,年无霜期269—292 d,年日照时数为1340 h。该地的母岩分布主要是石灰岩,土壤以黄棕壤为主。试验林均1989年以2 m×3 m的株行距营造的人工林,其中,马尾松(Pinusmassoniana)和光皮桦(Betulaluminifera)混交林是按1∶1的比例进行株间混交造林,并根据间密留疏的原则对中幼龄林进行抚育管理,之后人为干扰较小。所选样地初植密度均为1650株/hm2。各样地自然概况见表1。

表1 样地概况
1.2 样地设置与样品采集
于2019年7月在对照样地及3种造林地分别设置3个20 m×20 m的标准样方,并在每个样方内采用“S”形5点采样法确定采样点(共计15个),取样前去除土壤表层的凋落物,在样点做土壤剖面,采集0—20 cm土层土样,将每个样方中5个采样点所采集的土壤样品混合均匀。将一部分土样无菌塑料袋中并编号放于恒温箱内带回实验室,用于土壤微生物多样性的分析(高通量测序,样品需装入已灭菌的2 mL冻存管中进行-80 ℃保存)。其余部分经过风干处理后,用于土壤理化性质等指标的测定。
1.3 土壤理化性质测定
分别测定四组样品的土壤含水率(SWC)、pH值、土壤有机碳(SOC)、全氮(TN)、全磷(TP)等指标。其中,SWC采用烘干法(105℃,8 h);pH值用水浸提电位法(酸度计FE20K,Mettler)测定;SOC采用重铬酸钾-外加热硫酸氧化法(LY/T 1237—1999)进行测定;土壤 N、P 则分别采用半微量凯氏定氮法(LY/T 1228—1999)和钼锑抗比色法(LY/T 1232—1999)进行测定[22]。
1.4 土壤总DNA提取、PCR扩增及测序
1.4.1土壤总DNA 提取、PCR扩增
转移 250—500 mg 的新鲜样品到 2.0 mL进口离心管中,将 NucleoSpin Bead Tube中的研磨珠倒入样品管内,加入700 μL的SL2;再加150 μL的Enhancer SX,盖紧离心管,涡旋混匀,将样品管放入震荡混匀仪,于70 ℃下以1000—1200 rpm 震荡10 min,裂解完毕的样品,经过12000 rpm离心2 min,转移大约700 μL上清液到新的2.0 mL进口离心管中加入150 μL SL3,颠倒混匀后,4 ℃孵育5 min,12000 rpm 离心2 min;过滤去除抑制剂,进行DNA结合,清洗并且干燥硅基质膜,将DNA洗脱后转至新的1.5 mL进口离心管中备用。
选用长度约为250 bp的真菌ITS基因的高度可变的ITS1区为目标片段,使用ITS1F: CTTGGTCATTTAGAGGAAGTAA和ITS4:TCCTCCGCTTATTGATATGC通用引物组从每个样本提取的基因组DNA中扩增全长ITS rRNA基因。使用KOD One PCR主混合物(TOYOBO Life Science)进行为期25个周期的PCR扩增。
1.4.2高通量测序及OTU的划分
PCR 扩增产物的定量测定、均一化、文库制备、上机测序及数据质量控制等均由百迈客云平台完成。上机测序采用Illumina HiSeq测序平台。利用双末端测序(Paired-End)的方法,构建小片段文库进行测序。通过对原始测序序列进行过滤、双端拼接,得到优化序列(Tags),将优化序列进行聚类,划分OTU,并根据OTU的序列组成得到其物种分类,将相似性97%的序列进行聚类,基于分类单元进行物种注释,将测序错误序列及丰度值低于全体样本测序总量0.001%的OTU去除,将去除了稀有OTU的丰度矩阵用于后续的系列分析。
1.5 重要值计算方法
物种重要值是描述植物多样性的重要指标[23],其计算公式如下:
重要值(%)=(相对密度+相对优势度+相对频度)/3×100%
(1)
相对密度(%)=(某种植物的个体数/全部植物的个体数)×100%
(2)
相对优势度(%)=(样方中该种个体总面积/样方中全部个体总面积)×100%
(3)
相对频度(%)=(某种在全部样方中的频度/所有种频度之和)×100%
(4)
1.6 土壤微生物菌群稳定性计算方法
对于所取的土壤样本,引入特异性测量(Specific measurement,SPM)算法[24]来量化菌群的丰度变化情况,依据群落丰度的变化(SPM值),采用参数分散法(DPM)评价微生物群落的稳定性[25]。计算过程如下:
首先将某微生物种群丰度(X)转换为对应的向量X:
X= (X1,X2,…,Xi,…,Xn-l,Xn)
(5)
Xi= (0, 0,…,Xi,…, 0, 0)
(6)
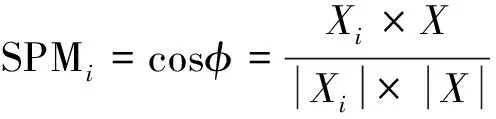
(7)
式中,n代表微生物种群的数量,Xi代表第i个微生物种群的丰度,向量Xi代表该菌群在第i个样本的丰度;φ为样品中的微生物菌群丰度。
将某微生物种群丰度(X)转换为对应的SPM值(XSPM):
XSPM=(SPM1,SPM2,…,SPMi,…SPMn-1,SPMn)
(8)
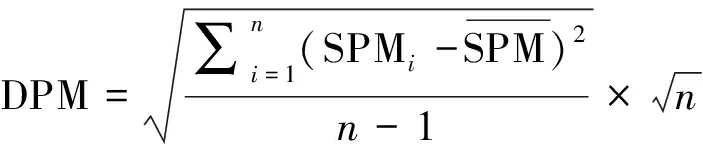
(9)
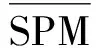
1.7 数据处理及分析
对样品α多样性(Alpha diversity)指数的分析采用Mothur软件进行,计算ACE、Chao1、Shannon和Simpson等物种多样性指数。采用SPSS 25.0对不同造林模式下土壤理化性质及真菌群落多样性差异进行单因素方差分析,比较不同造林模式下的差异显著性校验采用多元方差分析(PERMANOVA)。通过Mantel检验和冗余度分析(RDA)分析了真菌与土壤环境因子的关系。所有的统计分析都是在R 3.5.1中用“vegan”包进行的。
2 结果与分析
2.1 不同造林模式下优势植物种及重要值
重要值是确定某种植物在群落中相对重要性的一个综合性指标,能有效反映不同植被类型中各种植物在群落中的功能地位及分布格局[26]。不同造林模式下主要植物组成及重要值见表2。表2显示:圆叶鼠李(Rhamnusglobosa)在光皮桦纯林和混交林中重要值最大,分别为6.56、7.58,寒莓(Rubusbuergeri)和灰白毛莓(Rubustephrodes)分别是马尾松纯林和未造林灌草地中重要值最大的灌木种。草本层中,马兰(Kalimerisindica)在光皮桦纯林中和混交林中重要值均最大,分别为16.12、17.78,而在马尾松纯林中是毛蕨(Cyclosorusinterruptus)的重要值最大,为15.12,而过路黄(Lysimachiachristiniae)在未造林灌草地中的重要值最大,值为17.75。未造林灌草地由于没有高大乔木,光照充足,灌草种类要多于人工林。

表2 不同造林模式下主要植物组成及重要值
2.2 不同造林模式下的土壤理化性质
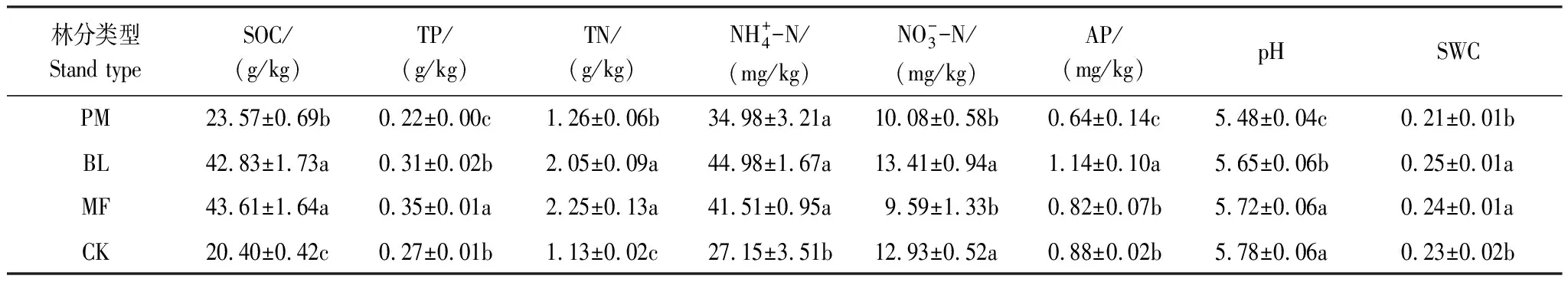
表3 不同造林模式下土壤理化性质的变化(平均值±标准误)(0—20 cm)
2.3 不同造林模式下土壤真菌组成
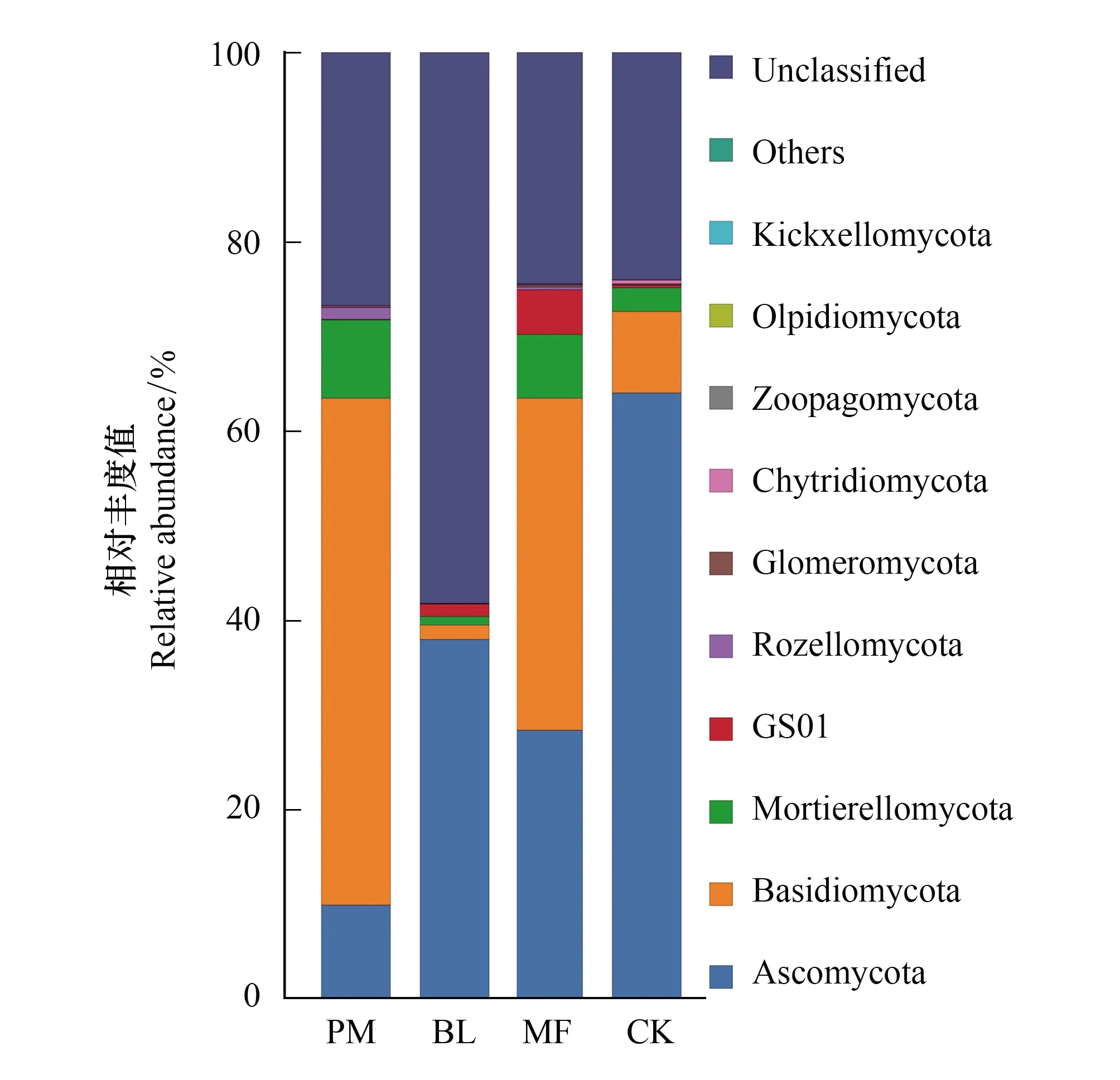
图1 不同造林模式土壤真菌群落相对丰度 Fig.1 The relative abundance of soil fungal communities in different afforestation modesPM,马尾松纯林Pinus massoniana;BL,光皮桦纯林Betula luminifera;MF,马尾松-光皮桦混交林Mixed Forest;CK,未造林灌草地Control check。Ascomycota:子囊菌门;Basidiomycota:担子菌门; Mortierellomycota:被孢霉门;GS01:芽孢杆菌门;Rozellomycota:罗兹菌门;Glomeromycota:球囊菌门;Chytridiomycota: 壶菌门; Zoopagomycota:捕虫霉门; Olpidiomycota:油壶菌门;Kickxellomycota:梳霉门 ;others:其他;Unclassified:未分类
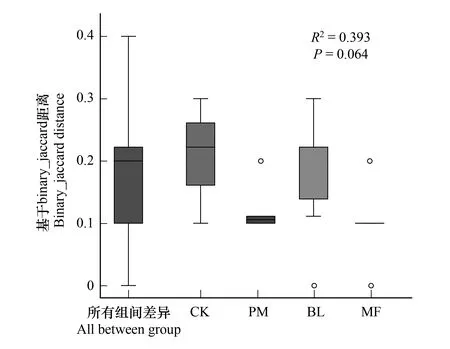
图2 基于binary_jaccard距离土壤真菌群落beta多样性分析 Fig.2 The beta diversity analysis of soil fungal community based on binary_jaccard distanceR2表示不同分组对样品差异的解释度,即分组方差与总方差的比值,R2越大表示分组对差异的解释度越高,表示分组差异越大,P 值小于0.05时说明检验的可信度高
不同造林模式下土壤真菌组成如图1所示。马尾松林地土壤样品中,门级水平除了未确定的真菌类群,担子菌门(Basidiomycota)为优势类群,其相对丰度为57.93%,其次为被孢霉门(Mortierellomycota)相对丰度为9.96%、子囊菌门(Ascomycota)相对丰度为9.50%,罗兹菌门 (Rozellomycota)相对丰度为1.38%。光皮桦林地土壤样品中,未确定的真菌类群相对丰度较大,后依次为子囊菌门(Ascomycota)相对丰度为35.0%,担子菌门(Basidiomycota)相对丰度为1.68%,被孢霉门(Mortierellomycota)相对丰度为0.87%。混交林土壤样品中,未确定的真菌类群相对丰度所占比例较大为30.98%,子囊菌门(Ascomycota)为优势类群,相对丰度为28.00%,其次为担子菌门(Basidiomycota)相对丰度为27.94%、被孢霉门(Mortierellomycota)相对丰度为6.49%。而石漠化灌草地土壤样品中,子囊菌门(Ascomycota)相对丰度为64.00%为优势类群,其次为担子菌门(Basidiomycota)相对丰度为8.64%、被孢霉门(Mortierellomycota)相对丰度为2.48%,未确定的真菌类群相对丰度为23.98%。由图2可知,基于binary_jaccard距离分析土壤真菌群落beta多样性, 组间存在差异,但检验的可信度不高(P>0.05)。
利用DPM分析石漠化区不同造林模式下土壤真菌各个门种群的变化(表4),结果发现:相对丰度高于1%的核心菌门中,子囊菌门(Ascomycota)和担子菌门(Basidiomycota)丰度变化值DPM>0.4,因此我们认为石漠化区不同造林模式土壤中子囊菌门和担子菌门菌群为活跃菌群。
2.4 土壤真菌多样性分析
Alpha多样性分析结果表明,3种不同造林模式下的土壤真菌多样性指数存在显著差异(P<0.05)(表5)。3种不同造林模式中,混交林土壤真菌物种总数高于其他造林模式,混交林土壤真菌Shannon指数显著高于马尾松和光皮桦林地,而马尾松和光皮桦纯林之间差异不显著,整体上真菌群落多样性表现为:混交林>马尾松林>光皮桦林。石漠化区土壤中存在大量未知的真菌菌群,与未造林灌草地相比,造林后土壤真菌物种总数明显增加,己知注释出的土壤真菌种的数量要高于未造林灌草地。
2.5 不同造林模式下土壤真菌结构和土壤理化性质的RDA分析

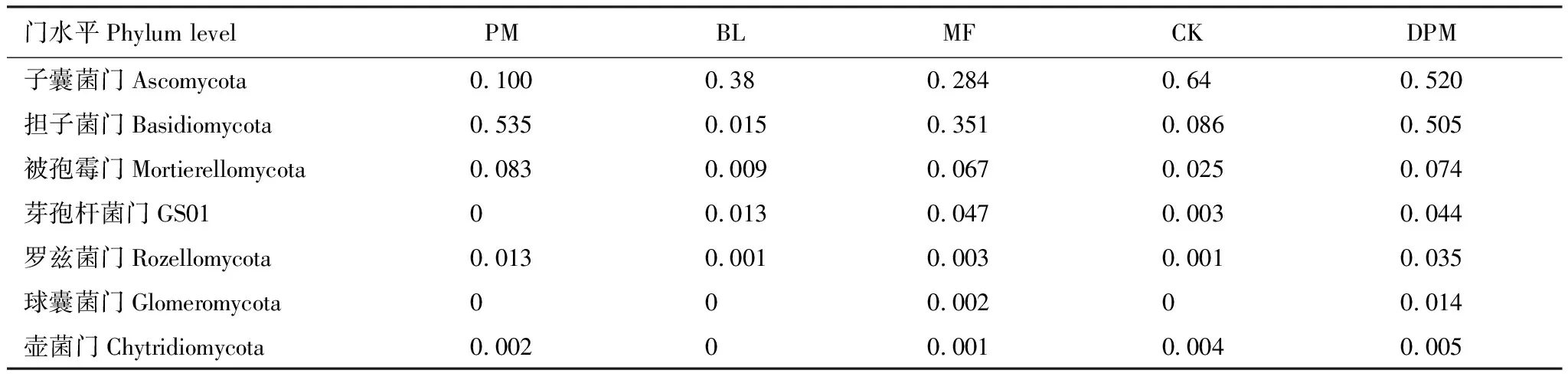
表4 不同真菌门丰度的DPM值
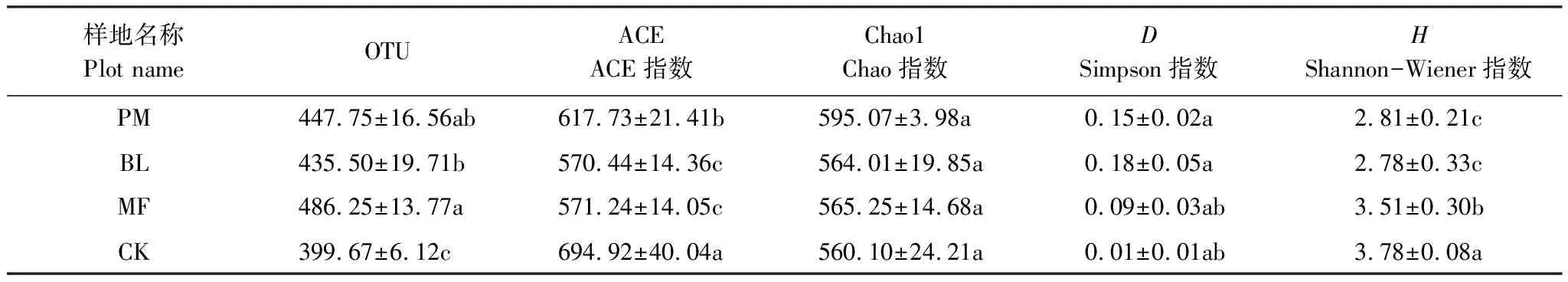
表5 不同造林模式下土壤真菌群落多样性分析
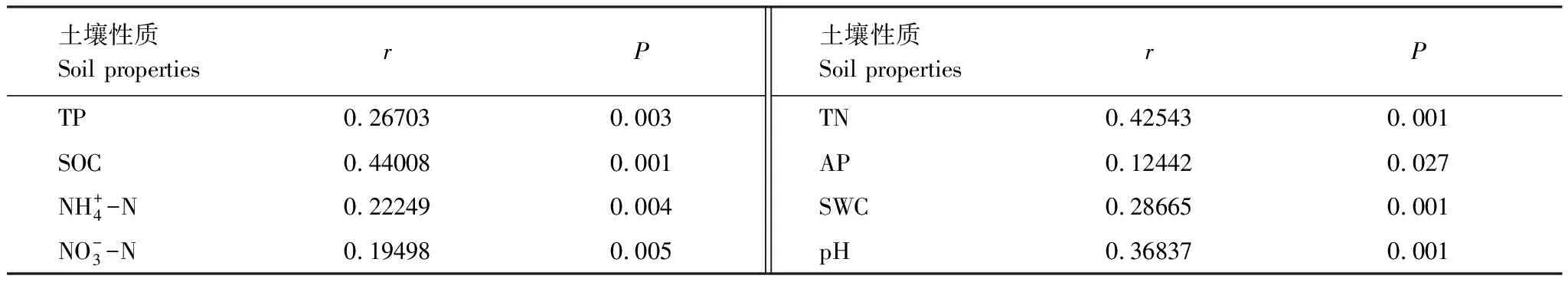
表6 基于Mantel test分析真菌群落与土壤之间的关系
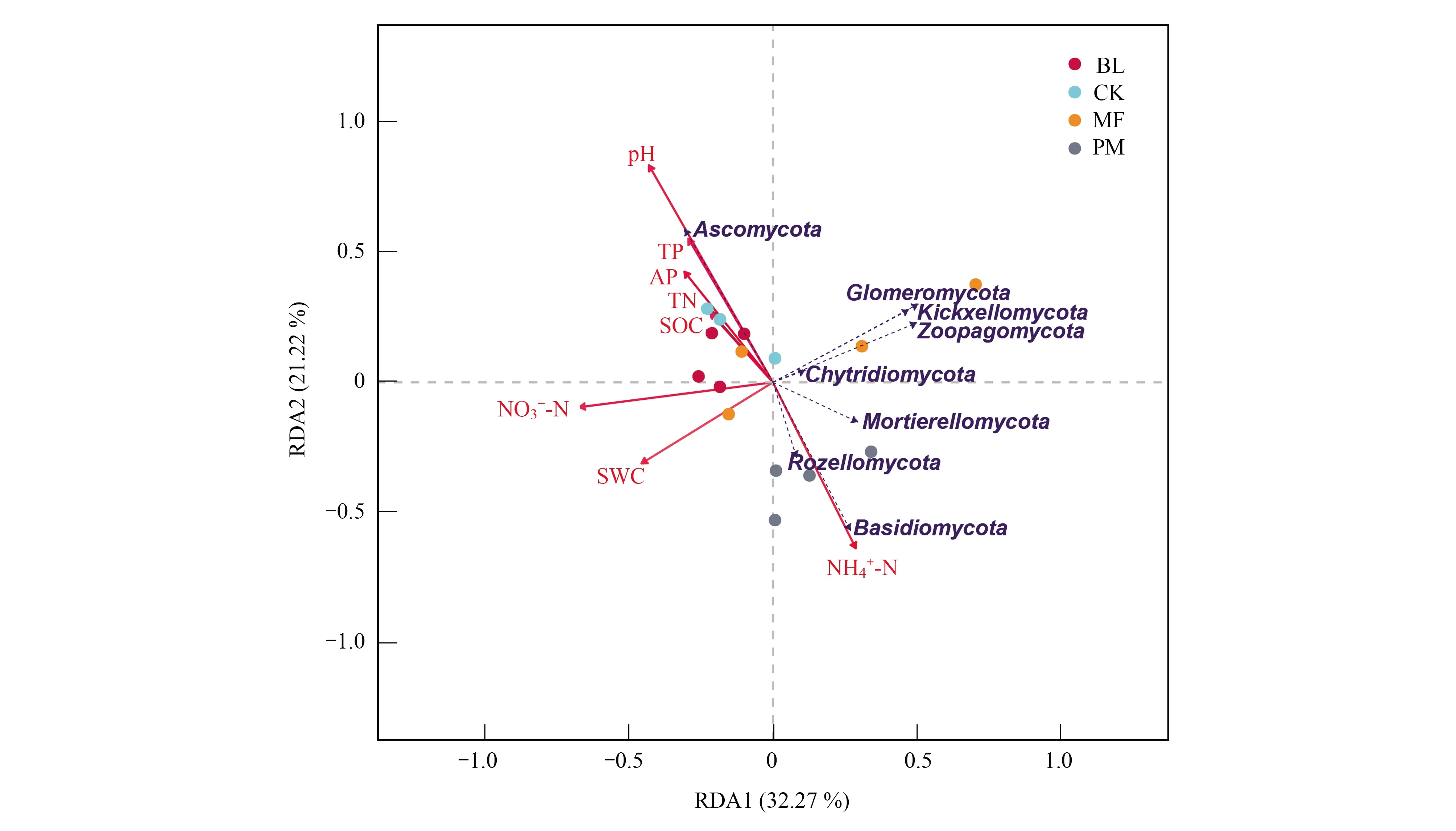
图3 不同造林模式下土壤真菌群落样地-环境RDA排序Fig.3 The soil fungi community RDA sort of sample area and environment in different afforestation patterns RDA: 冗余分析 Redundancy analysis;SOC:有机碳Soil Organic Carbon ;TP:全磷Total Phosphorus ;TN:全氮 Total 铵态氮 Ammonium;NO3--N:硝态氮 Nitrate Nitrogen;AP:有效磷Available Phosphorus ;SWC:土壤含水率Soil Water Content;pH: pH值;相同圆点代表重复样品
3 讨论
3.1 不同造林模式下土壤理化性质的差异
不同类型人工林在0—20 cm土层土壤中SOC、TN、TP、AP含量不同,其中马尾松林土壤中土壤养分含量最低,可能是因为马尾松林为针叶林,枯枝落叶保水能力较弱,且针叶分解速度较慢,从而导致土壤肥沃度下降。其次,有机质能够在一定程度上改善土壤的结构,较高的有机质和全氮含量能提高土壤的疏松度和保水能力。土壤肥力同时也取决于当地气候、土壤形成条件、环境以及不同地区的人为影响[27]。有研究表明,不同石漠化等级土壤养分含量差异显著,N、P、K是影响石漠化地区物种组成的主要因子,其分布特征可以部分解释草本和灌木分布的不均匀性[28]。
石漠化地区不同植被恢复模式下土壤理化性质存在明显差异,有研究显示,相同土层条件下,针阔混交林中土壤有机质、有效氮和土壤持水量均显著高于纯林,其土壤生物学性质更加完善[29]。与本研究结果相似,混交林土壤的SOC、TP、TN含量要高于纯林,可能是因为混交林中土壤真菌物种总数较多,真菌群落进行的生理生化活动利于土壤有机质矿化和养分库的积累[30—31]。马尾松为针叶树种,其凋落物以及根系分泌物中含有多种酸性物质,更易使土壤酸化[32],所以其土壤pH值显著低于其他造林模式。林隙土壤含水量出现差异的主要原因在于有机质含量差异[33],本研究中混交林的SWC显著低于纯林,可能是林下植物种类不同,混交林凋落物种类更丰富,菌根和腐生真菌协同竞争相同的有机底物[34],凋落物分解较慢导致有机质含量增加,但不利于土壤水分的积累,但为土壤微生物提供的营养生态位更全面(这与混交林真菌Shannon多样性较高结果一致)。因此,推测混交林凋落物和有机质分解速率大于两种纯林,进而导致土壤有机质累计较慢,土壤蓄水能力较差。
3.2 不同造林模式下土壤真菌群落组成和多样性
植被类型、气候、土壤及人为活动等多种因素均会影响土壤微生物群落结构组成[35],在立地条件相近的情况下,土壤微生物群落组成结构产生差异的最主要原因是植被类型的不同[36]。本研究中,混交林的真菌群落丰度最大,其次为马尾松纯林、光皮桦纯林。出现这种现象可能是由于马尾松属于针叶树种,凋落物难分解,土壤中有机质含量低于光皮桦林,加快了真菌的生长速度。在不同的生态系统中,微生物群落的整体组成可能存在较大差异,但优势菌群基本相似[37]。本研究中,子囊菌门和担子菌门在不同造林模式下的土壤真菌中占有绝对优势,子囊菌门在光皮桦林中的丰度(37.99%)高于马尾松林(9.97%),可能是因为子囊菌主要是腐生菌,腐生菌可以分泌多种酶,以体外方式分解土壤中的有机质及动植物尸体,从而形成二氧化碳、无机盐和简单的有机物,为植物生长提供养分,是土壤养分循环过程中的重要真菌,说明在石漠化地区种植光皮桦林可以提高子囊菌门真菌群落相对丰度,进一步改善土壤养分环境。而马尾松林中担子菌门丰度远高于光皮桦林,主要是因为马尾松林群落土壤土壤含水量较低,通气性良好,且土壤pH值较低,有利于提高担子菌门的丰度[38]。这与沈芳芳等[39]在陆地生态系统植物和土壤微生物群落多样性对全球变化的响应与适应研究进展中所得出的结论一致。
土壤特性是影响土壤真菌多样性的重要因素[40],本研究中马尾松-光皮桦混交林Shannon指数高于马尾松和光皮桦纯林,由Mantel test分析结果可知SOC是影响不同造林模式下土壤真菌群落的主要因子,其次为TN,可能是因为土壤C主要来源于有机质矿化和凋落物分解,土壤N的来源主要是凋落物的分解[41],真菌需要氮养分来合成分解有机物的酶,而碳是真菌生物量的主要成分以及能量来源,土壤微生物会根据地上植物的空间分布变化而发生变化[42],地上植被演替改变了植物组成及生理特性,从而导致进入土壤的有机碳随之发生改变[43],因此不同造林模式下真菌群落存在差异。本研究中石漠化地区土壤含水量较低,SWC对真菌群落结构影响显著,这与前人研究结果相似[44]。有研究显示宿主植物对土壤中真菌多样性和种类影响显著[45],因此,植物种类可影响根际微生物群落的结构和活性,根形态和根系分泌物可影响根际微生物群落的物种特异性[46],地上植被多样性可能是影响地下真菌群落结构与多样性的原因之一,究竟石漠化区植物群落乔木层、灌草层植物多样性与真菌多样性是否存在显著的相关性还需要未来做进一步研究。
4 结论
湘西石漠化治理区内,与未造林灌草地相比,3种造林模式均提高了土壤SOC、TP和TN含量,马尾松-光皮桦混交林和光皮桦纯林土壤养分含量高于马尾松纯林。马尾松-光皮桦混交林真菌可识别数量及多样性最高。而土壤SOC、TN是导致土壤真菌群落结构出现差异的最主要的环境因子。为提高该区土壤质量,实现植被恢复,推荐光皮桦纯林作为其治理模式,更有利于石漠化生态系统结构稳定性的维持和功能的恢复,若选择马尾松进行石漠化治理,则推荐采用混交林的种植模式。
