基于SEER数据库的胰腺癌患者自杀风险因素分析
2022-06-27黄礼莹冯敖梓何宁霞李淑娜
黄礼莹,黄 韬,李 莉,冯敖梓,何宁霞,李淑娜,吕 军
暨南大学附属第一医院临床研究部(广州 510630)
自杀是一种复杂的社会现象,已成为世界范围内严重的公共卫生问题。世界卫生组织报告显示,全球每年约703 000人自杀,死于自杀的人数超过了疟疾、艾滋病甚至战争,平均每100例死亡中就有1例为自杀(1.3%)[1]。有研究显示,2019年不同国家或地区的年龄标准化自杀率存在一定差异,非洲(11.2/10万人年)、欧洲(10.5/10万人年)和东南亚地区(10.2/10万人年)高于全球平均水平(9.0/10万人年)[1]。中国自杀人数约占全球自杀人数的六分之一,社会人口学特征、生活方式、身心健康、紧张的生活事件、精神障碍等因素均与自杀死亡风险的增加密切相关[2]。
癌症是影响全球的另一个重大公共卫生问题,也是美国第二大死亡原因[3]。有研究估计,排除黑色素瘤皮肤癌病例,2020年全球累计新增癌症病例1 930万例,累计癌症死亡病例1 000万例[4]。癌症诊断常会给患者带来沉重的心理负担,被认为是癌症患者自杀的危险因素[5-7]。多项研究发现,相较于一般人群,癌症患者更有可能经历心理困扰、情绪低落、严重抑郁症等精神心理问题和产生自杀念头,自杀风险是一般人群的两倍[8-11]。
自杀率较高的癌症包括肺癌、头颈部癌、胃癌和胰腺癌[12-13]。其中,胰腺癌治疗选择有限、预后差,五年生存率约为8%[14]。相比乳腺癌发病率的持续下降,各国胰腺癌的发病率和死亡率或保持稳定,或略有上升。有研究预测,至2025年,胰腺癌将超过乳腺癌,成为癌症死亡的第三大原因[15]。多项研究表明,在男性癌症患者中,胰腺癌自杀率高居第一[16-17]。针对癌症患者群体,存在较多关于不同国家或地区、性别、婚姻状态、诊断年龄、SEER阶段、原发部位等风险因素与自杀关系的研究,但针对胰腺癌患者自杀风险因素的相关研究较少,且数据较早[16,18-19]。本研究旨在探究1975—2018年胰腺癌患者自杀风险的潜在危险因素,为预防和减少胰腺癌患者的自杀风险提供参考。
1 资料与方法
1.1 研究对象和数据来源
数据来源为美国国家癌症研究所的SEER(Surveillance, Epidemiology, and End Results)Research Plus数据库。该数据库收集了美国多个登记站报告的癌症病例数据,包括人口统计学特征、原发肿瘤部位、肿瘤形态、诊断阶段、治疗信息等,涵盖美国人口的34.6%,涉及区域广,数据具有一定的代表性[20-21]。本研究胰腺癌患者数据来自2021年4月SEER Research Plus数据库发布的Plus-18、Plus-13、Plus-9数据集,包含1975—2018年所有胰腺癌患者的患病信息及其生存状态。
1.2 数据获取和信息收集
本研究采用SEER*Stat软件(版本8.3.9.2)进行数据提取,依据《国际疾病分类肿瘤学专辑》第三版(International Classification of Disease for Oncology Third Edition,ICD-O-3),合并Plus-18、Plus-13、Plus-9数据集中形态学编码(Morphology code)8140/3, 且 诊 断 年 份 在1975—2018年的所有胰腺癌患者病例(Pancreas;ICD-O-3 Site C250-C259; recode 21100)[22],根据患者编号去重,获取本研究的胰腺癌患者样本。
胰腺癌患者的自杀风险因素是研究关注的变量,考虑到自杀在SEER Research Plus数据库中被编码为死亡原因的一种,因此重点关注死亡原因为自杀(Suicide and Self-Inflicted Injury; ICD-10 codes, U03, X60-X84, Y87.0; recode 50220)的所有胰腺癌患者病例[23]。收集所有胰腺癌患者的信息特征,包括性别、诊断年份、种族、诊断年龄、手术、SEER阶段、婚姻状态、家庭年收入中位数(美元)和化疗信息。
1.3 统计学分析
本研究采用Stata软件(版本17.0)进行统计学分析。将胰腺癌患者分为自杀死亡、非自杀死亡和存活三组,并进行基线特征的比较,分析各胰腺癌患者群体分布特征。计算各分层变量相应胰腺癌患者群体的人年自杀率和标准化死亡比(SMR),分析人年自杀率较高的胰腺癌患者群体特点。由于性别变量未通过比例风险假设检验,针对总体胰腺癌患者采用泊松回归分析自杀风险的潜在因素,计算人年调整发生率比(aRR)与95%置信区间(95%CI)。对男性胰腺癌患者采用自杀风险Cox回归分析,计算校正后的风险比(HR)和95%CI,所有检验均为双侧检验,P<0.05认为差异有统计学意义。
2 结果
2.1 一般情况
共筛选出153 612例胰腺癌患者,其中女性74 378例(48.42%),男性79 234例(51.58%)。138例胰腺癌患者自杀死亡,其中男性患者126例(91.30%),女性患者12例(8.70%)。胰腺癌患者中,白色人种(80.68%)、65岁及以上(65.02%)、不建议手术(70.57%)、肿瘤处于远处转移阶段(57.28%)、已婚(56.06%)、家庭年收入中位数在50 000~74 999美元(47.17%)、未采取化疗(52.48%)的患者群体占比较高,且与138例胰腺癌自杀患者的分层群体特征分布相似。胰腺癌患者基线特征数据详见表1。
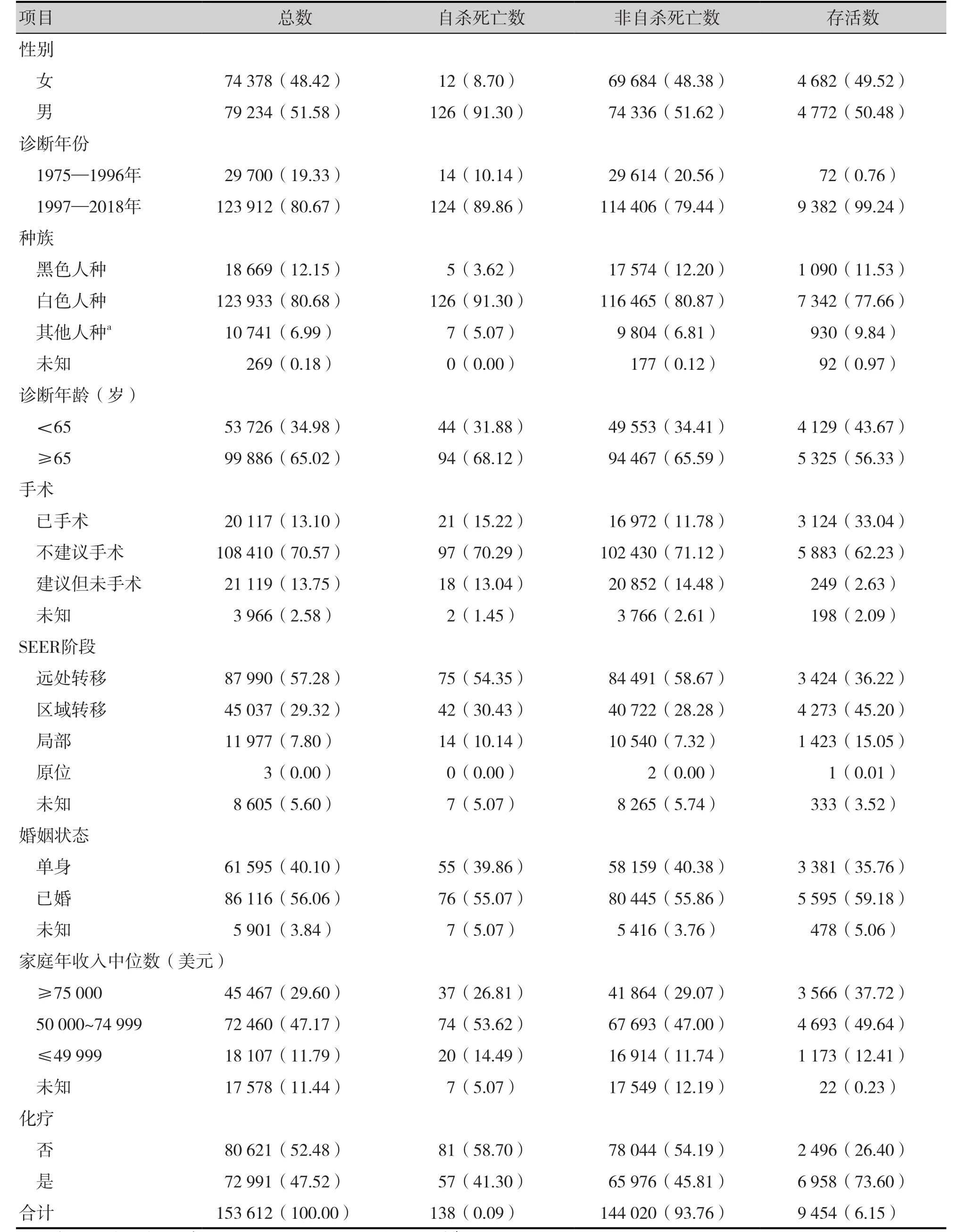
表1 胰腺癌患者基线特征(n, %)Table 1. Baseline characteristics of patients with pancreatic cancer(n, %)
2.2 胰腺癌患者自杀率和标准化死亡比
1975—2018年,153 612例胰腺癌患者中累计共138例患者自杀死亡,自杀率为115.64/10万人年,SMR是9.44。同时期美国一般人群自杀率为12.25/10万人年[24]。男性胰腺癌患者具有较高的自杀倾向,自杀率为211.62/10万人年,是女性胰腺癌患者(19.31/10万人年)的10.96倍。胰腺癌患者自杀率从1975—1996年的75.20/10万人年,大幅增加至1997—2018年的123.53/10万人年。白色人种(129.05/10万人年)、65岁及以上(137.77/10万人年)、建议但未手术(164.21/10万人年)、肿瘤处于远处转移阶段(187.88/10万人年)、单身(131.61/10万人年)、家庭年收入中位数不高于49 999美元(152.07/10万人年)、未采取化疗(190.44/10万人年)的患者群体自杀率较高(表2)。
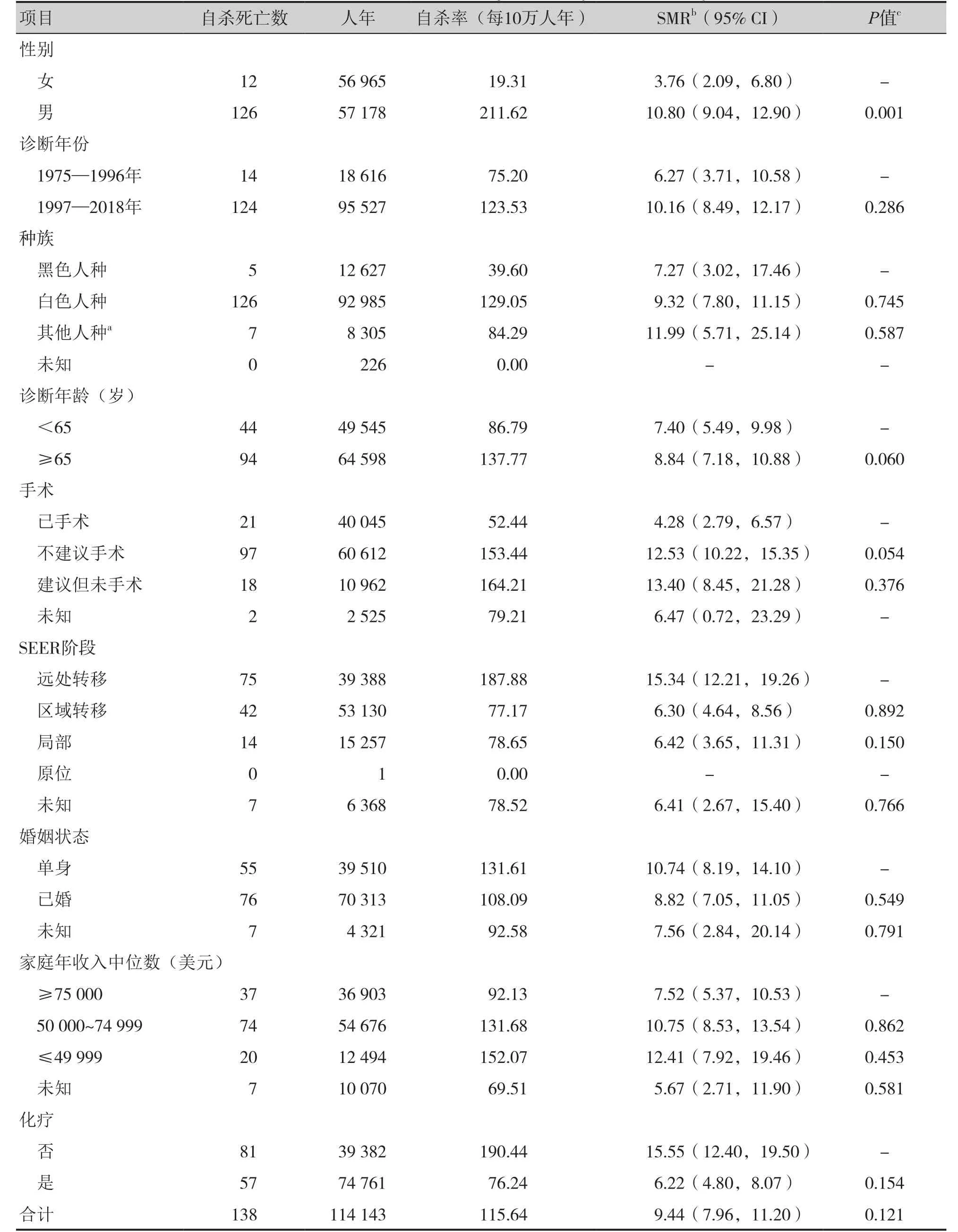
表2 胰腺癌患者自杀率和标准化死亡比分析Table 2. Suicide rates and standard mortality ratio of patients with pancreatic cancer
2.3 胰腺癌患者自杀风险泊松回归分析
泊松回归分析结果显示,胰腺癌患者中男性自杀风险约为女性的12.81倍[aRR=12.81,95%CI(6.85,23.96),P< 0.001]。白色人种约为黑色人种患者的3.56倍[aRR=3.56,95%CI(1.43,8.85),P=0.006]。65岁及以上患者自杀风险显著高于65岁以下年龄组[aRR=1.55,95%CI(1.07,2.26),P=0.022]。不建议手术、建议但未采取手术治疗的患者比已手术的患者更倾向自杀(P<0.01)。肿瘤处于远处转移阶段的患者,相比肿瘤区域转移或局部阶段的患者自杀风险更高(P<0.05)。已婚患者相较单身患者自杀风险低[aRR=0.57,95%CI(0.40,0.82),P=0.002]。化疗患者相较未化疗患者[aRR=0.34,95%CI(0.23,0.51),P< 0.001]自杀风险低(表3)。

表3 胰腺癌患者自杀风险回归分析Table 3. Regression analysis of suicide risk in patients with pancreatic cancer
2.4 男性胰腺癌患者自杀风险Cox回归分析
不同种族、手术选择、婚姻状态及化疗选择的男性胰腺癌患者,自杀风险具有显著差异。男性胰腺癌患者中,白色种族患者的自杀风险约为黑色种族患者的3.28倍[HR=3.28,95%CI(1.32,8.15),P=0.011]。建议手术但未选择手术治疗的男性患者比已手术的患者具有更高的自杀倾向[HR=2.66,95%CI(1.23,5.74),P=0.013]。 已婚男性患者相较单身患者自杀风险低[HR=0.63,95%CI(0.43,0.91),P=0.015]。 已化疗的男性患者相比未化疗患者面临较低的自杀风险[HR=0.39,95%CI(0.27,0.58),P< 0.001]。男性胰腺癌患者自杀风险Cox回归结果详见表3。
3 讨论
本研究结果显示,性别、种族、诊断年龄、是否采取手术治疗、SEER阶段、婚姻状态及化疗选择均显著影响胰腺癌患者的自杀风险。总体上,近二十年来胰腺癌患者自杀率较二十年前呈上升趋势,自杀率从1975—1996年的75.20/10万人年,升至1997—2018年的123.53/10万人年。
性别上,男性患者的自杀风险显著高于女性,与以往文献的研究结论一致[6,25]。相关研究显示,酒精很可能诱发男性胰腺癌患者自杀,控制酒精的使用后,男性患者的自杀风险降低了43.6%[18]。饮酒常被认为是自杀行为的预兆,大量饮酒可能会无意中将个人的注意力集中到当前的消极情况,从而加深苦恼、自杀念头和立刻尝试自杀的风险[26]。另有研究显示,每天适量的饮酒也与自杀率的上升相关[27]。
种族上,白色人种自杀风险显著高于黑色人种。既往研究表明,美国癌症患者中白人自杀风险最高,黑人最低[5]。本研究结果也表明白人患者自杀率较高,其自杀风险约为黑人患者的4倍。这可能与种族群体、教育水平、宗教参与和社会孤立等因素有关[28-31]。
诊断年龄上,相较65岁以下的胰腺癌患者,65岁及以上的老年患者具有更高的自杀倾向。有研究发现,胰腺癌的发病率和死亡率呈上升趋势,尤其是50岁以上人群[32]。老年胰腺癌患者存在较高的自杀风险,可能是由于胰腺癌发病风险随着年龄的增长而增加,65岁及以上患者更有可能被诊断出来。同时,诊断后的第一年是癌症患者自杀风险最高的时期[16,25],因此该年龄段人群在胰腺癌诊断后第一年需重点干预。
手术治疗的选择上,不建议手术、建议但未采取手术治疗的胰腺癌患者比已手术的患者有着更高的自杀风险。与本文的研究结果不同,Turaga分析了男性胰腺癌患者自杀风险,结果显示手术干预的自杀风险更高[19]。时间因素、研究方法的不同、外科技术的进步均有可能导致结果的不一致。本研究时间跨度更长,且采用泊松回归进行分析,考虑了暴露期随个体变动的影响。随着时间推移,医疗水平不断提高、外科技术趋于成熟,手术治疗对延长患者寿命、减轻患者痛苦具有积极作用,一定程度上可降低癌症患者的自杀风险。胰腺癌患者的治疗选择有限,预期寿命低,超过50%的患者在诊断时肿瘤处于远处转移阶段[14]。有限的治疗方案、较重的经济负担、长期的心理压力均有可能导致未采取手术治疗患者的高自杀风险[33-35]。
SEER阶段上,肿瘤处于远处转移阶段的患者更易自杀。由于胰腺位于腹腔后部,胰腺癌早期症状通常表现为腹痛、恶心、消化不良等,难以被患者和医生识别,胰腺特殊的位置和不典型的早期症状进一步延缓了诊断时间,导致大多数情况下胰腺癌诊断较晚[36]。一旦癌症诊断为晚期,除疼痛等严重症状外,患者还可能产生呼吸和进食等重要功能方面的困难,为逃避疾病痛苦和治疗,患者很可能提前结束生命[37]。
婚姻状态上,已婚的患者自杀风险较低。婚姻在一定程度上提供了情感和社会支持,既往文献同样验证了已婚可降低自杀风险[2,5,12,17,19]。化疗选择上,已化疗患者自杀风险相对较低,需加强对未化疗患者心理状态的关注。
本研究存在一定的局限性。第一,信息缺失,本研究使用SEER*Stat软件提取数据,但部分信息如心理状态、与生活方式相关的行为因素、社会环境因素等缺失,这些信息可能影响自杀行为,使自杀风险评估结果出现偏倚;第二,自杀错判和漏报,自杀和意外死亡在部分情况下难以辨别,可能导致潜在的错误分类和自杀漏报[38],从而低估胰腺癌患者的自杀率;第三,自杀风险因素分析不能直接判定自杀行为的因果关系,其他可能因素对胰腺癌患者自杀风险的影响有待深入研究;第四,本文研究人群仅限于美国胰腺癌患者,所得结果可能不适用于我国人群。
