经导管主动脉瓣置换术后瓣膜血栓的经胸超声心动图评估
2022-06-27王建德任心爽王婧金梁玉逄坤静王浩牛冠男王墨杨吴永健吕滨
王建德 任心爽 王婧金 梁玉 逄坤静 王浩 牛冠男 王墨杨 吴永健 吕滨
自2002年法国学者Cribier等[1]成功完成全球首例经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)以来,该项手术在全球获得广泛开展,使得大批无法进行外科瓣膜置换的高危患者获益。近年来随着经验积累、器械进步及在中危患者中的适应证获得认可[2-3],TAVR使得更多患者获益。
2013年Gregor首先应用CT及经胸超声心动图(transthoracic echocardiography,TTE)报道TAVR瓣膜血栓形成,之后越来越多的学者发现TAVR瓣叶CT表现的低回声增厚是人工瓣叶相关的血栓[4-5],自此TAVR术后瓣膜血栓获得越来越多的重视。由于CT评估具有对比剂增强、电离辐射及较高的医疗花费等不足之处,本研究通过TAVR患者术后TTE与CT资料进行对比分析,评估TTE诊断TAVR术后瓣膜血栓的价值。
1 对象与方法
1.1 研究对象
收集2015年6月至2019年6月于中国医学科学院阜外医院成功进行TAVR治疗的患者80例,所有患者术后在本院进行TTE随访,同期完成CT评估。
1.2 研究方法
TTE检查选用Philips Epic7c S5-1或X5-1探头、GE VIVID E9超声仪及M5sT探头。CT扫描采用西门子双源CT(SOMATOM Definition Flash)、GE256排宽体CT(Revolution CT)。所有患者于术前30 d内、术后1周内或出院前完成TTE检查,术后随访获取同期TTE及CT数据。TTE结果由高年资超声医师进行分析,评估TAVR人工瓣叶运动状态,以连续多普勒获取主动脉瓣峰值流速(Vmax)、峰值跨瓣压差(peak pressure gradient,PPG)、平均跨瓣压差(mean pressure gradient,MPG)及连续方程计算有效瓣口面积(available aortic valve area,AVA)等参数。窦性心律患者取3个心动周期的平均值,心房颤动患者取5个心动周期的平均值。
采用西门子/GE双源CT机进行主动脉根部扫描,采用回顾性心电门控,于最佳收缩期及舒张期重建图像进行评估。所有CT图像均由阜外医院瓣膜病核心实验室使用3mensio 软件(版本10.1)(3mensio Medical Imaging BV,Bilthoven, The Netherlands) 进行分析。TAVR瓣膜血栓定义为在两个不同重建时像及切面均可看到至少1个或更多的人工瓣叶出现明显增厚,并记录异常增厚的瓣叶个数及累及程度定量。参照心血管CT协会的专家共识[6],根据冠状位低回声增厚自瓣叶附着处向瓣尖部累及的范围将人工3个瓣叶血栓负荷分别定量评分:无低回声增厚为0分,累及小于25%为1分,25%~50%为2分,50%(含)~75%为3分,大于75%为4分,总血栓负荷为三个瓣叶评分累加。根据CT瓣膜血栓负荷分为三组(0~4分为低分组、5~8分为中间组及9~12分为高分组)。
1.3 统计学分析
所有数据采用SPSS 22.0 软件进行统计。正态分布连续变量以均数±标准差表示,非正态分布连续变量以中位数(四分位数间距)表示,分类资料以百分率表示。组间连续变量应用t检验进行对比,多组间对比采用单因素方差分析或Welch检验进行对比,组间对比采用LSD或studentt检验。以CT评估有无血栓为金标准,将主动脉瓣血流动力学指标及瓣口面积变化指标做受试者工作特征曲线,以约登指数最大时对应的指标值为界值,同时记录敏感度及特异度。以P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料
8 0例患者中男4 3例(5 3.7 5%),平均年龄(75.4±7.1)岁,置入自膨胀支架瓣膜60例(75.00%),球囊扩张瓣膜20例(25.00%),中位住院时间7(5,8)d,中位随访时间182.5(74.0,205.5)d,TTE与CT随访时间差为(0.28±0.86)d(表1)。

表1 80 例患者一般资料
2.2 患者TAVR术前、出院前及随访时超声数据
出院前、术后随访时的TTE超声数据分别与术前比较,差异均有统计学意义(均P<0.05);术后随访时仅LVEF与出院前比较,差异有统计学意义(P<0.05,表2)。
表2 80 例患者术前、出院前及随访时TTE 数据(±s)

表2 80 例患者术前、出院前及随访时TTE 数据(±s)
注:TTE,经胸超声心动图;Vmax,峰值流速;PPG,峰值跨瓣压差;MPG,平均跨瓣压差;AVA,有效瓣口面积;LVEDd,左心室舒张末期内径;LVEF,左心室射血分数;1 mmHg=0.133 kPa。
项目 术前 出院前 术后随访 P 值Vmax(m/s) 4.61± 0.59 2.39± 0.51 2.35± 0.55 <0.001 PPG(mmHg) 86.6 ±22.6 23.8 ±10.3 23.3 ±11.3 <0.001 MPG(mmHg) 54.9 ±15.8 13.2 ± 6.1 12.0 ± 6.7 <0.001 AVA(cm²) 0.65± 0.19 1.64± 0.45 1.60± 0.41 <0.001 LVEDd(mm) 49.6 ± 7.9 47.3 ± 7.3 46.9 ± 5.1 <0.05 LVEF(%) 56.7 ±13.8 59.3 ± 9.8 62.6 ± 5.5 <0.05
2.3 随访时血栓组与正常组患者TTE数据对比
CT诊断TAVR瓣膜血栓36例(45.00%)为血栓组,正常组44例(55.00%)。血栓组与正常组Vmax、PPG、MPG、ΔVmax、ΔPPG、ΔMPG及ΔVmax%、ΔPPG%、ΔMPG%比较,差异均无统计学意义(均P>0.05),但是AVA[(1.47±0.29)cm²比(1.71±0.45)cm²,P=0.006]、ΔAVA[(-0.15±0.35)cm²比(0.07±0.44)cm²,P=0.018]及ΔAVA%[(-7.10±18.73)%比(8.61±31.12)%,P=0.007]的差异均有统计学意义(表3)。
表3 血栓组与正常组TTE 数据对比(±s)
表3 血栓组与正常组TTE 数据对比(±s)
注:TTE,经胸超声心动图;Vmax,峰值流速;PPG,峰值跨瓣压差;MPG,平均跨瓣压差;AVA,有效瓣口面积;LVEDd,左心室舒张末期内径;LVEF,左心室射血分数;1 mmHg=0.133 kPa。
项目 正常组(44 例) 血栓组(36 例) P 值Vmax(m/s) 2.35± 0.51 2.34 ± 0.59 0.935 PPG(mmHg) 23.20 ±10.08 23.34 ±12.70 0.958 MPG(mmHg) 11.77 ± 5.85 12.28 ± 7.62 0.739 AVA(cm²) 1.71 ± 0.45 1.47 ± 0.29 0.006 LVEDd(mm) 46.59 ± 5.25 47.22 ± 5.01 0.585 LVEF(%) 63.43 ± 4.82 61.64 ± 6.22 0.150 ΔVmax(m/s) -0.057± 0.37 -0.014± 0.52 0.672 ΔPPG(mmHg) -1.15 ± 7.79 0.36 ±10.99 0.480 ΔMPG(mmHg) -1.5 ± 4.33 -0.83 ± 6.35 0.580 ΔAVA(cm²) 0.07 ± 0.44 -0.15 ± 0.35 0.018 ΔVmax%(%) -0.88 ±16.73 0.81 ±23.64 0.708 ΔPPG%(%) 2.55 ±38.71 7.08 ±54.87 0.667 ΔMPG%(%) -5.87 ±31.30 -0.92 ±46.74 0.574 ΔAVA%(%) 8.61 ±31.12 -7.10 ±18.73 0.007
2 .4 随访时不同血栓负荷组TTE数据对比
CT血栓负荷低分组18例,中间组14例,高分组4例。CT血栓负荷高分组与低分组、中间组PPG[(39.15±17.49)mmHg比(17.73±7.21)mmHg比(26.04±12.93)mmHg,P=0.003]、ΔVmax%[(25.01±33.18)%比(-6.52±17.47)%比(3.35±24.30)%,P=0.040]、ΔAVA%[(-30.54±17.10)%比(-4.97±14.87)%比(-3.32±19.95)%,P=0.020]的差异均有统计学意义,而低分组与中间组比较,差异均无统计学意义(均P>0.05,表4)。
表4 36例血栓组患者随访时不同血栓负荷组TTE数据对比(±s)

表4 36例血栓组患者随访时不同血栓负荷组TTE数据对比(±s)
注:TTE,经胸超声心动图;Vmax,峰值流速;PPG,峰值跨瓣压差;MPG,平均跨瓣压差;AVA,有效瓣口面积;LVEDd,左心室舒张末期内径;LVEF,左心室射血分数;1 mmHg=0.133 kPa。
项目 低分组(18例) 中间组(14 例)高分组(4 例)P 值Vmax(m/s) 2.07± 0.42 2.49± 0.56 3.07± 0.67 0.002 PPG(mmHg) 17.73± 7.21 26.04±12.93 39.15±17.49 0.003 MPG(mmHg) 9.22± 3.93 13.86± 8.56 20.50±10.72 0.010 AVA(cm²) 1.56± 0.22 1.43± 0.34 1.22± 0.32 0.090 LVEDd(mm) 47.17± 4.46 46.36± 3.48 50.50±10.47 0.690 LVEF(%) 62.11± 5.5 62.21± 3.45 57.50±14.27 0.820 ΔVmax(m/s) - 0.16± 0.39 0.01± 0.52 0.58± 0.76 0.030 ΔPPG(mmHg) - 2.52± 6.97 0.20±10.36 13.65±19.63 0.290 ΔMPG(mmHg) - 2.78± 4.39 - 0.43± 6.26 6.50± 9.85 0.020 ΔAVA(cm²) - 0.11± 0.29 - 0.10± 0.39 - 0.54± 0.33 0.060 ΔVmax%(%) - 6.52±17.47 3.35±24.30 25.01±33.18 0.040 ΔPPG%(%) - 9.64±35.18 12.18±55.54 64.42±92.58 0.040 ΔMPG%(%) -18.39±35.22 7.45±45.74 48.33±63.29 0.020 ΔAVA%(%) - 4.97±14.87 - 3.32±19.95 -30.54±17.10 0.020
2.5 AVA的绝对变化值及相对变化值对血栓形成的预测价值
AVA绝对变化值曲线下面积0.615(P=0.078),以ΔAVA>0.28cm²预测TAVR瓣膜血栓的特异度为75.0%,敏感度为25.0%(图1)。ΔAVA%的曲线下面积为0.638(P=0.035),以ΔAVA%>15.4%预测TAVR瓣膜血栓的特异度为77.3%,敏感度为27.8%(图2)。

图1 AVA 绝对变化值(ΔAVA)的受试者工作特征曲线
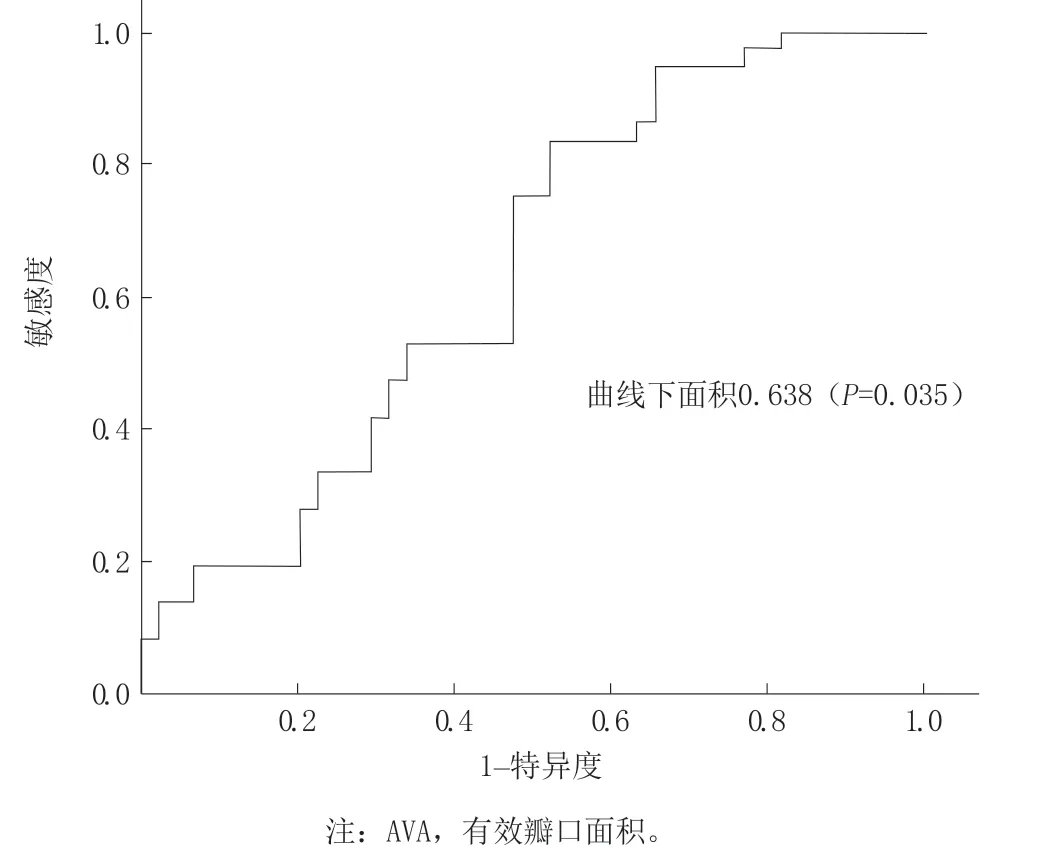
图2 AVA 相对变化值(ΔAVA%)的受试者工作特征曲线
2.6 患者术后抗栓方案
本组患者术后抗栓方案相似,均以氯吡格雷+阿司匹林的双抗为主(血栓组22/36,正常组21/44),其次为氯吡格雷单抗(血栓组12/36,正常组9/44),阿司匹林单抗(血栓组2/36,正常组7/44),正常组其余患者分别选用华法林(6例)和新型口服抗凝药物(1例)抗栓治疗。11例心房颤动患者仅6例选用华法林进行抗栓治疗,其余5例患者因高龄及出血高风险改用其他方案抗栓治疗。所有患者TTE检查均未发现TAVR瓣叶增厚及实体血栓附着,仅CT血栓负荷高分组2例(2.5%)患者TTE彩色血流提示瓣架内血流加速、Vmax及MPG明显增高而提示血栓可能(图3)。

图3 经胸超声心动图(TTE)显示1 例经导管主动脉瓣置换术人工瓣血栓形成前后对比 A、B.出院前TTE[A.心尖五腔心彩色血流显示支架内血流通畅;B.连续多普勒超声测得人工瓣峰值流速2.3 m/s(术前4.2 m/s),平均跨瓣压差15 mmHg(术前46 mmHg),连续方程计算有效瓣口面积为1.56 cm²(术前0.84 cm²)];C、D.术后7 个月时TTE[C.心尖五腔心彩色血流出现血流汇聚(红色箭头);D.连续多普勒超声测得人工瓣峰值流速3.6 m/s,平均跨瓣压差35 mmHg ,有效瓣口面积0.83 cm²];E、F.CT 显示三个瓣叶为低衰减增厚的血栓(蓝色箭头所示低回声血栓位于人工瓣膜的主动脉侧)
3 讨论
人工瓣膜置换是治疗主动脉瓣重度狭窄的首选治疗方式。自TAVR术式出现以来,许多外科瓣膜置换高危患者获得了新生。人工瓣血栓是机械瓣置换后众所周知的风险,但是在生物瓣中很少被重视。机械瓣置换术后患者长期服用口服抗凝药治疗,外科生物瓣置换及TAVR术后患者进行长期口服抗凝药治疗的仅为少数,多数患者仅抗血小板治疗以预防血栓形成。随着TAVR广泛开展,术后瓣膜血栓日益获得重视。文献报道TAVR术后1~3个月生物瓣血栓的发生率约为7%,一年时血栓发生率约为14%[7],主要为低回声血栓(又称低衰减的瓣叶增厚),表现为累及生物瓣瓣叶的附着缘并不同程度地延伸入生物瓣叶靠近支架中心对合缘的低回声增厚,这是TAVR术后生物瓣血栓主要特点[8],部分病例可以表现为人工瓣膜主动脉侧窦内实体大块状血栓[5]及人工瓣架附着的实体血栓[9]。
根据瓣膜血栓的形态及造成的瓣口血流动力学改变的不同程度,有学者将TAVR术后瓣膜血栓分为临床血栓及亚临床血栓,前者定义为超声心动图或CT证实的瓣膜附着的、具有活动性的实体块状血栓,并造成明显的瓣膜功能异常;后者定义为累及1~3个瓣叶主动脉侧的薄层血栓,不合并明显的瓣膜功能障碍。
TAVR瓣膜血栓形成的潜在机制包括:(1)人工瓣架贴合不良导致的内皮化延迟;(2)金属支架可能导致血栓形成;(3)人工瓣叶展开不良形成皱褶、凹陷有利于血栓形成;(4)老年TAVR患者可能同时存在血栓前状态[10]。TAVR人工瓣瓣膜血栓的危害主要在于潜在的卒中风险,明显的血栓可能造成再次瓣膜狭窄,而对于瓣膜的耐久性影响目前没有明确的研究结果。
目前TAVR瓣膜血栓诊断主要以CT为主,较少有TTE诊断的报道,主要原因为:(1)CT具有较高的空间分辨率,随着技术的进步,其在心血管成像的时间分辨率及后处理技术能够提供更优良的图像;(2)由于TAVR生物瓣叶位于瓣架内侧且支架材质为金属结构,TTE在各个方向上评估瓣叶运动状态及瓣叶厚度受金属声影影响明显。经食管超声心动图由于探头频率高、声场近、金属声影影响小等特点可以改善对瓣叶形态、厚度及运动状态的识别;(3)与自体瓣膜狭窄相似,仅当TAVR生物瓣的AVA减小到足够小才产生明显的血流动力学改变,这也被本研究结果所证实。本组患者显示瓣口血流加快而明显梗阻的患者仅占2.5%,与文献中报道TAVR患者术后造成瓣口明显梗阻的血栓发生率为0.6%~2.8%[11-12]相吻合。TTE难以通过直接观察瓣叶增厚或实体血栓附着来确诊瓣膜血栓,而仅通过间接的血流动力学改变及瓣口面积变化来评估血栓形成的可靠性较低。
本研究的不足之处在于以出院前超声心动图获得的血流动力学参数作为无血栓的基线资料,由于没有出院前的CT检查结果而将其作为基线可能对研究结果造成偏倚。另外受限于经食管超声心动图检查的半侵入特性,所有术后随访的患者均未进行经食管超声心动图评估。
利益冲突 所有作者均声明不存在利益冲突
