沉默IL-37 表达对骨肉瘤细胞的影响及其作用机制研究
2022-06-27陈海堡宋毅昌彭磊曾统张迪靳松
陈海堡 宋毅昌 彭磊 曾统 张迪 靳松
骨肉瘤是世界上最常见的儿童骨恶性肿瘤,也是儿童恶性肿瘤死亡的第八大原因。随着治疗理念及技术的改进,骨肉瘤患者的5 年总体生存率明显提高,但治愈率未有提高,而且出现转移或复发患者的预后较差。分子靶向治疗是骨肉瘤的治疗新策略,识别新的靶点和驱动骨肉瘤发病的潜在分子机制至关重要。IL-37 是近年被发现的IL-1 家族成员,具有天然的炎症和免疫抑制作用,与调控肿瘤的增殖和转移相关。然而IL-37 在骨肉瘤中的生物学功能尚未被阐明。B 淋巴细胞瘤(BCL)家族蛋白是细胞凋亡的重要调控因子,其通过调节线粒体通透性来调节凋亡激活物如细胞色素C 的释放来影响细胞的状态,BCL-2 家族包括促凋亡蛋白BCL 关联X 蛋白(BAX)和抗凋亡蛋白BCL-2。Wnt/β-catenin 通路是骨肉瘤中常见的信号通路,在调节肿瘤细胞增殖、转移等方面发挥重要作用。在正常的体细胞中,β-catenin仅作为一种细胞骨架蛋白在胞膜处与钙黏蛋白形成复合体,在维持同型细胞的黏附、防止细胞的移动中发挥作用。当细胞外Wnt 信号分子与细胞膜上特异性受体Frizzled 蛋白结合后,激活胞内蛋白Dvl。Dvl 通过抑制糖原合成酶激酶3β(GSK3β)等蛋白形成的β-catenin 降解复合物的降解活性,稳定细胞质中游离状态的β-catenin 蛋白。胞浆中稳定积累的β-catenin 进入细胞核后结合淋巴增强因子/ T 细胞因子(LEF/TCF)转录因子家族,启动下游靶基因如转录增强因子1(TEF1)、c-Myc、细胞周期蛋白D1(Cyclin D1)和基质金属蛋白酶-7(MMP-7)等的转录。为此,本研究中通过定量逆转录PCR(RT-qPCR)检测IL-37 在骨肉瘤细胞中的表达,并且进一步探讨IL-37 对骨肉瘤细胞增殖、迁移和侵袭的影响及与Wnt/β-catenin 信号通路关系,为骨肉瘤的靶向治疗提供新的证据,现报道如下。
材料与方法
一、主要材料
本实验所用的人类正常成骨细胞系(hFOB1.19)和骨肉瘤细胞系(U2OS、MG63、Saos-2)均购于中国科学院;10%胎牛血清(FBS)购自美国HyClone 公司;高糖型DMEM 培养基、谷氨酰胺购自美国Gibco 公司;胰酶、0.02%乙二胺四乙酸(EDTA)、青霉素-链霉素混合液(双抗)、β-甘油磷酸钠、地塞米松、细胞增殖及毒性检测试剂盒(CCK-8 法)购自美国Sigma 公司;逆转录(RT)试剂盒及qPCR 试剂盒、TRIzol RNA 抽提试剂、Annexin V-FITC 细胞凋亡检测试剂盒购自美国Invitrogen 公司;Transwell 孔板购自美国Corning 公司;IL-37(ab93959,兔抗人)购自美国Abcam 公司;β-actin 抗 体(AA128,鼠 抗 人)、BAX 抗 体﹑BCL-2 抗体﹑TEF1 抗体﹑c-Myc 抗体、Cyclin D1抗体﹑MMP-7 抗体购自美国CST 公司,辣根过氧化物酶标记二抗购自北京中杉金桥生物技术有限公司,Matrigel 基质胶购自美国BD 公司。
二、方 法
1. 细胞培养与小干扰RNA(siRNA)瞬时转染
hFOB1.19 细胞培养于含10% 胎牛血清的DMEM/F12 培养基,骨肉瘤细胞系(U2OS、MG63和Saos-2)使用含有10%FBS 的DMEM 培养基,在37 ℃、5% CO、95%湿度下培养,24 h 后更换新鲜的培养基,在显微镜下观察细胞的密度分布及其生长状态,以后每3 d 换液1 次。将生长状态良好的骨肉瘤细胞按照上述步骤消化后接种在需要进行相应实验的培养孔板上,待细胞生长汇合度为80%,弃除培养基加入适量的无血清培养基。干扰序列siIL-37(5′-ACAAAACUCCCCUUUAGAG AC-3′)及转染无意义的阴性对照序列(5′-CUCUAA AGGGGAGUUUUGUCU-3′)由上海吉玛基因股份有限公司设计合成。严格按照LipofectamineRNAiMAX 转染试剂盒说明书制备转染混合物。将上述的siRNA 转染混合物加入相应的细胞培养板孔,置于37 ℃、5% CO、95%湿度的培养箱中培养3 d,用RT-qPCR 检测转染效率并进行下一步实验。其中转染干扰序列siIL-37 沉默IL-37 表达的细胞作为siIL-37 组,转染阴性对照序列作为阴性对照组(siNC 组)。所有实验重复3 次。
2. RT-qPCR
根据TRIzol 试剂盒使用说明书提取细胞中的总RNA。取100 ng 的总RNA 为模板,通过RT 试剂盒合成模板DNA(cDNA),取cDNA 和引物,严格按照TaKaRa 公司SYBRPremix Ex TaqⅡ试剂盒说明书配制PCR反应液。RT-qPCR反应参数为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火34 s,40 个循环。反应结束后,PCR 扩增仪自动分析并得出Ct 值,采用2法计算IL-37 mRNA 相对表达量。引物由生工生物工程(上海)股份有限公司设计合成,具体序列见表1。

表1 引物序列
3. CCK-8 法检测细胞增殖
选择生长状态良好的hFOB1.19 细胞常规消化后按1000 个/孔的密度接种于96 孔板,均匀铺板置于37 ℃、5% CO、95%湿度的培养箱中培养过夜。按上述的步骤转染siRNA 干扰序列,沉默IL-37 的表达,设置阴性对照的siNC 组。转染培养72 h 后弃除培养基,加入含有10 µL CCK-8 试剂的完全培养基110 µL,置于37 ℃、5%CO、95%湿度的培养箱中孵育2 h。在全自动酶标仪上测定每孔在450 nm 处的吸光度(A)值并分析结果。细胞 增 殖 比 例=(A-A) /( A-A),其 中A为 实 验孔A 值(含培养基、CCK-8 溶液、分别予siIL-37或siNC 转染细胞),A为对照孔A 值(含培养基、CCK-8 溶液,未使用siRNA 处理的细胞),A为空白孔A 值(含培养基、CCK-8 溶液,不含细胞)。
4. 细胞迁移和侵袭实验
按照Transwell 染色试剂盒说明书用无血清培养基将其稀释至250 µg/mL 的工作浓度,取100 µL稀释的基质胶加入Transwell 上层小室,置于37 ℃的培养箱中孵育4 h。选择瞬时转染48 h 后的骨肉瘤细胞,常规消化后用含1% FBS 培养基重悬细胞计数,调整细胞密度至约1.25×10/mL。24 孔板中每孔加入含20% FBS 培养基作为下层小室,取200 µL 细胞悬液加入Transwell 迁移和侵袭上层小室,小心地将上层小室置入24 孔板中,置于37 ℃、5% CO、95%湿度的培养箱中孵育24 h。取出迁移及侵袭小室,用4%多聚甲醛穿过小室的细胞固定30 min,再用结晶紫将其染色15 min。然后用棉签轻柔拭去小室里面未迁移穿膜的细胞。静置干燥后在显微镜下通过计数穿膜细胞的数量反映细胞侵袭能力,用Image J 计数并进行统计分析。
5. 流式细胞术检测细胞凋亡
转染48 h 后的骨肉瘤细胞用不含EDTA 的胰酶消化,上清培养液终止消化,1000 转/分离心5 min,收集细胞,使用500 μL 连接缓冲液重悬细胞,然后加入5 μL Annexin V-FITC 和5 μL PI 染液,避光,室温孵育15 min。孵育染色后,然后往每管加入400 µL 连接缓冲液混匀,1 h 内上机检测。所得数据用相关配套软件分析并绘制散点图。
6. 蛋白免疫印迹法检测相关蛋白表达
采用蛋白免疫印迹法检测siIL-37 组和siNC 组细胞中的BAX、BCL-2 以及Wnt/β-catenin 信号通路相关蛋白β-catenin、c-Myc、Cyclin D1、MMP-7 TEF1 的表达,检测步骤参照前期研究。
三、统计学处理

结 果
一、正常成骨细胞系和骨肉瘤细胞系细胞中IL-37 mRNA 的表达情况比较
RT-qPCR 结果显示,IL-37 mRNA 在3 种骨肉瘤细胞系(U2OS、MG63、Saos-2 细胞)中的相对表达量均高于其在正常成骨细胞系hFOB1.19 细胞中的相对表达量(F = 13.332,P < 0.01;Dunnett-t检验P 均< 0.05),见图1。
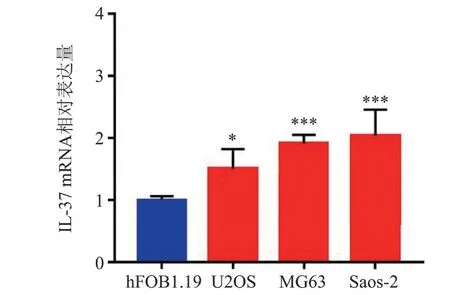
图1 正常成骨细胞系和骨肉瘤细胞系中IL-37 mRNA 的表达情况比较
二、沉默siIL-37 表达对3 种骨肉瘤细胞中IL-37 mRNA 表达的影响
3 种骨肉瘤细胞在siIL-37 组中的IL-37 mRNA相对表达量均低于其在siNC 组中的相对表达量(P 均< 0.05), 其 中IL-37 mRNA 在U2OS(t =138.276,P < 0.01) 和MG63(t = 151.863,P <0.001)细胞中的表达抑制率均> 80%,故后续实验选择这2 种细胞作进一步的研究分析,见图2。
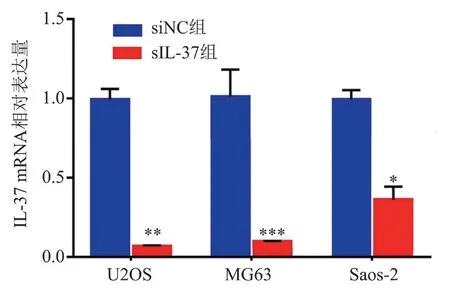
图2 沉默siIL-37 表达对3 种骨肉瘤细胞中IL-37 mRNA表达的影响
三、沉默IL-37 表达对骨肉瘤细胞增殖的影响
CCK-8 法结果显示,U2OS 细胞和MG63 细胞中siIL-37 组的细胞增殖比例均低于siNC 组(t 分别为78.521 和68.672,P 均< 0.001),见图3。
四、沉默IL-37 表达对骨肉瘤细胞凋亡的影响
流式细胞术结果显示,U2OS 细胞和MG63 细胞中siIL-37 组的细胞凋亡率均高于siNC 组(t 分别为4.257 和22.532,P 均< 0.05),见图4。
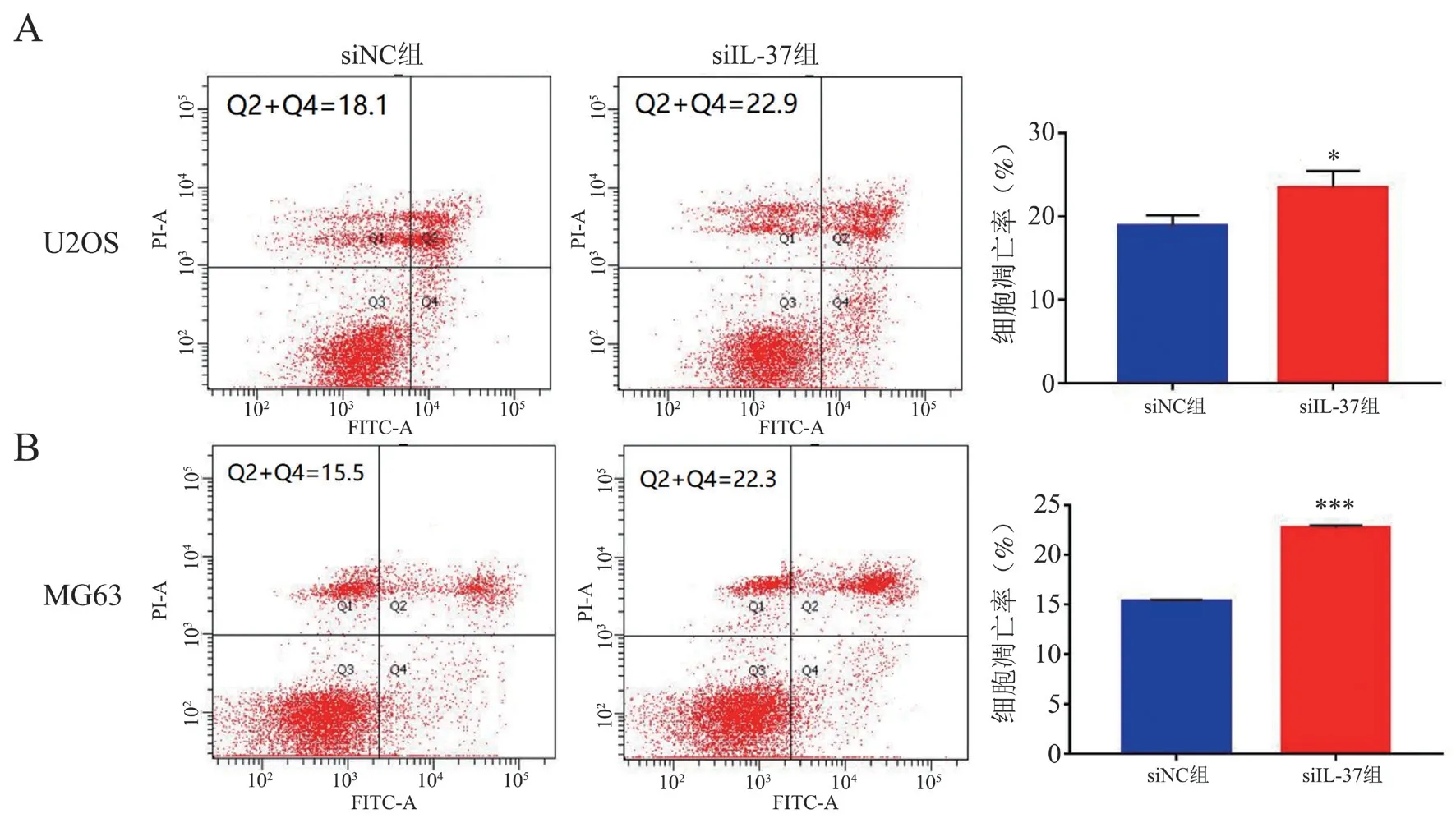
图4 沉默IL-37 表达对骨肉瘤细胞凋亡的影响
五、沉默IL-37 表达对骨肉瘤细胞迁移和侵袭

注,与siNC 组比较,***P < 0.001;每组n = 3。
的影响
Transwell 实验结果显示,无论是在U2OS 细胞中还是在MG63 细胞中siIL-37 组的迁移细胞数量(t 分别为33.213 和24.427,P 均< 0.001)和侵袭细胞数量(t 分别为15.856 和45.123,P 均< 0.01)均多于siNC 组,见图5。
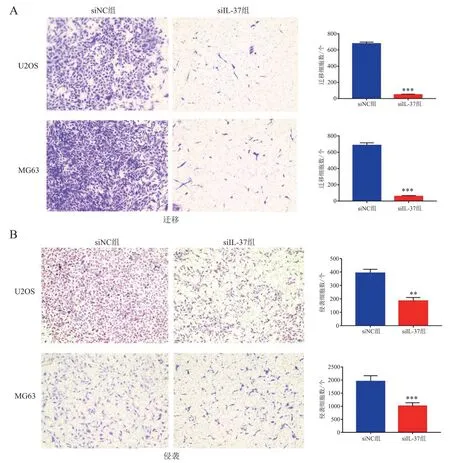
图5 沉默IL-37 表达对骨肉瘤细胞迁移和侵袭的影响(结晶紫染色,×100)
六、沉默IL-37 表达对凋亡和Wnt/β-catenin信号通路各蛋白表达的影响
蛋白免疫印迹法结果显示,与siNC 组比较,无论是在U2OS 细胞中还是在MG63 细胞中siIL-37组BAX 蛋白表达均上调(t 分别为6.371 和4.968,P 均< 0.05),而BCL-2 蛋白表达均下调(t 分别为14.576 和8.946,P 均< 0.01), 且TEF1(t 分别为9.758 和7.968,P 均< 0.01)、c-Myc(t 分别为14.652 和10.572,P 均< 0.01)、Cyclin D1(t 分别为19.629 和17.384,P 均< 0.001)和MMP-7(t分别为21.728 和16.368,P 均< 0.001)蛋白表达均下调。进一步检测β-catenin 蛋白显示,siIL-37组U2OS 和MG63 细胞中的β-catenin 蛋白相对表达量均低于siNC 组(t 分别为6.873 和8.173,P均< 0.01),见图6。

图6 沉默IL-37 表达对凋亡和Wnt/β-catenin 信号通路各蛋白表达的影响
讨 论
骨肉瘤具有病死率高、治愈率低的特点。现阶段,新辅助化学治疗、切除肿瘤和保肢重建手术是治疗骨肉瘤的主要策略。经过有效治疗,高级别骨肉瘤患者的5 年生存率可达60%~70%,因此有必要寻找更精确的诊断生物标志物及阐明骨肉瘤发生和转移的分子机制,为骨肉瘤的治疗提供潜在治疗靶点。本研究验证了IL-37 在人骨肉瘤细胞系有高表达。沉默IL-37 表达可抑制细胞增殖并同时促进细胞凋亡,证实IL-37 与骨肉瘤的发生有关。本研究还显示,沉默IL-37 表达可抑制骨肉瘤细胞迁移和侵袭,这也表明IL-37 可能与骨肉瘤的侵袭性生物行为有关。骨肉瘤的恶性生物学行为涉及复杂的分子机制和不同信号通路的激活。BCL-2 家族蛋白是细胞凋亡的重要调控因子,包括促凋亡蛋白BAX 和抗凋亡蛋白BCL-2。本研究蛋白免疫印迹结果显示,沉默IL-37 表达上调骨肉瘤细胞中BAX 表达,而下调BCL-2 的表达,研究结果表明IL-37 可能通过BAX/BCL-2 调控骨肉瘤增殖凋亡的恶性生物学行为。前期研究表明,Wnt/β-catenin 信号通路在人类骨肉瘤的发病和发展中起着关键作用,该途径调节细胞中β-catenin 表达水平,促进肿瘤血管生成和逃避免疫监测,对骨肉瘤侵袭性进展起关键作用。Wnt/β-catenin通路中的下游靶标TEF1、c-Myc、Cyclin D1 和MMP-7 在调控肿瘤增殖、凋亡、侵袭和转移等恶性生物学行为中发挥至关重要的作用。本研究中,沉默IL-37 表达后Wnt/β-catenin 通路的关键蛋白β-catenin 及其下游靶标(TEF1、c-Myc、Cyclin D1 和MMP-7)均相应下调。c-Myc 是人类常见的活化原癌基因之一,参与多种恶性肿瘤的发生发展。作为转录因子,早期研究发现c-Myc转录靶标参与了许多生物过程,如代谢、细胞生长、细胞周期调节和细胞凋亡。Cyclin D1 充当细胞周期进程的中央调节器,该蛋白的异常表达促使细胞的周期发生改变是肿瘤发生的重要因素。MMP 家族组成一系列转录因子,它们能够调节肿瘤的微环境,主要是通过细胞外基质的降解来实现的,外基质的降解为细胞的侵袭和转移创造了条件。MMP-7 的表达和激活在几乎所有类型的恶性肿瘤中都存在,尤其与肿瘤转移有关。研究结果表明,IL-37 可能通过BAX/BCL-2 和Wnt/β-catenin 信号通路调控骨肉瘤发生发展,因此有望成为骨肉瘤临床早期诊疗的肿瘤标志物和治疗靶标。
综上所述,IL-37 在骨肉瘤细胞中上调,沉默IL-37 可以抑制骨肉瘤细胞增殖、迁移和侵袭,其机制可能与BAX/BCL-2 表达和调控Wnt/β-catenin信号通路有关。研究结果为骨肉瘤发生机制的深入研究奠定了基础,对骨肉瘤的预防及治疗具有一定意义,但本研究仅在体外评估了IL-37 的生物学功能,下一步将用动物实验进行体内验证。
