阻塞性睡眠呼吸暂停综合征对大鼠海马神经细胞线粒体自噬相关蛋白表达的影响*
2022-06-26卢亚凤殷梅
卢亚凤,殷梅
(昆明医科大学第二附属医院 神经内科,云南 昆明 650101)
阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS)是一种睡眠呼吸相关性疾病,可导致全身多系统损伤,特别是认知损害。有文献[1]综述了中国、美国、西班牙、印度、韩国、日本及瑞典在1993年—2013年的11项基于人口的OSAS患病率的调查发现,男性OSAS患病率为22%,女性为17%,且患病率随时间延长而升高。有研究[2]表明,合并OSAS脑卒中患者的认知障碍更严重。OSAS患者存在轻度认知障碍已被明确肯定[3],但其具体机制未明。OSAS治疗方法主要为持续性正压通气,能有效改善认知障碍[4],但要求患者有较高的依从性,其他治疗手段及疗效有限。因此,OSAS致认知障碍的研究任重而道远。另一方面,早在2005年,LEMASTERS等[5]提出,缺氧、饥饿、能量匮乏等刺激能诱导细胞产生线粒体自噬。有研究[6]也提出,一定程度的缺氧能诱发细胞产生线粒体自噬异常。慢性间歇性缺氧是OSAS主要的病理生理机制[7],而海马对缺氧的敏感性高[8]。本研究拟检测OSAS模型大鼠海马神经细胞的线粒体变化。其中,LC3及LC3Ⅱ/LC3Ⅰ反映了细胞自噬小体的数量及线粒体自噬活性,而p62蛋白含量与其自噬活性成反比[9-10];PINK1-Parkin途径是线粒体自噬过程中最主要的分子机制之一[11-12],也是线粒体质量控制途径[13-14]。目前国内外关于线粒体自噬与OSAS的相关性研究较少。本研究拟通过检测上述相关蛋白的表达,探讨线粒体自噬在OSAS模型大鼠海马神经细胞中的变化,可能为研究OSAS导致的认知障碍开辟新的方向。
1 材料与方法
1.1 动物、试剂和仪器
成年雄性SD大鼠24只,体重180~230 g/只,购自昆明医科大学实验动物学部[生产许可证:SCXK(滇)K2015-0002]。LC3、p62、PINK1、Parkin抗体及β-actin抗体均购自美国CST公司,透明质酸钠凝胶购自上海其胜生物制剂公司,RIPA裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE蛋白上样缓冲液(6X)均购自广州碧云天公司,蛋白酶抑制剂cocktail、Phostop磷酸化蛋白酶抑制剂购自罗氏公司,PVDF膜(0.22μm及0.45μm)、ECL显色液购自密理博(上海)贸易有限公司,2.5%戊二醛、乙醇、醋酸双氧铀硝酸铅、Epon812环氧树脂均购自西陇化工。多参数神经监护仪购自上海诺诚医疗器械公司,光学显微镜、JEM-1011 TEM透射电子显微镜购自日本JEOL公司。
1.2 模型复制
将24只SD大鼠随机分为对照组(6只)和实验组(18只)。实验组复制OSAS模型,对照组无特殊处理。
1.2.1 OSAS大鼠模型复制在YU等[15]学者的研究基础上,参照周赵德等[16]的方法进行模型复制:模型复制前,用多参数神经监护仪监测大鼠的血氧饱和度,然后用10%水合氯醛腹腔麻醉后,于大鼠舌根、咽腭弓、舌腭弓处,多点注射透明质酸钠凝胶,3 mL/只。注射完成后将大鼠按组别分笼饲养于SPF实验动物房,实验前适应性喂养1周,每日光照12 h,室内温度20~26℃,颗粒饲料自由饮食,每日更换垫料1次,保持饲养环境卫生。
1.2.2 模型复制成功的标准正常大鼠活动正常,反应灵敏,警觉性高,进食正常;模型复制成功后的大鼠反应慵懒,警觉性差,进食减少,偶有呼吸节律不规则等。实验组大鼠观察4周后再次进行血氧饱和度的监测,比较模型复制前后的最低血氧饱和度及平均血氧饱和度,如果差异有统计学意义,可判定模型复制成功。
1.2.3 实验取材实验组大鼠模型复制成功后分别于2、4、6周脱颈处死,即为2周组、4周组和6周组,每组6只;对照组直接脱颈处死。酒精消毒,暴露并剔除颅骨取脑,在冰面上快速分离出海马组织,一半置于EP管中放入-80℃冰箱冷冻保存备Western blotting检测,一半置于2.5%戊二醛中避光后放入4℃冰箱中保存备行透射电子显微镜观察。
1.3 Western blotting检测大鼠海马神经细胞LC3、LC3Ⅱ/LC3Ⅰ、p62、PINK1及Parkin的蛋白相对表达量
取大鼠海马组织,每100 mg组织中加入500μL的RIPA裂解液(含50μL蛋白酶抑制剂),用无菌眼科剪剪碎后,冰浴环境下,用超声细胞破碎仪匀浆20 s,冰浴上静置裂解20 min。4℃下,12 000 r/min离心10 min,收集上清液。用BCA蛋白浓度测定试剂盒测定浓度,然后灌胶与上样,进行SDS-PAGE电泳,用湿转模法转模;再将PVDF膜置于5%的牛血清白蛋白中,室温(20~30℃)封闭1 h,于脱色摇床上,TBST漂洗3次,每次5 min,尽量吸干BSA液,加入一抗5 mL,装入杂交袋中,将剪好的PVDF膜置于其中,捆绑于静音混合仪上,放置4℃冰箱中过夜;去除一抗,加入TBST缓冲液洗膜3次,每次10 min;加入酶标二抗,室温孵育2 h;洗膜后进行ECL显色。采集图像,用Image J软件测定海马神经细胞LC3、LC3Ⅱ/LC3Ⅰ、p62、PINK1及Parkin蛋白相对表达量。β-actin为内参。
1.4 透射电子显微镜观察
取2.5%戊二醛4℃固定的海马组织,用PBS缓冲液冲洗3次,每次10 min;用锇酸固定后进行乙醇系列梯度脱水,即用30%、50%、70%、90%、100%浓度的乙醇脱水,每次10 min,其中用100%的酒精进行2次脱水;再用Epon812环氧树脂包埋,分别在37℃、45℃、65℃的温箱固化,每级温度固化24 h;然后用UltracutE超薄切片机切片,再用醋酸双氧铀硝酸铅染色后上机测试;最后用JEM-1011 TEM透射电子显微镜观察并采集图像。
1.5 统计学方法
数据分析采用SPSS 24.0统计软件。计量资料以均数±标准差(±s)表示,两组比较用t检验,多组比较采用方差分析,进一步两两比较用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 OSAS对大鼠血氧饱和度的影响
实验组大鼠模型复制前后最低血氧饱和度和平均血氧饱和度比较,采用配对t检验,差异有统计学意义(P<0.05),见表1。说明OSAS大鼠模型复制成功。
表1 实验组大鼠模型复制前后最低血氧饱和度和平均血氧饱和度比较(%,±s)
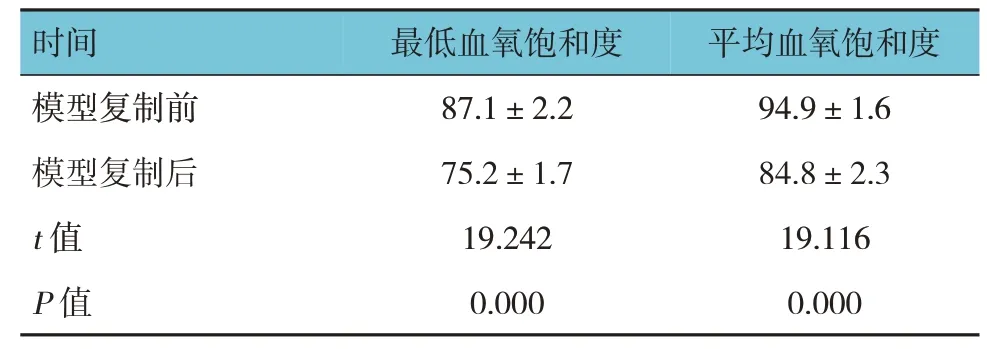
表1 实验组大鼠模型复制前后最低血氧饱和度和平均血氧饱和度比较(%,±s)
时间模型复制前模型复制后t值P值最低血氧饱和度87.1±2.2 75.2±1.7 19.242 0.000平均血氧饱和度94.9±1.6 84.8±2.3 19.116 0.000
2.2 OSAS对大鼠海马细胞线粒体自噬相关蛋白表达的影响
对照组、2周组、4周组和6周组大鼠的海马神经细胞LC3、LC3Ⅱ/LC3Ⅰ、p62、PINK1及Parkin蛋白相对表达量比较,差异有统计学意义(P<0.05)。进一步两两比较,2周组、4周组和6周组大鼠的海马神经细胞LC3、LC3Ⅱ/LC3Ⅰ、PINK1及Parkin蛋白相对表达量均高于对照组(P<0.05),p62蛋白相对表达量低于对照组(P<0.05);4周组LC3、LC3Ⅱ/LC3Ⅰ、PINK1及Parkin蛋白相对表达量高于2周组(P<0.05),p62表达均低于2周组(P<0.05);6周组LC3、LC3Ⅱ/LC3Ⅰ、PINK1及Parkin蛋白相对表达量高于4周组(P<0.05),p62表达低于4周组(P<0.05)。见表2和图1。
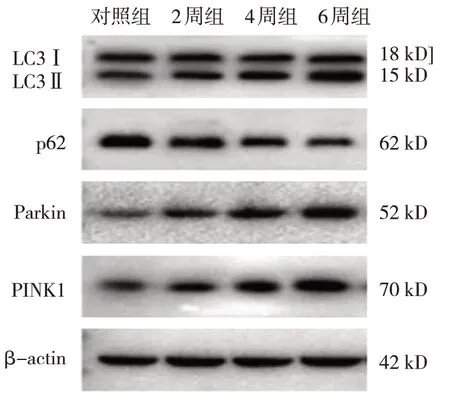
图1 各组大鼠海马神经细胞线粒体自噬相关蛋白的表达
表2 4组大鼠海马神经细胞线粒体自噬相关蛋白的相对表达量比较(n=6,±s)
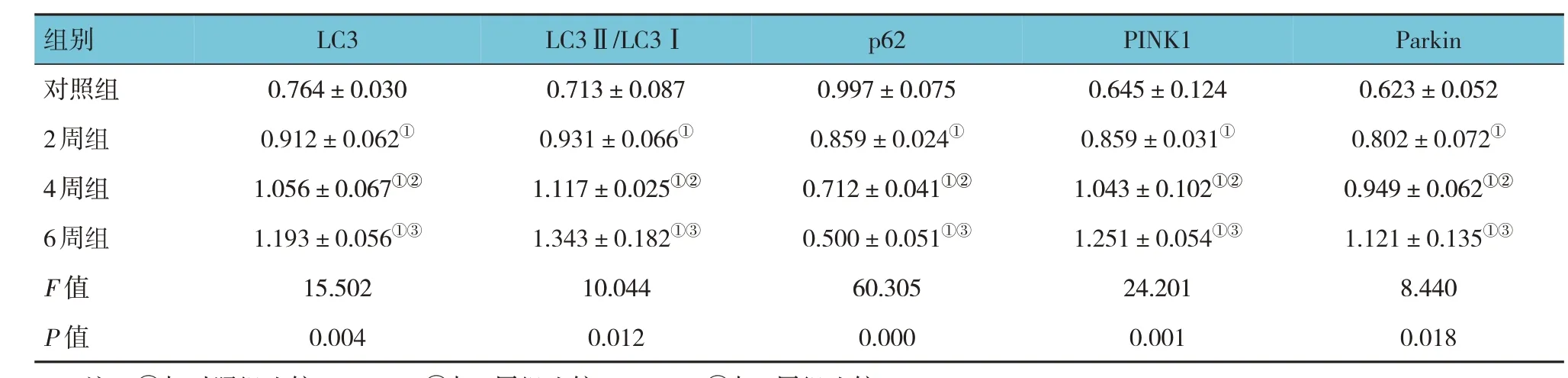
表2 4组大鼠海马神经细胞线粒体自噬相关蛋白的相对表达量比较(n=6,±s)
注:①与对照组比较,P<0.05;②与2周组比较,P<0.05;③与4周组比较,P<0.05。
组别对照组2周组4周组6周组F值P值LC3 0.764±0.030 0.912±0.062①1.056±0.067①②1.193±0.056①③15.502 0.004 LC3Ⅱ/LC3Ⅰ0.713±0.087 0.931±0.066①1.117±0.025①②1.343±0.182①③10.044 0.012 p62 0.997±0.075 0.859±0.024①0.712±0.041①②0.500±0.051①③60.305 0.000 PINK1 0.645±0.124 0.859±0.031①1.043±0.102①②1.251±0.054①③24.201 0.001 Parkin 0.623±0.052 0.802±0.072①0.949±0.062①②1.121±0.135①③8.440 0.018
2.3 OSAS对大鼠海马神经细胞线粒体的影响
与对照组比较,2周组、4周组和6周组大鼠海马区可见被双层或多层磷脂双分子层包裹的线粒体自噬体(见图2及图中箭头所指)。
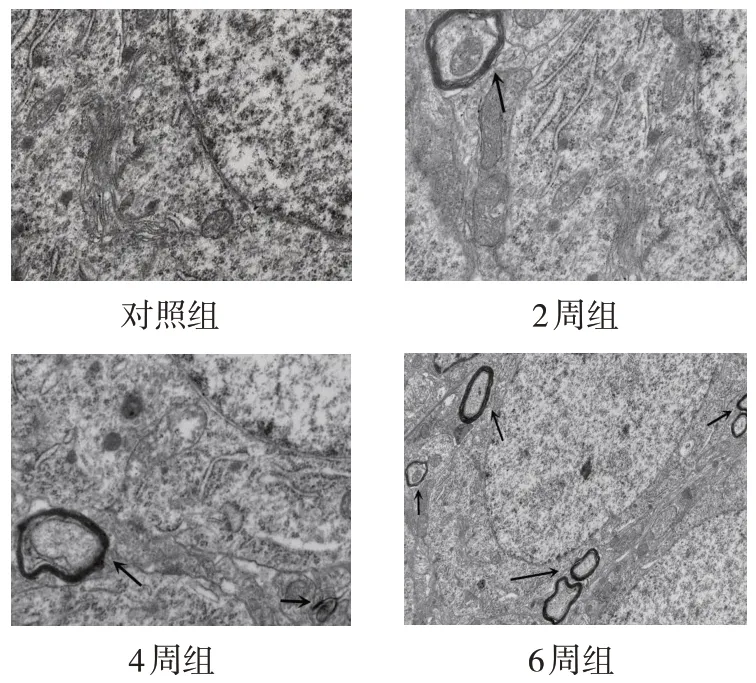
图2 各组大鼠海马神经细胞线粒体透射电镜图(×20 000)
3 讨论
慢性间歇性缺氧可致大鼠海马神经细胞受损,破坏海马结构[17],而海马在机体情绪和认知中发挥重要作用[18]。本课题组前期研究[16]表明,咽腔注射透明质酸钠凝胶的方法可复制OSAS大鼠模型,且OSAS可致大鼠空间记忆力损害,饲养时间越长受损程度越重。可见,OSAS对认知功能造成的影响不容忽视。本研究从OSAS最主要的病理机制——慢性间歇性缺氧出发,运用同样的方法复制OSAS大鼠模型,结果显示,模型复制后的OSAS大鼠反应迟钝,警觉性较差,且血氧饱和度低于对照组,说明模型复制成功。
另一方面,线粒体自噬,俗称“自己吃自己”,能通过自噬迅速清除自身功能失调线粒体和已损坏的细胞器[19]。在人体内,衰老、局部活性氧的积累、暴露于毒素、缺氧等条件下均可发生线粒体损伤[14];本研究在电镜下观察到OSAS大鼠海马细胞被双层或多层磷脂双分子层包裹的线粒体自噬体,进一步检测其自噬相关蛋白的表达,结果显示,与对照组比较,2周组、4周组、6周组LC3、LC3Ⅱ/LC3Ⅰ、PINK1及Parkin蛋白表达均升高,p62表达均下降,说明模型复制后继续饲养时间越长,OSAS大鼠线粒体自噬相关蛋白LC3、LC3Ⅱ/LC3Ⅰ、PINK1及Parkin的表达越高,p62蛋白表达越低,OSAS引起细胞自噬活性增加,自噬体生成增多,这和电镜下观察到的自噬小体增多的结果一致,证实了OSAS引起大鼠海马神经细胞出现线粒体自噬,这也与缺氧引起细胞线粒体自噬存在一致性。
一定程度的缺氧能导致线粒体产生大量的活性氧[20],而活性氧的过量积累会破坏细胞结构,引起多脏器细胞的损伤[21],而神经细胞突触部分的能量需求来源于线粒体网[22-23],这对神经元的影响较为显著。并且,线粒体自噬异常(线粒体过度自噬或缺失),均会损伤神经细胞,导致神经细胞的凋亡,最终损害中枢神经系统[24]。在本研究中,模型复制后继续饲养时间越长,OSAS大鼠线粒体自噬相关蛋白LC3、LC3Ⅱ/LC3Ⅰ、PINK1及Parkin的表达越高,p62蛋白表达越低,表明其线粒体自噬程度随饲养时间延长而加重。这不排除随着模型复制后时间的延长,可能存在线粒体的过度自噬,这种自噬异常有可能损伤神经系统。
线粒体自噬也被称为自噬-溶酶体途径,自噬体的明显增多可能是过度自噬,也可能是损害了自噬-溶酶体途径[25],了解线粒体自噬过程中具体的分子机制及其在神经元动态平衡中的具体影响至关重要[14]。而本研究不足之处在于未能检测其他自噬途径及相关蛋白,但不可否认的是,本研究也为进一步研究线粒体自噬与OSAS大鼠海马受损的相关性开辟了新的方向。
