ELK1调控PI3K/Akt信号通路促进骨肉瘤细胞增殖及其机制研究
2022-06-26徐永军董舒王昊
徐永军,董舒,王昊
(咸阳市中心医院1.骨一科,2.骨四科,陕西 咸阳 712000)
骨肉瘤是常见的原发性恶性骨肿瘤,具有青少年儿童发病率高、疾病进展快、恶性程度高及远处转移和复发率高的特点[1]。尽管手术治疗与化疗相结合可以提高骨肉瘤患者的生存率,但骨肉瘤患者的预后仍然不能令人满意,尤其是在初次检查时出现临床转移的患者中[2]。表观遗传学领域的新证据表明,骨肉瘤是由遗传改变和遗传积累引起的。肿瘤的恶性进展取决于基因的调控,因此寻找与骨肉瘤恶性表型显著相关及在骨肉瘤中发挥关键作用的基因至关重要[3]。E26转录因子1(E-twenty six transcription factor 1,ELK1)是属于ETS家族和三元复合因子(ternary complex factor,TCF)亚家族的转录因子,在调节细胞生长、分化及存活中起关键作用[4]。ELK1在结直肠癌、骨肉瘤、胃癌等多种恶性肿瘤中表达升高,促进恶性肿瘤的发生、发展[5-7],而ELK1在骨肉瘤中发挥的具体生物学功能未知。PI3K/Akt信号通路是与肿瘤发生、发展密切相关的重要调控途径[8],抑制其激活可作为抗肿瘤治疗的有效策略[9]。因此,本文对ELK1在骨肉瘤中发挥的生物学功能及其通过调控PI3K/Akt信号通路的作用机制进行了初步研究,旨在获得ELK1作为骨肉瘤治疗潜在分子靶点的重要实验室依据。
1 材料与方法
1.1 细胞与主要试剂
骨肉瘤细胞系U2OS、MG-63、HOS及正常成骨细胞hFOB11.9(中国科学院细胞库提供),培养基、胎牛血清和胰酶(美国Hibco公司);6孔板、96孔板及培养瓶(美国Coring公司),RIPA(北京索莱宝试剂有限公司),BCA蛋白检测试剂盒(上海碧云天生物技术有限公司),PVDF膜(美国Promega公司),ECL发光液(美国millipore公司),ELK1 siRNA(广州锐博生物生物技术有限公司),MTS增殖检测试剂盒(中国北京百奥莱博科技有限公司),吉姆萨染色(上海歌凡生物科技有限公司),ELK1、pPI3K和pAkt抗体(英国Abcam公司)。
1.2 细胞培养
骨肉瘤细胞系U2OS、MG-63、HOS及正常成骨细胞hFOB11.9复苏后重悬至含有10%胎牛血清的培养基中,全湿度条件下放置在37℃、5%二氧化碳培养箱中培养。观察培养基的颜色,变为黄色时更换新鲜培养基,细胞融合度为95%左右时,以1∶2进行细胞传代。
1.3 Western blotting检测ELK1蛋白相对表达量
骨肉瘤细胞系U2OS、MG-63、HOS及正常成骨细胞hFOB11.9长满后,胰酶进行消化后收集细胞,PBS洗3次,获得细胞斑块,加入RIPA混匀于冰上裂解细胞10 min,4℃高速离心30 min。取4μL上清液检测ELK1蛋白,其余的上清液移至新的EP管中,加入上样缓冲液煮沸蛋白变性。蛋白加至SDS-PAGE凝胶中,电泳仪80 V分离蛋白,100 V转膜(PVDF膜),PVDF膜放至8%脱脂牛奶中室温孵育1 h,TBST洗3次,加入ELK1和内参GAPDH一抗稀释液4℃孵育过夜,TBST洗3次后,加入兔二抗室温孵育1 h,ECL试剂盒显示蛋白条带。Image J软件分析各组细胞中ELK1的相对表达量。
1.4 细胞转染
对常规培养中ELK1蛋白相对表达量最高的骨肉瘤细胞进行ELK1 siRNA感染。细胞呈对数生长时,胰酶进行消化后收集细胞数,以1×105个/孔接种至6孔板中,分为si-NC组(对照)、si-ELK1-1组(ELK1干扰siRNA序列1)及si-ELK1-2组(ELK1干扰siRNA序列2)。细胞贴壁后采用Lipofectamine 2000进行各组siRNA转染,全湿度条件下放置在37℃、5%二氧化碳培养箱中培养12 h后更换新鲜培养基,转染48 h后,按照1.3中方法检测各组细胞中ELK1蛋白相对表达量,验证各组ELK1 siRNA转染效率。
1.5 MTS实验
对常规培养中ELK1蛋白相对表达量最高的骨肉瘤细胞进行MTS实验。细胞呈对数生长时,胰酶进行消化后收集细胞数,以1 000个/孔接种至96孔板中,分为si-NC组、si-ELK1-1组及si-ELK1-2组,按照1.4细胞转染的方法进行转染。转染48 h后,向96孔板中加入30μL/孔MTS试剂,全湿度条件下放置在37℃、5%二氧化碳培养箱中孵育2 h后,检测各孔在490 nm波长处的OD值。细胞增殖率=实验组OD值/对照组OD值×100%。
1.6 平板克隆实验
对常规培养中ELK1蛋白相对表达量最高的骨肉瘤细胞进行平板克隆实验。细胞呈对数生长时,胰酶进行消化后收集细胞数,以500个/孔接种至6孔板中,分为si-NC组、si-ELK1-1组和si-ELK1-2组,按照1.4细胞转染的方法进行转染。全湿度条件下放置在37℃、5%二氧化碳培养箱中培养2周左右,肉眼可见克隆团形成时终止细胞培养,培养过程中培养基变黄时更换新鲜培养基。PBS洗3次,加入甲醇固定10 min,加入吉姆萨染液进行细胞染色,扫描拍照计数各组细胞克隆团形成数目,检测各组细胞克隆形成能力。
1.7 PI3K/Akt信号通路检测
收集转染的各组细胞,按照1.3中Western blotting检测si-NC组、si-ELK1-1组及si-ELK1-2组中PI3K/Akt信号通路关键蛋白pPI3K和pAkt的相对表达量。
1.8 SC79处理骨肉瘤细胞进行功能回复实验
对常规培养中ELK1相对表达最高的骨肉瘤细胞进行功能回复实验。细胞呈对数生长时,胰酶进行消化后收集细胞数,以1×105个/孔接种至6孔板中,分为si-NC组、si-ELK1组及si-ELK1+SC79组,细胞贴壁后si-NC组转染对照siRNA、si-ELK1组转染干扰ELK1表达效果较好的ELK1 siRNA,si-ELK1+SC79组转染ELK1 siRNA的同时加入5μmol SC79作用48 h,采用MTS实验和平板克隆实验检测各组细胞的增殖率和克隆形成能力。
1.9 统计学方法
数据分析用SPSS 17.0统计软件。计量资料以均数±标准差(±s)表示,多组间的比较用单因素方差分析,进一步两两比较采用Dunnett-t法,P<0.05为差异有统计学意义。
2 结果
2.1 ELK1在骨肉瘤细胞系中的相对表达量
Western blotting结果显示,ELK1在骨肉瘤细胞系U2OS、MG-63、HOS中 的 表 达 分 别 为(6.12±1.05)、(2.51±0.11)和(2.99±0.13),在正常成骨细胞hFOB11.9中的表达为(0.98±0.07),多组间比较差异有统计学意义(F=49.155,P=0.000),与正常成骨细胞比较,ELK1在骨肉瘤细胞系中的相对表达量均升高(P<0.05),其中,在U2OS细胞中的相对表达量最高(P<0.05)。见图1。

图1 ELK1在骨肉瘤细胞系和正常成骨细胞中的相对表达量比较(±s)
2.2 ELK1 siRNA转染效果
选择ELK1相对表达量最高的骨肉瘤细胞U2OS进行ELK1 siRNA转染,Western blotting结果显示,ELK1在si-NC组、si-ELK1-1组及si-ELK1-2组U2OS细胞中的相对表达量分别为(1.95±0.35)、(0.85±0.08)和(0.62±0.09),3组比较,差异有统计学意义(F=33.195,P=0.001);与si-NC组比较,si-ELK1-1组和si-ELK1-2组U2OS细胞中ELK1蛋白的相对表达量降低(P<0.05),si-ELK1-2组的干扰效果较好,可进行后续的功能回复实验。见图2。
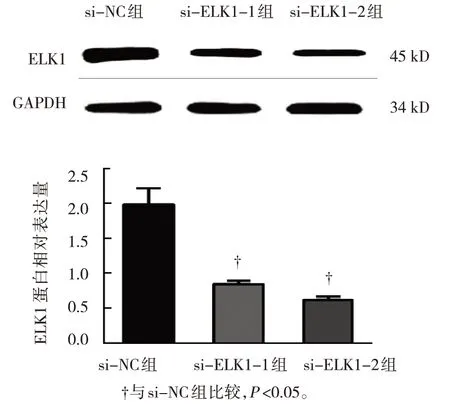
图2 ELK1 siRNA转染效果
2.3 干扰ELK1对U2OS细胞增殖率的影响
MTS实验结果显示,si-NC组、si-ELK1-1组及si-ELK1-2组U2OS细胞增殖率分别为(100.00±0.00)%、(47.22±6.22)%和(35.42±5.44)%,3组比较,差异有统计学意义(F=311.746,P=0.000);与si-NC组比较,si-ELK1-1组和si-ELK1-2组U2OS细胞增殖率降低(P<0.05)。见图3。
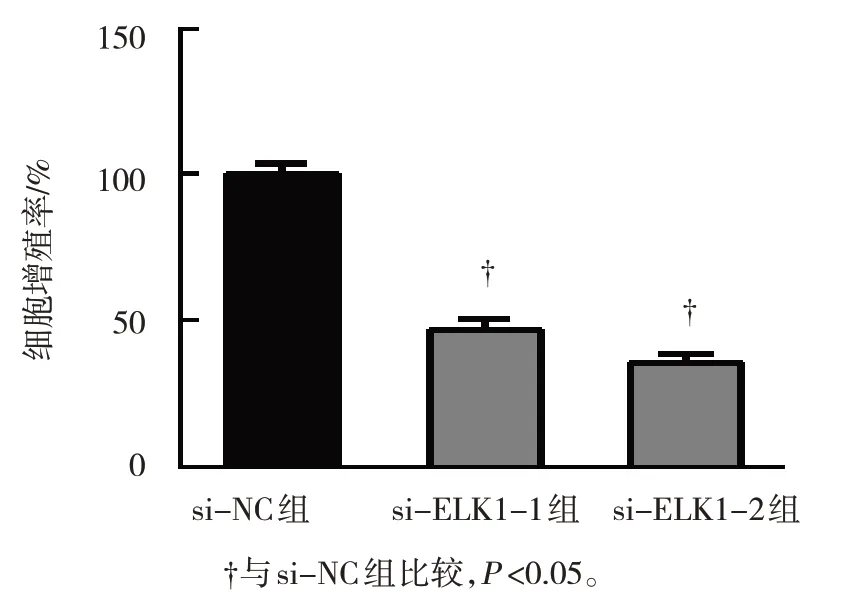
图3 干扰ELK1对U2OS细胞增殖率的影响
2.4 ELK1对U2OS细胞克隆形成能力的影响
平板克隆形成实验结果显示,si-NC组、si-ELK1-1组及si-ELK1-2组U2OS细胞克隆形成数目分 别 为(116.33±13.54)个、(69.67±6.29)个 和(36.67±8.42)个,3组比较,差异有统计学意义(F=49.075,P=0.000);与si-NC组比较,si-ELK1-1组和si-ELK1-2组U2OS细胞克隆形成能力降低(P<0.05)。见图4。
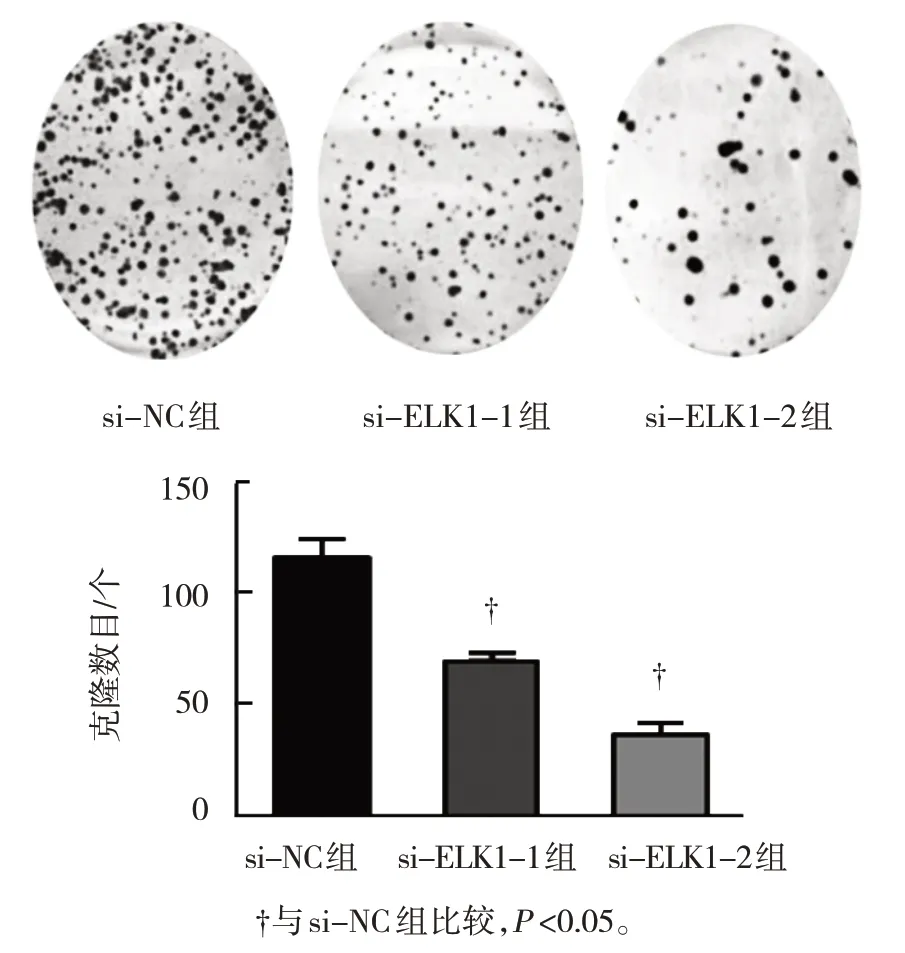
图4 干扰ELK1对U2OS细胞克隆形成能力的影响
2.5 ELK1对U2OS细胞中PI3K/Akt信号通路的影响
Western blotting实验结果显示,si-NC组、si-ELK1-1组及si-ELK1-2组U2OS细胞中PI3K和Akt蛋白相对表达量比较,差异无统计学意义(P>0.05);si-NC组、si-ELK1-1组及si-ELK1-2组U2OS细胞中pPI3K和pAkt蛋白相对表达量比较,差异有统计学意义(P<0.05),si-ELK1-1组和si-ELK1-2组的pPI3K和pAkt蛋白相对表达量较si-NC组降低(P<0.05)。见表1和图5。
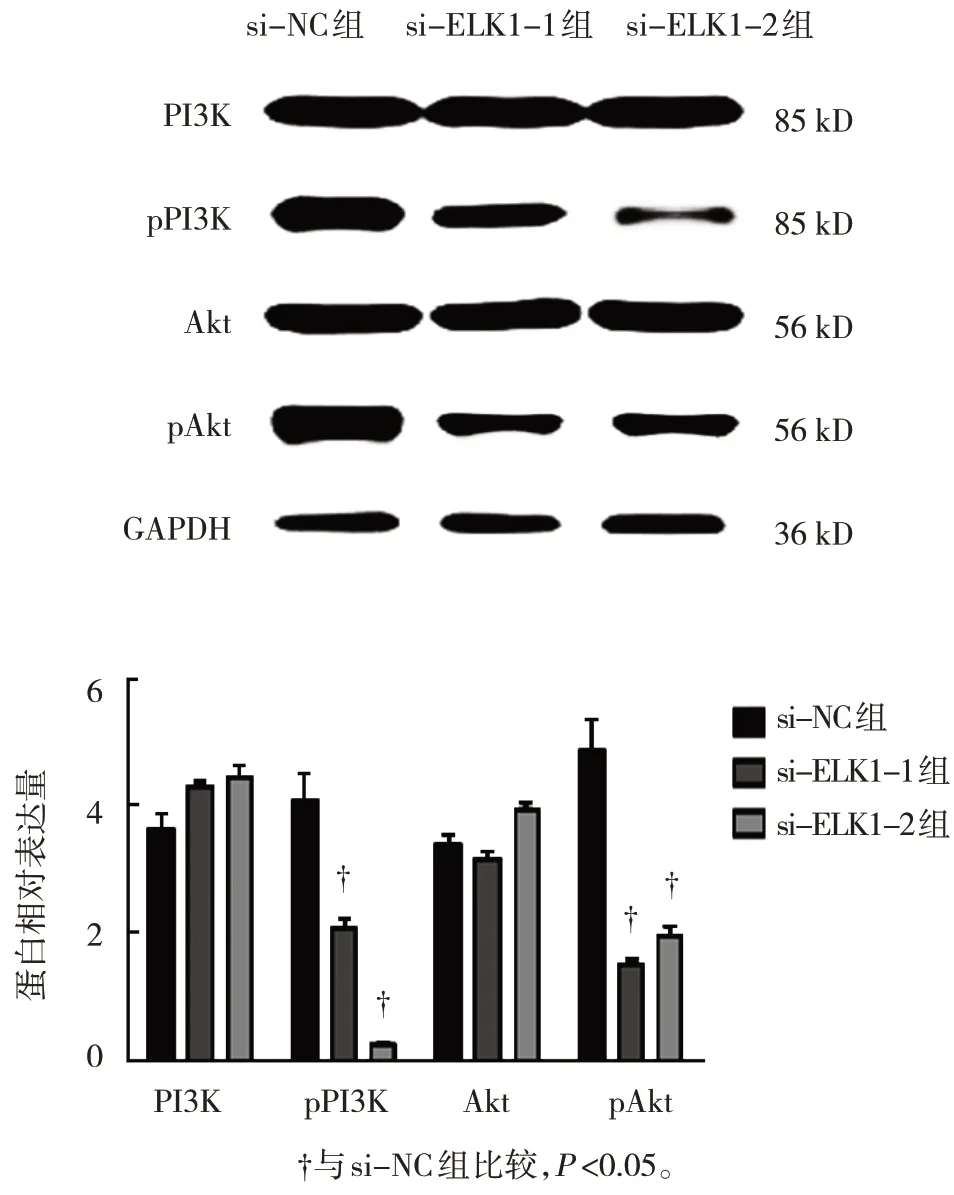
图5 干扰ELK1对U2OS细胞PI3K/Akt信号通路的影响
表1 干扰ELK1对PI3K/Akt信号通路的影响(±s)
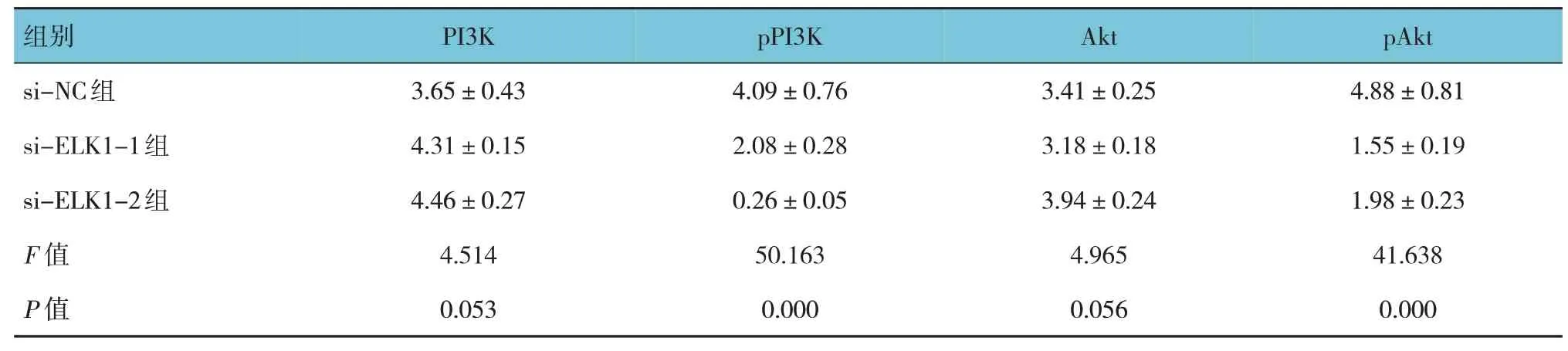
表1 干扰ELK1对PI3K/Akt信号通路的影响(±s)
组别si-NC组si-ELK1-1组si-ELK1-2组F值P值PI3K 3.65±0.43 4.31±0.15 4.46±0.27 4.514 0.053 pPI3K 4.09±0.76 2.08±0.28 0.26±0.05 50.163 0.000 Akt 3.41±0.25 3.18±0.18 3.94±0.24 4.965 0.056 pAkt 4.88±0.81 1.55±0.19 1.98±0.23 41.638 0.000
2.6 ELK1调控PI3K/Akt信号通路影响U2OS细胞增殖和克隆形成能力
采用PI3K/Akt信号通路激活剂SC79处理ELK1 siRNA转染的细胞进行功能回复实验的研究。MTS实验结果显示,si-NC组、si-ELK1组和si-ELK1+SC79组U2OS细胞增殖率分别为(100.00±0.00)%、(37.36±6.44)%、(56.14±7.19)%,3组比较,差异有统计学意义(F=99.820,P=0.000),与si-NC组比较,si-ELK1组和si-ELK1+SC79组U2OS细胞增殖率降低(P<0.05)。与si-ELK1组比较,si-ELK1+SC79组U2OS细胞增殖率增加(P<0.05),SC79减弱ELK1对细胞增殖率的抑制作用。
平板克隆实验结果显示,si-NC组、si-ELK1-1组和si-ELK1-2组U2OS细胞克隆形成数目分别为(109.67±18.66)个、(35.33±6.85)个、(72.67±5.22)个,3组比较,差异有统计学意义(F=29.44,P=0.001);与si-NC组比较,si-ELK1-1组和si-ELK1-2组U2OS细胞克隆形成数目减少(P<0.05)。与si-ELK1-1组比较,si-ELK1-2组U2OS细胞克隆形成数目增加(P<0.05),SC79减弱ELK1对细胞克隆形成能力的抑制作用。见图6。
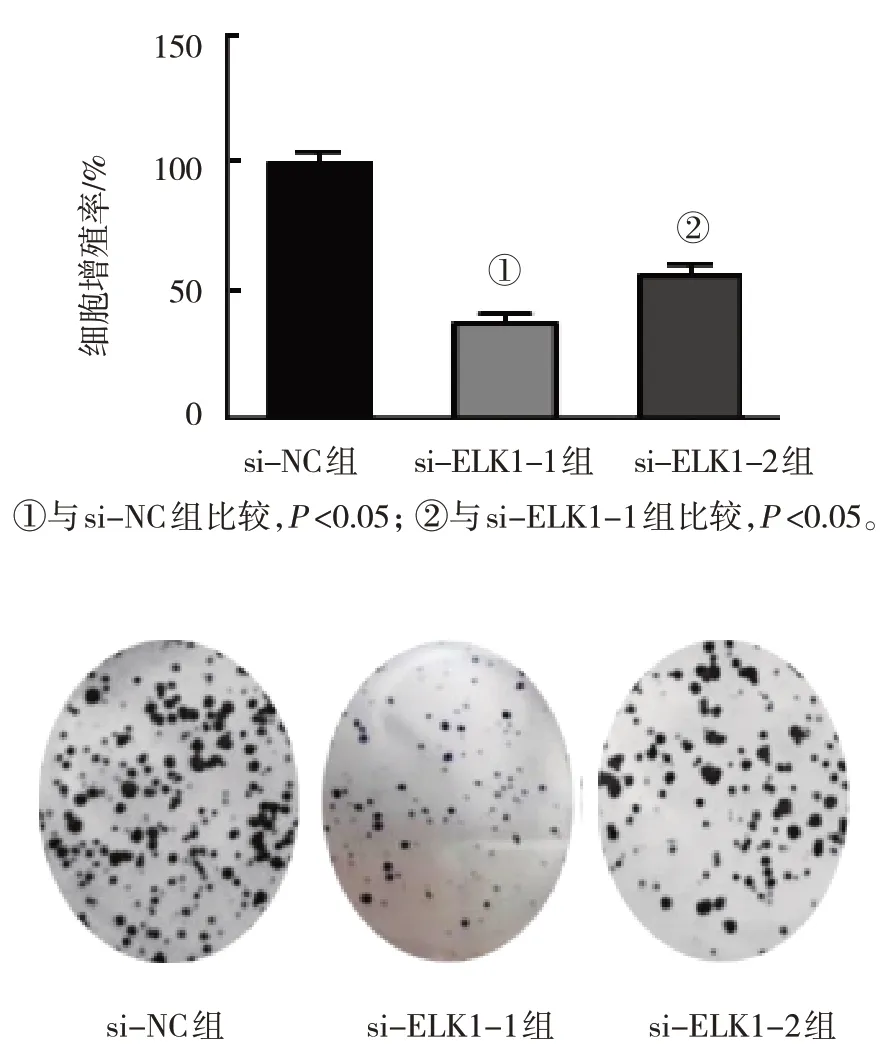
图6 ELK1调控PI3K/Akt信号通路影响U2OS细胞增殖和克隆形成能力
3 讨论
骨肉瘤的发病率为3/100万,是骨组织中最常见的恶性肿瘤[1]。骨肉瘤最常见的发病部位是股骨远端,其次是胫骨近端和肱骨长骨的干骺端。骨肉瘤通常发生在青少年中,0~24岁骨肉瘤患者的发病率为2.0%~7.6%,在所有儿童和青少年骨恶性肿瘤死亡者中,约有8.9%是由骨肉瘤引起的[10]。手术联合放化疗是骨肉瘤患者的主要治疗方法,对早期患者疗效较好,但是约有20%的骨肉瘤患者在初次检查时就出现了肺部临床转移症状,长期生存率较差,骨肉瘤患者的5年生存率仅为60%左右[10]。骨肉瘤的复发和转移导致病死率升高,研究报道局限性早期骨肉瘤患者5年生存率为80%,而晚期骨肉瘤患者的5年生存率仅为15%~30%[11]。因此研究骨肉瘤进展的分子机制对改善患者预后具有重要意义。骨肉瘤的发病机制是错综复杂的,主要由遗传和环境因素组成[3]。针对肿瘤发生、发展中关键基因的治疗是新近发现的抗肿瘤治疗,即分子靶向治疗,骨肉瘤的分子靶向治疗仍处于研究阶段,在分子水平研究骨肉瘤的恶性进展机制是寻找抗骨肉瘤治疗的关键途径[12]。
E26(E-twenty six,ETS)家族是较大的细胞内转录因子调控家族之一,该家族大多数的成员在生理和病理过程中具有重要的作用,包括胚胎发育、细胞分化、细胞增殖与凋亡、细胞与细胞间的相互作用等,在包括恶性肿瘤在内的人类疾病中发挥重要调控作用[13]。ETS家族重要调控转录因子之一的ELK1同样在调控细胞增殖、分化及存活过程中发挥关键作用,研究报道[14]ELK1是新型的肿瘤促癌基因,在前列腺癌中ELK1表达与较高的临床T期、病理T期,格里森评分、预后等级及阳性淋巴结状态相关,并是前列腺癌疾病复发的独立预后因子。在宫颈癌中ELK1诱导GPC3-AS1/GPC3轴促进宫颈癌细胞的增殖和迁移[15]。而SU等[6]研究报道长链非编码RNA(lncRNA)MIR100HG在骨肉瘤组织和细胞系中高表达,其高表达是骨肉瘤患者预后不良因素,干扰MIR100HG的表达可抑制骨肉瘤细胞增殖和细胞周期的进程,并促进细胞凋亡,其作用机制是被转录因子ELK1上调。因此ELK1上调促进骨肉瘤的进程。而本文对ELK1在骨肉瘤中的直接生物学作用进行研究。首先Western blotting检测发现,ELK1在骨肉瘤细胞系中的相对表达量高于其在正常成骨细胞中的相对表达量,并选择ELK1相对表达最高的骨肉瘤细胞进行干扰,MTS和平板克隆实验发现骨肉瘤细胞的增殖能力下降,表明ELK1在骨肉瘤细胞中高表达促进细胞的增殖。由于组织样本的限制,本文未在骨肉瘤组织水平对ELK1的表达水平进行验证,仍需在后续实验中进行补充。
ELK1在骨肉瘤中发挥作用的分子机制需进一步研究。研究报道ELK1作为转录因子,通过激活有丝分裂原激活的蛋白激酶(MAPK)/细胞外信号调节激酶(ERK)途径而被磷酸化并转移到细胞核,从而导致包括原癌基因c-fos下游靶点的调控发挥生物学功能[16]。WANG等[17]发现在肾透明细胞癌中ELK1可以调节NDUFA4L2的表达,参与细胞生长和死亡过程,而NDUFA4L2可能与PI3K/Akt发挥相互作用。PI3K/Akt激活可促进肿瘤的恶性增殖,由于其密切参与多种肿瘤的各种恶性生物学行为[18-19],PI3K/Akt可作为抗肿瘤治疗的分子靶点,PI3K/Akt信号通路抑制剂已经在抑制肿瘤的进展中取得了一定的疗效[20]。研究报道在骨肉瘤中PI3K/Akt信号通路也处于异常激活状态,PI3K/Akt信号通路关键蛋白PI3K和Akt发生磷酸化,促进或抑制其下游通路分子的表达,以促进肿瘤的发生、发展[21-22]。本文采用Western blotting检测ELK1的表达对骨肉瘤细胞中PI3K/Akt信号通路的影响,结果发现干扰ELK1的表达后,骨肉瘤细胞中PI3K/Akt信号通路关键蛋白pPI3K和pAkt蛋白表达降低,表明ELK1可能通过调控PI3K/Akt促进骨肉瘤细胞增殖。并进一步采用PI3K/Akt信号通路激活剂SC79进行功能回复实验,结果显示SC79恢复si-ELK1组部分增殖能力,表明ELK1通过激活PI3K/Akt信号通路促进骨肉瘤细胞的增殖。
综上所述,ELK1在骨肉瘤细胞中高表达,通过激活PI3K/Akt信号通路促进骨肉瘤细胞增殖的能力,ELK1可作为治疗骨肉瘤的潜在靶点。
