壬二酸对阿霉素诱导的心肌细胞损伤的保护作用及其机制
2022-06-24高远真原阳叶婷李梦娇张钰坤邢东明
高远真 原阳 叶婷, 李梦娇, 张钰坤, 邢东明,3
(1 青岛大学基础医学院,山东 青岛 266071; 2 青岛大学附属医院肿瘤研究所,青岛肿瘤研究院; 3 清华大学生命科学学院)
目前,包括阿霉素(DOX)在内的蒽环类化疗药物是乳腺癌、骨肉瘤、淋巴瘤等肿瘤的最为有效的化疗药物[1],由于其不良反应如不可逆的急性或慢性心脏毒性发生率较高[2-3],限制了其临床应用[4],因此,寻找一种安全有效的药物以治疗DOX心脏毒性具有重要临床意义。壬二酸(AzA)广泛存在于小麦、黑麦以及高粱等谷物中[5],具有抗炎、抗氧化以及抗肿瘤等药理作用[6-8],被美国食品和药物管理局(FDA)批准用于皮肤疾病治疗,具有较好的安全性和有效性[9]。研究显示,AzA可保护高脂饮食诱导的C57BL/6J小鼠心脏功能损伤[10]。然而,目前尚未有AzA对DOX所致心肌损伤是否有保护作用的相关研究报道。基于此,本研究通过建立体内外DOX损伤模型,探讨AzA对DOX诱导的心肌细胞损伤的保护作用及其机制,为AzA治疗DOX所致心脏毒性提供实验依据。
1 材料和方法
1.1 材料和设备
H9c2大鼠心肌细胞株购自武汉普诺赛生命科技有限公司。SPF级8周龄雌性C57BL/6J小鼠购自济南朋悦实验动物繁育有限公司。AzA购买于西安恩肽元生物科技有限公司;DOX购买于湖北威得利化学科技有限公司;CCK-8试剂盒、DCEF-DA探针购买于大连美仑生物技术有限公司;乳酸脱氢酶(LDH)检测试剂盒、线粒体膜电位(ΔΨm)检测试剂盒购买于北京索莱宝公司;三磷酸腺苷(ATP)检测试剂盒购买于上海碧云天生物技术有限公司;B淋巴细胞瘤-2基因相关启动子(Bad)、泛素结合蛋白(P62)、微管相关蛋白轻链3(LC3)抗体购买于武汉ABclonal公司。Bcl-2/腺病毒E1B相互作用蛋白3(BNIP3)抗体购买于美国Santa Cruz公司。
1.2 研究方法
1.2.1H9c2心肌细胞的复苏及培养 将冻存的H9c2心肌细胞于37 ℃水浴中解冻并迅速复苏后,与4 mL完全培养基(含体积分数为0.10的胎牛血清、体积分数为0.01青链霉素双抗的高糖DMEM培养基)混合,1 000 r/min 离心5 min后,取5 mL细胞悬液移入细胞培养瓶,置于37 ℃,含体积分数为0.05 CO2培养箱中培养。待细胞融合度约达到80%时进行后续实验。
1.2.2CCK-8法检测细胞活力 取细胞融合度达到80%的H9c2细胞胰酶消化后接种于96孔板中,每孔2 000个细胞,待细胞融合度再次达到80%后,分别加入浓度为0、1、2、5、10、20 μmol/L的DOX,每种浓度设置6个复孔,处理24 h后,每孔中加入CCK-8溶液10 μL,继续培养3 h,采用酶标仪测定波长450 nm处的吸光度,并计算细胞存活率,确定DOX的后续实验浓度。取细胞融合度达到80%的H9c2细胞胰酶消化后接种于96孔板中,每孔2 000个细胞,待细胞融合度再次达到80%后,分别加入10、20、30、40 μmol/L AzA与5 μmol/L DOX的混合溶液,每组设置6个复孔,处理24 h后,每孔中加入CCK-8溶液10 μL,继续培养3 h。采用酶标仪测定波长450 nm处的吸光度,并计算细胞存活率,确定AzA的后续实验浓度。
1.2.3H9c2心肌细胞的分组与处理 取细胞融合度达到80%的细胞胰酶消化后接种于6孔板或共聚焦皿中,待细胞融合度再次达到80%时分为正常组、模型组和AzA组,正常组以高糖DMEM培养基培养24 h,模型组以5 μmol/L DOX处理24 h,AzA 组以10 μmol/L AzA和5 μmol/L DOX共处理24 h。
1.2.4H9c2心肌细胞各项指标的检测 取处理24 h后的3组细胞上清液,按照LDH检测试剂盒说明书进行操作,采用酶标仪于波长450 nm处检测各孔吸光度值,根据公式计算各组H9c2心肌细胞LDH漏出量。按照ATP试剂盒说明书操作,检测各组细胞内ATP含量。取处理24 h后的3组细胞,加入含10 μmol/L DCFH-DA探针的无血清高糖培养基,37 ℃下暗室培养30 min,荧光显微镜下观察各组荧光强度,采用Image J软件处理DCFH-DA绿色荧光强度,分析3组细胞活性氧(ROS)的水平。按照线粒体膜电位检测试剂盒说明书装载JC-1荧光探针,激光共聚焦显微镜下拍照并观察红、绿荧光,使用Image J软件分析和处理荧光图像。取处理24 h后的3组细胞,按照文献[11]中的操作步骤,对细胞进行包埋、切片、染色,透射电子显微镜下观察分析3组细胞中的自噬体存在情况。从细胞培养箱中取出共聚焦皿,按照文献[12]中的操作步骤,依次对细胞进行固定、透膜、封闭、一抗二抗孵育、染色,防淬灭封片剂封片,4 ℃下避光保存,置于激光共聚焦显微镜下观察拍照,采用Image J软件处理图片,分析3组细胞中BNIP3与Mitotrac-ker共定位情况。上述实验均重复3次,结果取3次实验的均值。
1.2.5Western blot实验检测H9c2心肌细胞中微管相关蛋白轻链3-Ⅰ(LC3-Ⅰ)、微管相关蛋白轻链3-Ⅱ(LC3-Ⅱ)、P62、Bad、BNIP3蛋白表达水平 取处理24 h后的3组细胞,收集并裂解细胞,通过BCA法检测蛋白浓度。取20 μg蛋白上样,置于150 g/L的十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)中进行电泳以分离蛋白,之后将分离的蛋白转移到PVDF膜上,以含50 g/L脱脂奶粉的TBST室温封闭1~2 h,分别加入LC3B、P62、Bad、BNIP3一抗(前两组蛋白浓度为1∶1 000,后两组蛋白浓度为1∶400),4 ℃水平摇床孵育过夜。次日以TBST洗涤PVDF膜3次,每次10 min。二抗(1∶10 000)用含50 g/L脱脂奶粉的TBST稀释,室温孵育1 h。TBST洗涤3次,每次10 min。以凝胶成像仪显影,采用Image J软件分析蛋白条带灰度值。实验重复3次,结果取均值。
1.3 小鼠的处理和相关指标检测
1.3.1小鼠的分组和处理C57BL/6J小鼠随机分为正常组、模型组和AzA组,每组8只小鼠。模型组和AzA组小鼠仅在第1天腹腔注射10 mg/kg的DOX,AzA组同时灌胃20 mg/kg的AzA,每日1次,连续7 d;正常组小鼠灌胃等体积生理盐水,每日1次,连续7 d。
1.3.2小鼠心脏功能检测和心脏组织Masson染色各组小鼠于实验完成后第2天,使用含体积分数0.015异氟烷进行麻醉,采用飞依诺科研专用彩超仪V6测试小鼠心脏射血分数(EF%)和左室短轴缩短率(FS%)。心超检查结束后,各组小鼠再分别注射10 g/L戊巴比妥钠10 μL/g麻醉小鼠,提取心脏组织,以40 g/L多聚甲醛溶液固定24 h,石蜡切片脱蜡,按照Masson染色试剂说明进行操作,Regaud苏木精染液、Masson丽春红酸性复红液依次染色,浸洗、脱水、封固后,置于奥林巴斯荧光倒置显微镜下拍照观察。
1.4 统计学处理

2 结 果
2.1 AzA和DOX实验浓度的确定
H9c2心肌细胞经过0、1、2、5、10、20 μmol/L的DOX溶液处理24 h以后,细胞的存活率分别为(100.00±9.09)%、(56.19±7.29)%、(47.45±6.32)%、(30.81±12.21)%、(18.92±11.40)%、(10.35±2.61)%。随着DOX浓度的增加,细胞活力显著下降,差异具有统计学意义(F=81.568,P<0.05)。根据本实验结果,同时参考相关文献[13],确定本研究DOX的浓度为5 μmol/L。H9c2心肌细胞经过10、20、30、40 μmol/L的AzA与5 μmol/L DOX混合溶液处理24 h后,细胞存活率分别为(89.34±14.47)%、(53.47±4.96)%、(40.82±5.40)%、(32.45±7.87)%,各组间比较差异有统计学意义(F=60.985,P<0.05),其中经过10 μmol/L AzA和5 μmol/L DOX混合溶液处理的细胞存活率最高,依据该结果确定的后续实验的AzA浓度为10 μmol/L。
2.2 AzA对DOX诱导的H9c2细胞中各项指标的影响
单因素方差分析显示,各组H9c2细胞中ROS水平、LDH漏出量、ATP水平、ΔΨm、LC3-Ⅱ/LC3-Ⅰ比值以及Bad、BNIP3、P62蛋白表达水平比较,差异均有显著性(F=10.472~151.501,P<0.05),两组细胞的LDH漏出量、ROS水平、ATP含量、ΔΨm、自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ比值及Bad、BNIP3、P62蛋白表达水平与模型组细胞比较,差异均具有显著性(t=2.54~17.37,P<0.05)。见表1。透射电镜下观察结果显示,模型组的细胞存在大量的自噬体,而在正常组、AzA组的细胞中存在少量的自噬体(图1)。

表1 三组H9c2细胞各项指标的比较
2.3 AzA对DOX诱导的细胞中BNIP3与Mitotracker共定位的影响
结果显示,正常组、模型组、AzA组细胞BNIP3与Mitotracker的Pearson系数分别为0.19±0.05、0.53±0.04、0.41±0.06,各组间比较差异具有显著性(F=61.642,P<0.05),模型组、AzA组细胞BNIP3与Mitotracker的Pearson系数与模型组细胞比较,差异均具有显著意义(t=11.00、4.00,P<0.05)。
2.4 AzA对DOX损伤小鼠心脏收缩功能的影响
心脏超声检测结果显示,正常组、模型组、AzA组小鼠EF%分别为84.22±2.94、43.37±6.83、74.03±11.09,FS%分别为48.68±4.71、18.57±3.60、39.07±11.29,3组小鼠EF%、FS%比较差异具有显著性(F=22.815、13.078,P<0.05),进一步两两比较,正常组、壬二酸组小鼠与模型组小鼠比较,EF%、FS%差异均具有显著性(t=3.41~6.49,P<0.05)。
2.5 AzA对小鼠心肌组织纤维化的影响
模型组小鼠与正常组比较,心肌纤维排列紊乱、心肌间质胶原纤维明显增加,而AzA组小鼠与模型组比较,心肌纤维排列紊乱明显改善,心肌间质胶原纤维明显减少(图2)。

上排放大倍数8 000倍,右下角bar代表1 μm,下排为上排部分区域的局部放大(20 000倍),右下角bar代表500 nm,黑色箭头所指为自噬体
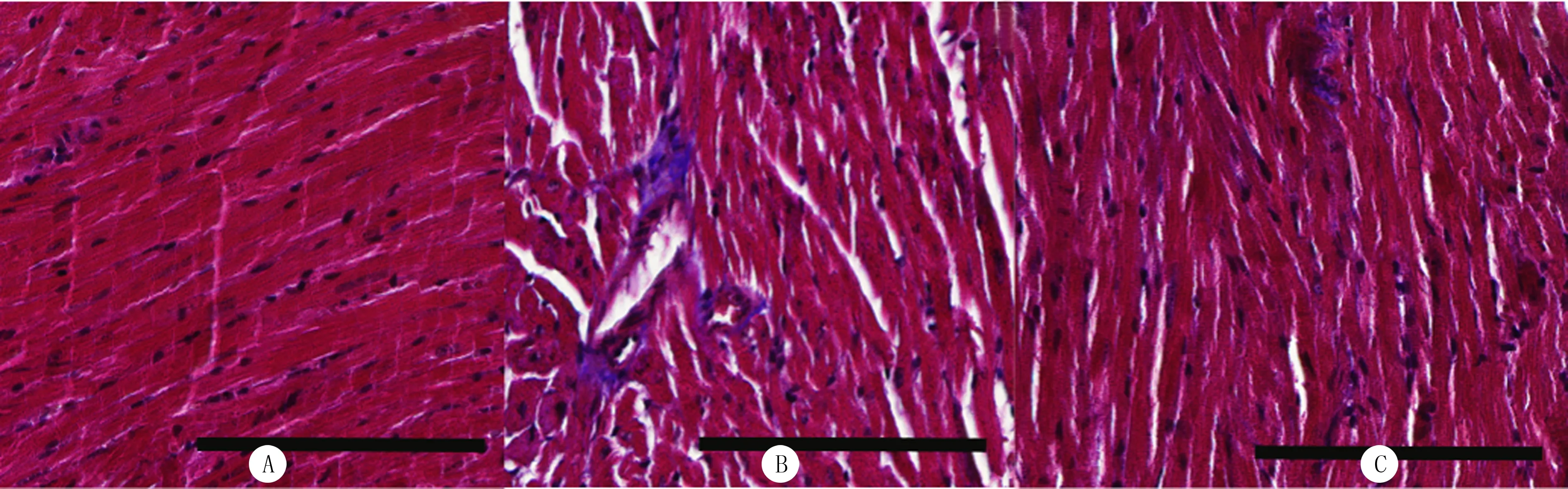
图2 各组小鼠心肌组织纤维化情况比较(200倍)
3 讨 论
DOX导致的心肌损伤机制并不明确,是目前研究热点之一。既往研究表明机体产生的过量ROS所致氧化应激反应是DOX诱发心肌损伤的原因之一[14-15]。线粒体是产生ROS的主要细胞器,也是真核细胞生物ATP产生的主要场所,心肌组织能量代谢活跃,线粒体富集,过量ROS产生及细胞能量代谢紊乱导致线粒体受损或功能障碍,进而激活线粒体自噬的发生[16]。线粒体内膜上存在大量的心磷脂,而DOX对其具有很高的亲和力,可与其形成药物-脂质复合物,导致ΔΨm降低,从而抑制电子传递链中氧化磷酸化反应的进行,产生更多的ROS[17]。研究显示线粒体自噬可能是DOX诱导心肌损伤的重要机制[18]。
含有LC3相互作用基序(LIR)的BNIP3蛋白属于Bcl-2家族,其作用包括促进线粒体分裂但抑制其融合,同时可促进LC3的表达,独立影响线粒体自噬,调节线粒体更新及细胞凋亡途径,参与细胞内线粒体自噬以及细胞死亡过程[19]。研究表明在DOX诱导的心肌毒性模型中,BNIP3通过向线粒体转移,促进了细胞的通透性和去极化,进而启动线粒体自噬[20]。自噬开始后,自噬相关蛋白LC3-Ⅰ向LC3-Ⅱ转化,即LC3-Ⅰ蛋白含量减少,LC3-Ⅱ蛋白含量增加[21]。因此,LC3-Ⅱ/LC3-Ⅰ比值的变化可间接判断细胞自噬变化趋势。P62蛋白与自噬效应蛋白LC3相互作用,并可作为底物通过自噬-溶酶体途径被降解[22]。因此,P62蛋白含量的增加提示自噬流被阻断。
本研究通过建立DOX诱导的体内外损伤模型,探讨了AzA对DOX所致心肌损伤的保护作用。早期研究发现,安体舒通和依普利酮可通过改善EF%和FS%,减少心肌组织纤维化降低DOX诱导的心肌毒性[23-24]。本研究在心肌超微结构上发现模型组心肌细胞的细胞质发生破裂,心肌纤维排列出现紊乱,蓝色胶原纤维增加,表明DOX可引起心肌纤维化,而AzA组H9c2心肌细胞较模型组更完整,心肌纤维排列整齐有序,蓝色胶原纤维减少,提示AzA可以改善DOX诱导的心肌纤维化。此外,模型组小鼠与正常组相比较,心脏功能收缩性指标(EF%、FS%)出现显著差异,心脏收缩功能明显下降,提示经AzA治疗后改善了小鼠心脏收缩功能。H9c2心肌细胞暴露于DOX 24 h以后,细胞活力明显下降,细胞培养的上清液中LDH含量及细胞内ROS水平均明显升高。心肌细胞膜受损或破裂可释放LDH,从而造成细胞外LDH含量的增加。因此细胞外LDH含量能够在一定水平上反映出心肌细胞损伤程度。ROS水平升高,可进一步导致线粒体膜通透性增加,引起ΔΨm降低,加重线粒体损伤,同时受损严重的线粒体又可释放更多的ROS到细胞中,最终导致了线粒体自噬以及细胞凋亡的发生[25]。本研究中CCK-8实验结果显示AzA浓度为10 μmol/L时可显著提高DOX诱导的H9c2心肌细胞活力,提示高浓度AzA时对细胞不再具有保护作用。先前也有研究显示,高浓度AzA因干扰线粒体氧化还原酶的功能而产生细胞毒性,从而失去对细胞的保护作用[26],因此根据本研究和相关研究的结果,本研究最后确定后续实验中AzA的浓度为10 μmol/L。本研究结果显示,AzA可以显著抑制DOX诱导的H9c2心肌细胞活力的下降,并显著抑制DOX所致细胞LDH漏出量和细胞内ROS水平的增加,提示AzA具有保护H9c2心肌细胞免受DOX所致心肌毒性作用。线粒体途径凋亡蛋白Bad表达水平增加与线粒体自噬过度激活有关,而线粒体自噬过度激活可加重DOX诱导的H9c2心肌细胞损害,进而促进心肌细胞凋亡。为了研究AzA保护DOX诱导的H9c2心肌细胞是否与调控线粒体自噬减轻细胞凋亡有关,本研究检测了H9c2心肌细胞内ATP水平、ΔΨm变化、凋亡相关蛋白Bad及自噬相关蛋白LC3-Ⅰ、LC3-Ⅱ、P62蛋白表达水平,结果显示DOX降低了心肌细胞中ATP含量、ΔΨm和P62蛋白表达水平,升高了自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ比值。而AzA有升高DOX损伤心肌细胞内ATP含量、升高ΔΨm、降低Bad蛋白表达、升高P62蛋白表达水平的作用。推测AzA是通过抑制线粒体自噬从而发挥保护DOX诱导的H9c2心肌细胞作用的。本研究对AzA是否调控BNIP3介导的线粒体自噬进行了进一步的探讨,Western blot检测结果显示,模型组BNIP3蛋白表达水平较正常组显著升高,说明可能与BNIP3介导的线粒体自噬有关;与模型组比较,AzA组BNIP3蛋白表达显著降低,推测AzA保护DOX致H9c2心肌细胞损伤的机制,可能是通过抑制BNIP3介导的线粒体自噬参与的。
综上所述,AzA通过抑制BNIP3介导的线粒体自噬、抑制H9c2心肌细胞凋亡、增强细胞活力、减轻心肌纤维化,最终改善心功能以抵抗DOX心肌毒性。
