辣椒枯萎病拮抗木霉菌的筛选及鉴定
2022-06-24章行远吴奇飞卯婷婷金义兰张昌容班菲雪刘少兰
章行远,吴奇飞,卯婷婷*,金义兰,张昌容,班菲雪,刘少兰,乔 飞
(1.贵州省植物保护研究所,贵州 贵阳 550006;2.安顺学院,贵州 安顺 561000)
0 引言
【研究意义】辣椒自15世纪随哥伦布环球航行被传出美洲后[1],中国在明朝时期引入并作为观赏植物种植。目前中国辣椒种植面积居全球前列,产量位居全球第一[2]。但随着种植面积扩大,提升经济效益的同时,辣椒病害的发生日益严重,枯萎病是辣椒常见病害之一,发病率一般为15%~30%[3];长期连作破坏了农田生态系统稳定,导致该病发生率更高。目前对辣椒枯萎病的防控措施主要为化学防治,虽有高效、使用简便、成本低廉等优点,但增加了农药残留、降低土壤微生物多样性,并导致土壤硬化、病原菌耐药性增强等问题。随着消费者对有机食品需求的日益提高,以及生物技术的发展,挖掘可利用的生防资源防治辣椒枯萎病具有重要意义。【前人研究进展】辣椒枯萎病致病菌为尖孢镰刀菌萎蔫专化型〔FusariumoxysporumSchl.f.sp.vasinfectum(Atk)Snyder & Hansen〕,17~37℃均可发生,最适生长温度为24~28℃,潮湿环境有利于病原菌传播蔓延;病原菌菌丝体和繁殖体厚垣孢子随病残体在土壤的表土层越冬,且可存活6~8年;通过风、水等流体传播;病原菌从根部薄弱部位侵染辣椒,产生有毒物质破坏代谢功能并堵塞导管,导致侧根腐烂,降低植株支撑能力,并使叶片丧失生理功能直至植株死亡;植株染病后平均2周死亡[4-5]。许多生防菌对辣椒枯萎病病原菌有抑制作用,刘云龙等[6]研究发现,施用哈茨木霉菌和某些解磷菌可以抑制辣椒疫病和枯萎病的发生并促使作物提前8 d开花,产量提高15%。THANGAVELU等[7-8]研究表明,枯草芽孢杆菌、木霉菌和荧光假单孢菌按照一定比例混配对辣椒枯萎病的病原菌有强抑制作用,并可提高植株体内POX酶、几丁质酶活性和酚类物质含量,在施用6 d后达最大值,从而提高植株抗病性。王文斌等[9]研究发现,万寿菊根部物质对辣椒枯萎病菌菌丝生长有显著抑制作用,抑菌效果随提取物浓度降低而减弱,50 mg/mL无菌水提取物48 h内抑菌率达100%;万寿菊根部提取物可显著提高辣椒幼苗的CAT、SOD和POD活性,增强植株抗病性。张俊庆等[3,10]成功分离到对辣椒枯萎病病原菌有较强拮抗作用的枯草芽孢杆菌、解淀粉芽孢杆菌、萎缩芽孢杆菌和哈茨木霉菌株。【研究切入点】国内外报道用于防治辣椒枯萎病的生防资源相对较少,在贵州鲜见利用生防菌防治辣椒枯萎病的报道。【拟解决的关键问题】采用平板稀释法分离辣椒连作区域内植株根际土壤微生物,再采用平板对峙法筛选对辣椒枯萎病有拮抗效果的生防菌,最后利用菌落直径测量法结合形态学和分子生物学方法鉴定拮抗菌发酵液抑菌活性及拮抗菌株种类,以期为绿色防控辣椒枯萎病提供有效的生防资源。
1 材料与方法
1.1 材料
1.1.1 土壤 供试土壤为辣椒根际土壤,采自贵州省贵阳市花溪区(北纬26°30′40″,东经106°39′44″,海拔1 174 m,丘陵地形,旱地黄壤土,四季降雨,年均降雨量1 130 mL)辣椒连作区。
1.1.2 病原菌 供试病原菌为尖孢镰刀菌辣椒枯萎病致病专化型,菌株由贵州省植物保护研究所生物防治研究室分离保藏。
1.1.3 培养基 马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g,葡萄糖20 g,琼脂粉18.5 g,纯水1 000 mL;为了更高地分离土壤真菌,在PDA培养基中额外加入0.05 g链霉素和0.25 g氯霉素[11]。木霉选择性培养基:五氯硝基苯0.3 g,葡萄糖3.0 g,MgSO40.2 g,KH2PO40.9 g,NH4NO31.0 g,KCl 0.15 g,玫瑰红0.15 g,琼脂18 g,氯霉素0.25 g,链霉素0.05 g以及1 000 mL蒸馏水[12]。PD液体培养基:蒸馏水1 000 mL,葡萄糖20 g,土豆200 g,自然pH[13]。
1.2 方法
1.2.1 辣椒根际土壤微生物分离纯化 于辣椒苗期、花期、果实采摘前和果实采摘后4个阶段,采用5点取样法采集辣椒种植区域距土表10~15 cm的根际土壤并混匀,每个时期各采集土样3份,记录采集时间、辣椒生长状态和采集量等。将无菌水和采集的土样按照10∶1比例稀释后,在摇床上以150 r/min的速度振荡20 min制备土壤初悬浮液,采用梯度稀释法,逐级制备浓度为1×10-1CFU/mL、1×10-2CFU/mL、1×10-3CFU/mL和1×10-4CFU/mL的土壤悬浮液[14-15]。在PDA培养基上均匀涂布100 μL土壤悬浮液,每个浓度3次重复。置于28℃恒温培养箱,培养3 d后观察记录真菌菌落数量,并挑选生长单一完整的菌落,利用木霉选择性培养基分离纯化得到木霉菌,并保存。
1.2.2 平板对峙法初筛 以尖孢镰刀菌病原菌为靶标病原菌,分离得到的木霉菌株为待测菌。在PDA培养基的两侧分别接种直径5 mm的病原菌和待测菌菌饼,参照樊炳君等[16]的方法,28℃培养6 d后观察菌落生长情况,有明显抑制病原菌生长的待测菌标定为拮抗菌,并测量菌落直径,计算抑菌率,获得辣椒枯萎病拮抗菌株并保存。
1.2.3 拮抗菌发酵液抑菌活性试验 将拮抗菌株的菌块接种于PD液体培养基中,26℃ 150 r/min培养4 d,取10 mL培养液于7 500 r/min离心10 min。上清液过0.45 μm过滤器去除菌体,获得含有拮抗菌次生代谢产物的发酵液,与PDA按1∶10混匀配制培养基。未添加菌株发酵液的培养基为空白对照,接种尖孢镰刀菌菌块,26℃培养7 d,测量尖孢镰刀菌菌落直径,计算抑菌率。
抑菌率=[(空白对照菌落直径-处理组菌落直径)/空白对照菌落直径]×100%
1.2.4 拮抗菌株鉴定 形态学方法鉴定:选取有抑菌效果的菌株,在PDA上26℃培养7 d后,观察记录菌落形态及颜色,刮取菌丝及孢子,以蒸馏水作为悬浮剂制片,在显微镜下观察菌丝、产孢结构和孢子形态,并测量孢子大小[17]。
分子系统学鉴定:拮抗菌接种于铺满无菌玻璃纸的PDA培养基上,待菌丝生长铺满整个培养皿后,收集菌丝体、在液氮中研磨至粉末状,提取DNA;采用ITS1、ITS4和TEF1-728F、TEF1-rev引物分别扩增ITS和TEF基因,ITS引物的反应体系参照卯婷婷等[13]的方法,采用25 μL反应体系:DNA模板1 μL,上下游通用引物ITS1和ITS4各1 μL,2×EsTaqMaster Mix 12.5 μL,无菌水9.5 μL;TEF引物的反应体系同为25 μL反应体系:DNA模板1 μL,上下游通用引物TEF各1 μL,2×EsTaqMaster Mix 12.5 μL,无菌水9.5 μL。PCR扩增反应条件:94℃预变性5 min;94℃变性30 s、55℃退火30 s、72℃延伸1 min,34次循环;72℃延伸10 min。扩增产物经1.5%琼脂糖凝胶电泳检测后,送生工生物工程(上海)股份有限公司测序。在GeneBank中下载拮抗菌株近缘种的ITS和TEF序列,采用ClustalW对齐后拼接,在MEGA 11中用Maximum Likelihood方法构建系统发育树,采用bootstrap自举检验1 000次。根据形态学和分子系统发育树确定拮抗菌株的分类地位。
2 结果与分析
2.1 辣椒根际土壤微生物分离
从表1看出,利用PDA培养基从采集的12份有效土样中共分离纯化得到真菌50株,其中,从苗期土样中分离到LJ060209、LJ060210和LJ060201等共22株菌株,从开花期土样中分离到LJ07160601、LJ07160843和LJ07160121等共16株菌株,从果实采摘前土样中分离到LJ08072、LJ08074和LJ080726等共9株菌株,从果实采摘后土样中分离到LJ09240301、LJ09240303和LJ09240304共3株菌株,分别占总分离菌株的44%、32%、18%和6%。

表1 辣椒根际土壤分离获得的真菌菌株
2.2 分离菌株的抑菌效果
从表2看出,菌株LJ06020803、LJ060204、LJ060205、LJ060211和LJ09240304共5株菌株对辣椒枯萎病病原菌有显著抑制作用,各处理病原菌菌落直径为10.83~19.50 mm,表现为LJ06020803
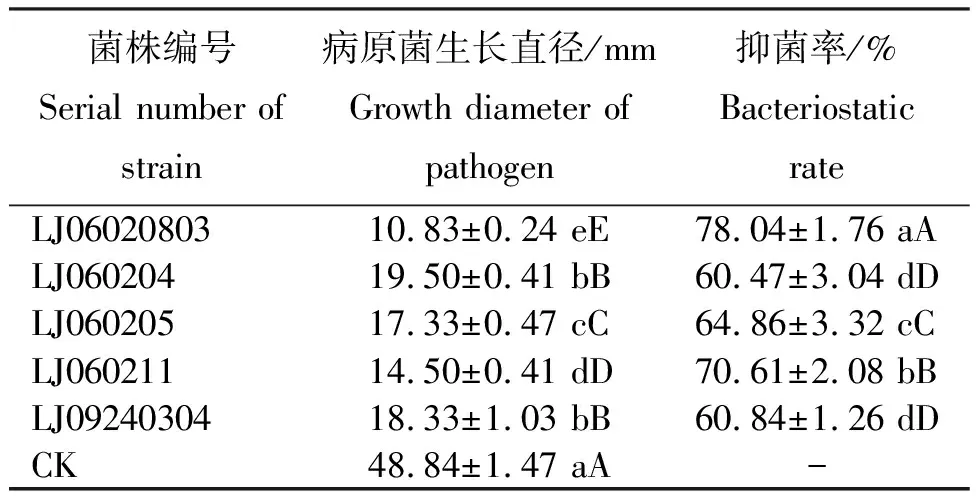
表2 拮抗菌株对辣椒枯萎病病原菌的抑菌效果
2.3 发酵液的抑菌活性
从封二图Ⅱ看出,LJ06020803菌株无菌体发酵液对辣椒枯萎病病原菌有一定的抑制作用,在含LJ06020803菌株无菌体发酵液的PDA培养基上培养4 d后,辣椒枯萎病病原菌的菌落直径为33.5 mm,空白对照的菌落直径为56.7 mm,抑菌率为40.92%。
2.4 菌株鉴定
2.4.1 形态学 从封二图Ⅲ看出,菌株LJ06020803在木霉选择性培养基上生长7 d长满培养皿,易产孢,浅绿色。在PDA培养基上培养72 h后,菌落直径为90 mm,菌丝白色,产孢稀少;培养至7 d后,菌落正面黄绿色至草绿色,产孢区聚集状;菌丝无色,分生孢子梗无色,简单分枝, 初级分枝近似直角,瓶梗轮枝状,大小为(4.5~7.5)μm×(2.0~3.0)μm;分生孢子卵圆形至椭圆形,大小为(2.0~3.0)μm×(2.5~3.5)μm,浅榄黄色至浅草绿色。与GAMS等[14]描述的哈茨木霉(T.harzianum)的形态一致。
2.4.2 分子生物学 通过PCR扩增,获得菌株LJ06020803的ITS和TEF基因序列,长度约550 bp。从图1看出,在由ITS序列和TEF序列共同构建的系统发育树中,菌株LJ06020803的近缘种均以二分支树的形式聚集在一起,菌株LJ06020803与哈茨木霉(T.harzianum)处于同一分支,自举支持率(MPBS)100。与非洲哈茨木霉(T.afroharziaum)形成姊妹支,自举支持率为(MPBS)80%。结合形态特征及分子系统学特征,确定菌株LJ06020803为哈茨木霉菌(T.harzianum)。
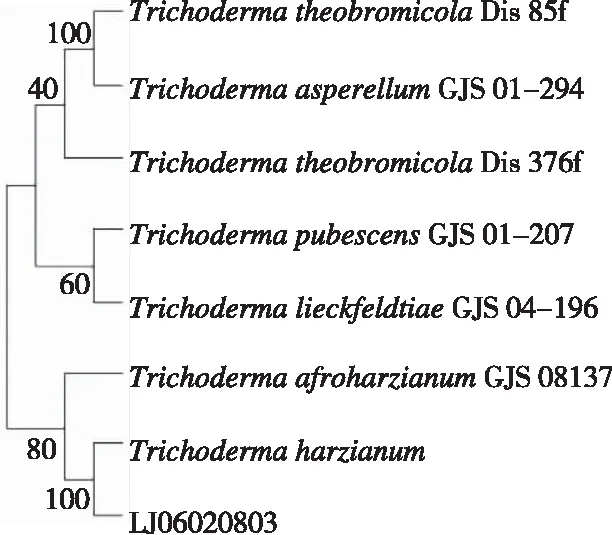
图1 基于菌株LJ06020803的ITS和TEF序列构建的系统发育树
3 讨论
筛选自然界中抑菌微生物作为农作物病害的绿色防控生防资源是近年来的研究热点,也是今后绿色农业的发展方向。已有研究表明,多粘类芽孢杆菌(Paenibacilluspolymyxa)对于小麦赤霉病、黄瓜霜霉病、辣椒疫霉病、白菜茎腐病和番茄根结线虫等均有较好的防治效果[18-22];木霉菌(Trichodermaspp.)施用后,通过产生木聚糖、低聚糖、内肽化合物等小分子量化合物诱导植物产生防御反应[23-25],同时具有一定促进作物增产的效果[26],目前被广泛用于防治西瓜枯萎病和烟草黑胫病等多种病害[27-28]。前人专门针对中国西南地区由连作导致的辣椒病害的生防研究相对较少,且大多采用单次采样的方法收集土壤。研究选取年降雨量约1 000 mL的贵州丘陵地带旱地辣椒连作区域的土壤,在辣椒不同生阶段长期调查其根系土壤微生物,多次采集土样,按照常规拮抗微生物分离和筛选方法,以区域常见病害辣椒枯萎病的病原菌作为靶标菌,应用PDA、木霉选择性培养基、PD液体培养基,通过平板对峙法筛选出对辣椒枯萎病病原菌尖孢镰刀菌有较好抑制效果的菌株LJ06020803;形态学特征鉴定发现,菌株LJ06020803的培养形状及形态学特征与GAMS等[14]描述的哈茨木霉(T.harzianum)一致;分子生物学鉴定其与哈茨木霉(T.harzianum)处于同一分支,自举支持率为100%。结合形态学和分子生物学鉴定结果,确定菌株LJ06020803为哈茨木霉菌(Trichodermaharzianum)。研究还发现,在对峙培养中菌株LJ06020803对尖孢镰刀菌具有显著的抑制作用,抑制率为78.04%,菌株LJ06020803的无菌体发酵液对尖孢镰刀菌的抑菌率为40.92%,具有拮抗作用。同时也说明,该菌株可产生有抑菌活性的次级代谢产物,但目前该代谢产物种类及抑菌机理尚不明确,后期将进一步深入研究,明确抑菌机理,并开发其大田应用技术。
4 结论
贵州辣椒连作地的根际土壤中有较多的木霉菌,试验共获得5株对尖孢镰刀菌具有较好拮抗作用的木霉菌株(Trichodermaspp.),其中,菌株LJ06020803的对峙培养抑制率最高,为78.04%,其不含菌体的发酵液抑菌率为40.92%。通过形态学和分子生物学方法鉴定,菌株LJ06020803为哈茨木霉菌(Trichodermaharzianum)。该菌株对尖孢镰刀菌具有较好的抑制作用,可作为生防菌资源开发防治辣椒枯萎病的生防制剂。
