活化过碳酸盐及过氧碳酸氢盐在水处理领域中的研究进展
2022-06-24廖兵胥雯叶秋月
廖兵,胥雯,叶秋月
(1成都理工大学地质灾害防治与地质环境保护国家重点实验室,四川 成都 610059;2成都理工大学生态环境学院,四川 成都 610059;3成都理工大学国家环境保护水土污染协同控制与联合修复重点实验室,四川 成都 610059)
随着社会经济快速发展以及人类的大规模生产活动,各类工业、农业废水未经有效处理,可循环使用率低,排放量增大,导致水环境污染日益严重。水中残留的部分有机物难以被生物降解,对人类的生存环境产生较大危害。高级氧化技术常被用于处理生物难降解有机污染物,主要包括臭氧催化体系、Fenton 体系、类Fenton 体系、光催化体系、过硫酸盐体系以及过碳酸盐体系等。Fenton体系对环境的pH 条件要求严格,同时还存在运行成本高以及易产生二次污染的特点,因此在应用过程中存在一定的局限性。而活化过碳酸盐(SPC)作为类Fenton 试剂,适用的pH 范围广泛,且易于储存、运输和处理,越来越多的学者开始将其应用于高级氧化体系处理水体中难降解有机污染物。单一的SPC体系处理污染物时所需用量较大,主要是中间产物参与竞争过碳酸盐所致,为了进一步提高过碳酸盐的反应活性,目前已有多种方法用于活化过碳酸盐,如铁基材料、活性炭、光活化等,反应体系的影响因素包括溶液初始pH、活化剂投加量、SPC浓度、目标污染物的浓度以及水中共存无机离子和有机物等。过氧碳酸氢盐(PMC)的活化剂主要包括过渡金属离子以及金属复合材料,溶液初始pH、活化剂投加量、HO浓度、HCO浓度、活化剂浓度以及共存阴离子均会对目标污染物的降解产生影响。本综述系统总结了活化过碳酸盐体系和活化过氧碳酸氢盐在水处理领域的研究动态,梳理和回顾了目前活化SPC 以及活化PMC 在水处理中的应用研究进展,分析和总结了活化SPC体系和活化PMC 体系的反应机理,以期为其在水处理中的进一步应用提供一定的参考。
1 过碳酸盐与过氧碳酸氢盐
1.1 过碳酸盐体系
过碳酸钠俗称固体HO,在室温下较稳定,呈白色颗粒状粉末,主要是通过在流化床中碳酸钠和过氧化氢溶液的结晶获得。过碳酸钠作为HO和NaCO的加成化合物(理论含量为32.5%和67.5%),其化学式有两种表达形式,即NaCO·1.5HO和2NaCO·3HO,具有与液态过氧化氢相同的氧化作用。与传统高级氧化技术所用的氧化剂相比,SPC成本低廉、适用的温度范围及pH范围更广,同时也具有良好的水溶性,使用后不产生污染和异味,绿色环保。由于SPC对微生物不具有毒性,在溶于水后可分解为NaCO和HO,可表示为式(1),在这样的碱性条件下,HO可进一步分解为HO和O,如式(2)所示,产生的氧气可供好氧微生物使用,用于有机污染物的降解。因此,近年来以SPC为氧化剂的新型氧化体系逐渐被应用于水处理领域中。
1.2 过氧碳酸氢盐体系


2 活化过碳酸盐及过氧碳酸氢盐的方法
2.1 活化过碳酸盐
由于SPC溶于水可生成HO,因此可直接将其用于降解有机污染物,包括苯、三氯乙烯(TCE)、磺胺二甲嘧啶(SMT)等,但在单一的SPC 体系中,溶于水产生的HO很难分解生成活性物质,反应效率较低。添加活化剂后,系统中会产生一系列活性氧自由基(ROS),可快速降解目标污染物。
2.1.1 铁基材料活化SPC


(2)螯合剂-Fe由于在氧化反应过程中,Fe失去电子转化为Fe,会降低整个体系的活性,削弱Fe活化SPC 的能力,因此高剂量的Fe参加反应十分必要。为避免Fe(OH)沉淀析出,可在较宽的pH 范围内使用螯合剂提高Fe的利用效率,产生大量ROS。这是因为利用Fe活化SPC 产生HO与Fenton工艺的性质相似,而添加水溶液呈酸性的螯合剂会使体系的pH 降低,酸性条件下有利于维持体系中的Fe浓度,进一步通过式(4)产生·OH降解目标污染物。部分螯合剂已被证明是改良的Fenton工艺中降解污染物的有效试剂,如柠檬酸(CA/CIA)、乙二胺四乙酸(EDTA)、草酸(OA)、一水柠檬酸(CIT)、谷氨酸(GA)。螯合-Fe催化SPC体系在地下水应用中具有较好的应用前景,但在Fe/SPC中添加螯合剂时,应综合分析目标污染物和螯合剂的化学性质。
(3)nZVI 复合材料 nZVI 可活化SPC,由于存在易团聚、抗氧化性能较差等缺点,nZVI/SPC去除污染物降解率较低。为进一步改善nZVI 的缺点,常采用液相还原法将其改性制成负载型双金属材料,如沸石负载的铁铜双金属(Z-nZVI-Cu)、沸石负载的铁镍双金属(Z-nZVI-Ni)等,根据BET 分析结果发现,nZVI 复合材料的比表面积显著增加,且具有较好的降解效果。此外,有研究使用氧化石墨烯负载纳米零价铁材料(G-nZVI)活化过碳酸钠体系去除目标污染物。与nZVI 相比,纳米零价铁复合材料表现出更好的稳定性能,在水处理中具有良好的应用前景。
2.1.2 活化SPC的其他方法
(1)生物炭活化SPC 生物炭具有比表面积大、孔隙度高、吸附能力强的特点,因此被作为一种性能优良的吸附剂应用于各类工业水的处理。利用生物炭活化SPC时,不同热解温度对污染物的降解效果具有较大影响,反应过程中产生的HO·是导致目标污染物降解的主要活性自由基。
(2)光活化SPC 光活化法是一种将光能转化成化学能的技术,一般采用紫外光作为光源激发O或HO产生HO·,光助Fenton氧化法是一种处理难降解有机废水的有效方法,具有操作简便、降解速度快、效率高且矿化能力强的特点,是目前极具发展潜力和应用前景的高级氧化技术之一,与单独SPC、单独UV体系相比,目标污染物在UV/SPC体系中呈现更高的降解效率。在同等氧化剂浓度下,双酚A在UV/SPC和UV/HO的降解率相当。
(3)其他活化方式 除了以上提到的材料可活化SPC外,还可利用其他物质或复合体系对SPC氧化剂进行活化,包括FeO@ZIF-8材料、Vis/FeOCl以及以钒[V(Ⅳ)]为基础的活化方式。通过相关表征分析发现,复合材料一般具有较大的比表面积,利于污染物的扩散和转移。Li 等研究了V(Ⅳ)催化SPC 对苯胺的降解,验证了V(Ⅳ)对SPC的活化机理,在V(Ⅳ)/HO和V(Ⅳ)/HO/NaCO系统中评估了苯胺降解的性能,并与V(Ⅳ)/SPC 系统进行了比较,结果表明,V(Ⅳ)/SPC 可以有效分解苯胺,随着V(Ⅳ)和SPC 用量的增加,降解效率提高。
活化SPC降解有机物的相关研究如表1所示。

表1 不同活化剂活化SPC降解有机物
2.2 活化过氧碳酸氢盐
2.2.1 过渡金属离子
在PMC 体系中使用活化剂,可加速有机污染物的降解。研究者发现在对PMC 进行活化时,使用溶解的过渡金属离子Co(Ⅱ)和含钴的多相催化剂具有良好的效果。通过研究不同金属离子(Mn、Cu、Fe、Ag)替代Co对PMC 进行催化,发现Co具有更好的活化过氧碳酸氢盐的性能。将Co活化的PMC 系统与Fenton 试剂降解染料相比,Co活化的PMC 系统降解效果更好。此外,Mn和Cu也被用于活化PMC系统,与单独PMC体系相比,其对污染物的降解率更高。
2.2.2 金属复合体系
除了使用过渡金属离子外,也可使用复合材料对PMC进行活化。目前主要以Co、Cu、Mn为基础合成一系列用于活化PMC的复合材料。复合材料的优点主要体现在具有较低的氧化电位和更多的氧化还原活性位点。此外,过渡金属硫化物也被用于活化PMC。有研究合成了CuFeS、CuS和FeS三种材料活化PMC并进行了比较,发现CuFeS表现出可逆氧化还原性能,活化PMC降解2,4-二氯苯酚(2,4-DCP)的效果最佳。
活化PMC降解有机物的相关研究如表2所示。

表2 不同活化剂活化PMC降解有机物
2.3 过碳酸盐体系和过氧碳酸氢盐体系中活化剂的异同
金属离子和复合材料均可活化SPC 和PMC,主要的区别在于SPC 的活化剂包括Fe(Ⅱ)、Fe(Ⅲ)、螯合剂-Fe、nZVI 复合材料、生物炭、光、V(Ⅳ)以及含铁的复合材料等。但在活化PMC体系中,使用的过渡金属离子除Fe外,还包括Co、Mn、Cu、Ag等,常用的复合材料一般以Co、Cu、Mn为基础合成。
3 活化过碳酸盐及过氧碳酸氢盐在水处理中的影响因素
3.1 活化过碳酸盐的影响因素
3.1.1 溶液初始pH
(1)酸性条件 在高级氧化技术中,溶液初始pH是重要的影响因素,Fenton体系的适宜pH范围为2~4,在此范围内,体系能够拥有较好的氧化性能。当活化过碳酸盐体系溶液初始pH 较低时,目标污染物的降解率更高。特别是在使用Fe(Ⅱ)或螯合剂-Fe(Ⅱ)对SPC 进行活化的反应体系中得到了验证,这与Fenton反应类似,主要是因为不同的溶液pH条件会影响反应体系中Fe的存在形式,在较高的pH条件下,抑制了HO·的产生,促进铁的沉淀,二者均会对目标污染物的降解产生阻碍作用。Sajjadi 等将溶液的初始pH 分别设定2、3、5、7、9,随着pH从2增加到3,目标污染物MB的降解效率从61.4%增加到了98.5%,在pH 持续上升的情况下,降解率降低至50%以下。
在不同的初始pH条件下进行实验,终点pH也存在差异,Zang 等在初始pH=3.01 的条件下,TCE 的降解率在反应90min 后达到了93%,溶液最终pH 为2.85,这是由于TCE 氧化反应下会产生CO,然后产生H,从而导致pH的降低。虽然SPC在溶解过程中产生HO与水分子发生反应,会增加溶液中OH的量,但与TCE氧化过程中产生的H相比反应很慢。Lyu等发现,在CA-Fe(Ⅱ)/SPC/TCE体系中,初始pH=3.0系统的最终pH下降到了2.9,初始pH=3.8 系统的最终pH 降低至3.5,初始pH 分别为5.0、7.0 和9.0 的体系最终pH 上升到了6.2、8.6 和10.0,在反应过程中pH 条件的升高加速了Fe(OH)的沉淀,阻碍了反应系统中活性自由基的产生量,但加入水溶液呈酸性的CA 后,导致最终溶液pH 的变化趋势差异。有实验结果与此不同,HAH/CA/Fe(Ⅱ)/SPC/TCE 体系中,当初始溶液pH为3 和5.2 时,TCE 的去除率超过了99%,但这两种情况下的最终溶液pH都接近2.5,表明该体系中TCE 的去除具有pH 依赖性,在酸性条件下去除效率更高,符合Fenton反应过程的一般行为。
除了溶液本身pH 条件的影响外,添加的螯合剂的性质也会对反应体系产生影响,在Fe/SPC/PCE体系中分别加入不同性质的螯合剂,发现在同等摩尔浓度比例下,呈酸性的螯合剂会降低溶液的pH,提高Fe的活化性能,最终PCE 的降解率更高。
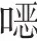
(3)中性条件 在部分活化SPC降解污染物的实验中,中性pH 条件下反而降解率更高,促进了将活化SPC应用于地下水原位修复的可能性。Miao等配制了pH 分别为3.0、4.5 和6.5 的溶液,初始pH 为6.5 的条件下,反应5min 后PCE 的降解率达到了98%,而pH 为3.0 和4.5 的条件下,PCE 的降解率为80.4%和53.5%,在近中性的pH 条件下,Fe/SPC 的氧化性能更佳。初始pH=6.5 和pH=4.5体系中的最终pH 分别降至3.44 和3.45,但pH=3.0体系最终pH 增加到3.15,类Fenton 反应和PCE 的降解使反应体系呈酸性,但SPC的溶解造成了碱性环境,导致最终pH的变化趋势不同。
Fenton反应对有机污染物的氧化降解通常在溶液pH 略低于3 时表现出较好的效果,但与传统高级氧化技术所用的氧化剂相比,SPC 在较宽的pH范围内对污染物的降解均有效,这可能与反应体系的性质有关。pH 梯度实验验证了这一结论,在使用Fe(Ⅱ)活化SPC去除目标污染物的实验中,该体系可在更宽的pH(3~10)内使用。V(Ⅳ)活化SPC 的研究也发现初始pH 对于目标污染物的降解没有显著影响。Li等研究了初始pH对质子化g-CN/SPC/Vis 体系去除MB 的影响,MB 降解的最适初始pH为7;在溶液初始pH为中性或弱碱性的条件下,MB 的降解率最大可达90%,当溶液的初始pH=3 时,MB 的降解率为70%,表明在较宽的pH 范围内,质子化g-CN/SPC/Vis 体系降解MB 都有较好的效果。
活化SPC降解污染物的初始pH及反应后pH如表3所示。

表3 不同活化剂活化SPC降解污染物的初始pH
3.1.2 SPC/活化剂/污染物浓度
SPC作为一种有效的氧化剂,其不同的浓度水平对目标污染物的降解率也会产生相应的影响。在较低的SPC浓度下,目标污染物的降解率较低,随着SPC浓度的增加,目标污染物的降解率随之显著升高,SPC浓度增加到达一定值后,目标污染物的降解率反而呈降低的趋势,这是由于在低浓度SPC体系下,反应系统产生的HO较少,增加SPC初始浓度可以增加体系内的HO产生量,在活化剂的作用下,体系内的HO可以生成更多HO·,用于目标污染物的降解。当SPC 增加到一定浓度后,系统中的HO·会发生两种反应[式(5)、式(6)]。当SPC添加量超过最适浓度时,水中大量的碳酸盐离子会与TCE竞争ROS,阻碍TCE的降解[式(7)]。

单独的SPC氧化体系对于有机污染物的去除效果较差,活化剂的加入可催化分解SPC溶于水产生的过氧化氢产生HO·,添加足量活化剂可显著改善污染物的去除率,当活化剂使用过量时,目标污染物的去除率反而降低。Fu等在Fe(Ⅲ)/SPC/苯的研究中发现了不同的现象,随着Fe(Ⅲ)剂量的增加,苯完全被降解所需的时间被缩短;苯的降解呈现出两个阶段,在反应速率较慢的第一阶段,大约有30%的苯被降解,在第二阶段苯的降解速度较快;较高剂量的Fe(Ⅲ)促进了Fe(Ⅱ)-氢过氧化物配合物的生成,从而产生了更多的HO·,使苯降解的时间缩短。
光照作为活化SPC的方法之一,可通过控制辐照强度对污染物的降解产生影响,苯胺降解率随着UV辐照强度的增加而显著上升,UV辐照强度的增加对HO均裂反应产生促进作用,使反应体系中·OH 等活性物种的有效浓度上升,有利于对目标物的降解。Eslami 等研究了超声波活化对SPC 体系降解酸性橙7(AO7)的影响,在控制pH、SPC 剂量不变的条件下,超声波功率的增加(100W、200W、300W)对AO7的去除没有产生变化,100W的功率足以激活SPC以产生自由基。
3.1.3 水中共存无机离子与有机物

低浓度(10mmol/L)Cl对污染物降解的影响不明显,但有实验发现低浓度Cl反而加速了目标污染物的降解,这种增强的降解可能是由于氯物种的形成,Cl可能与HO反应,生成了OCl,在紫外线和超声条件下,HOCl 被分解为HO·和Cl·,这两种自由基都可以降解染料。高浓度Cl条件下则发生了明显的抑制作用,在酸性pH 环境中,这种抑制可能是由于氯化物和HO·的相互作用形成HOCl·。在Fe(Ⅲ)/SPC/苯体系里,添加高浓度的Cl会对污染物的降解产生较大影响,可能是由于在溶液中生成了铁的配合物,抑制了Fe 和Fe(Ⅲ)对SPC 的活化作用,反应系统产生的HO·变少。

(2)有机质 地下水中除了含有多种无机阴离子外,还溶解了大量的有机质(NOM),对氧化体系的污染物去除效果也会产生影响。在活化SPC降解污染物的研究中通常选用腐殖酸(HA)作为一种具有代表性的NOM,添加低浓度HA,对污染物的去除略有抑制,当HA浓度提高时,目标污染物的去除率降低,HA 会与目标污染物竞争消耗氧化体系内的HO·,进而导致AOPs 的效率较低。随着HA 浓度进一步增加到100mg/L,对乙苯(EB)降解的抑制作用并没有进一步增强。有研究发现pH为5~7,添加一定浓度的HA可以提高Fenton 系统中有机化合物的氧化速率。高浓度的NOM 会降低Fe/SPC对苯的降解率,然而在反应体系中加入CIA 或GA 可减轻这种抑制作用,这可能是由于螯合剂的加入增加了反应体系里的HO·;然而在Fe/SPC降解苯的实验中得到了不同的结论,加入HA 促进了苯的降解,随着HA 浓度的增加,苯被完全降解的时间缩短,这可能是因为在反应体系中加入HA使Fe还原成了Fe,增强了反应体系的活化能力,对HO·的生成产生了促进作用,与HA消耗的HO·相比量更多,反应体系呈现出对苯降解的促进作用。
3.2 活化过氧碳酸氢盐的影响因素
3.2.1 溶液初始pH


3.2.3 共存阴离子

3.3 活化过碳酸盐和过氧碳酸氢盐体系的影响因素比较

4 活化过碳酸盐及过氧碳酸氢盐体系的反应机理
4.1 活化过碳酸盐体系的反应机理
4.1.1 铁基材料活化SPC
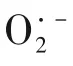


4.1.2 其他材料活化SPC

活化SPC的相关反应式如表4所示。

表4 活化SPC反应式
4.2 活化过氧碳酸氢盐体系的机理
4.2.1 PMC体系的机理


4.2.2 PMC的活化机理与作用机制


PMC体系与活化PMC体系的相关反应式如表5所示。
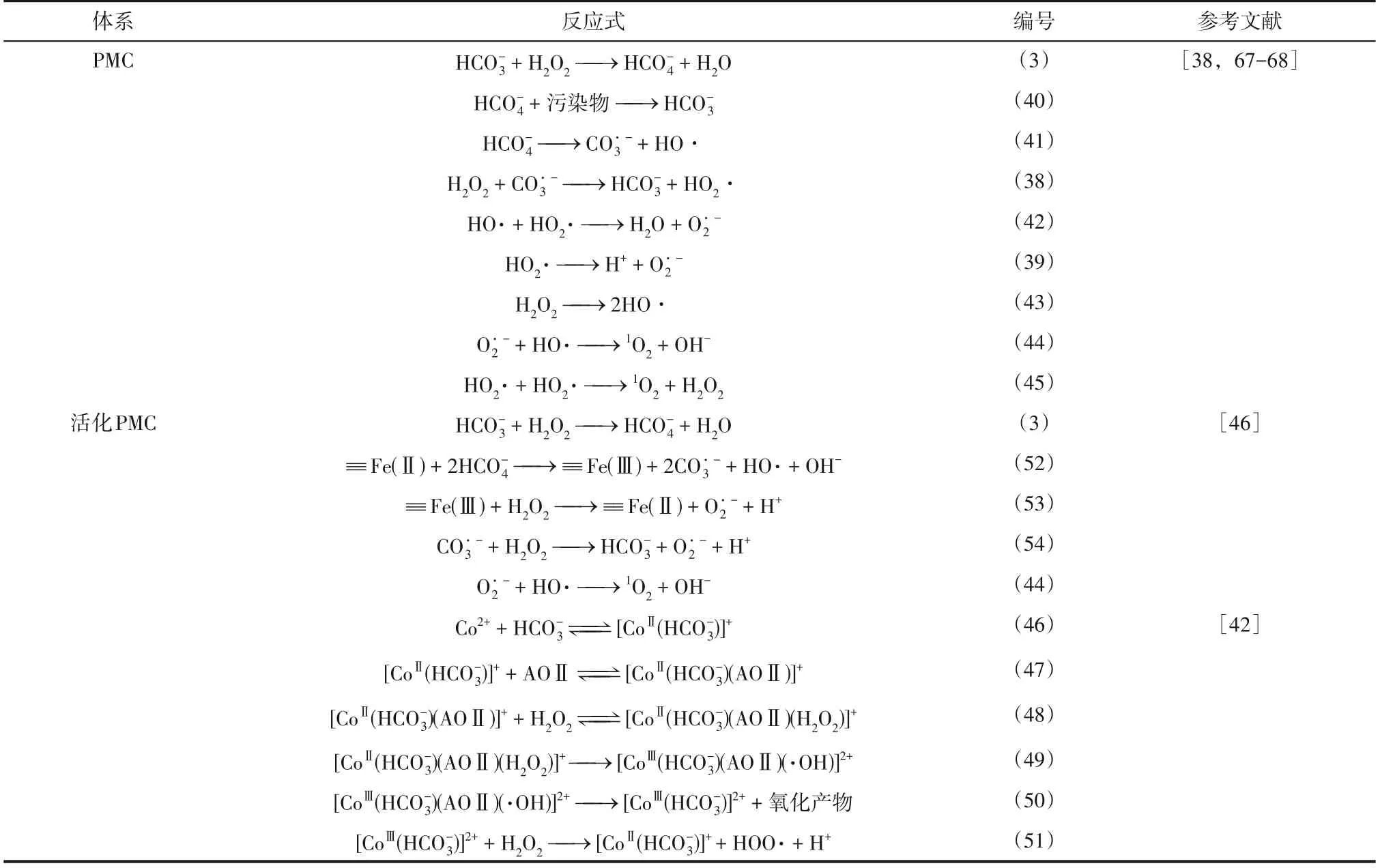
表5 PMC相关反应式
4.3 活化过碳酸盐和过氧碳酸氢盐体系机理的比较

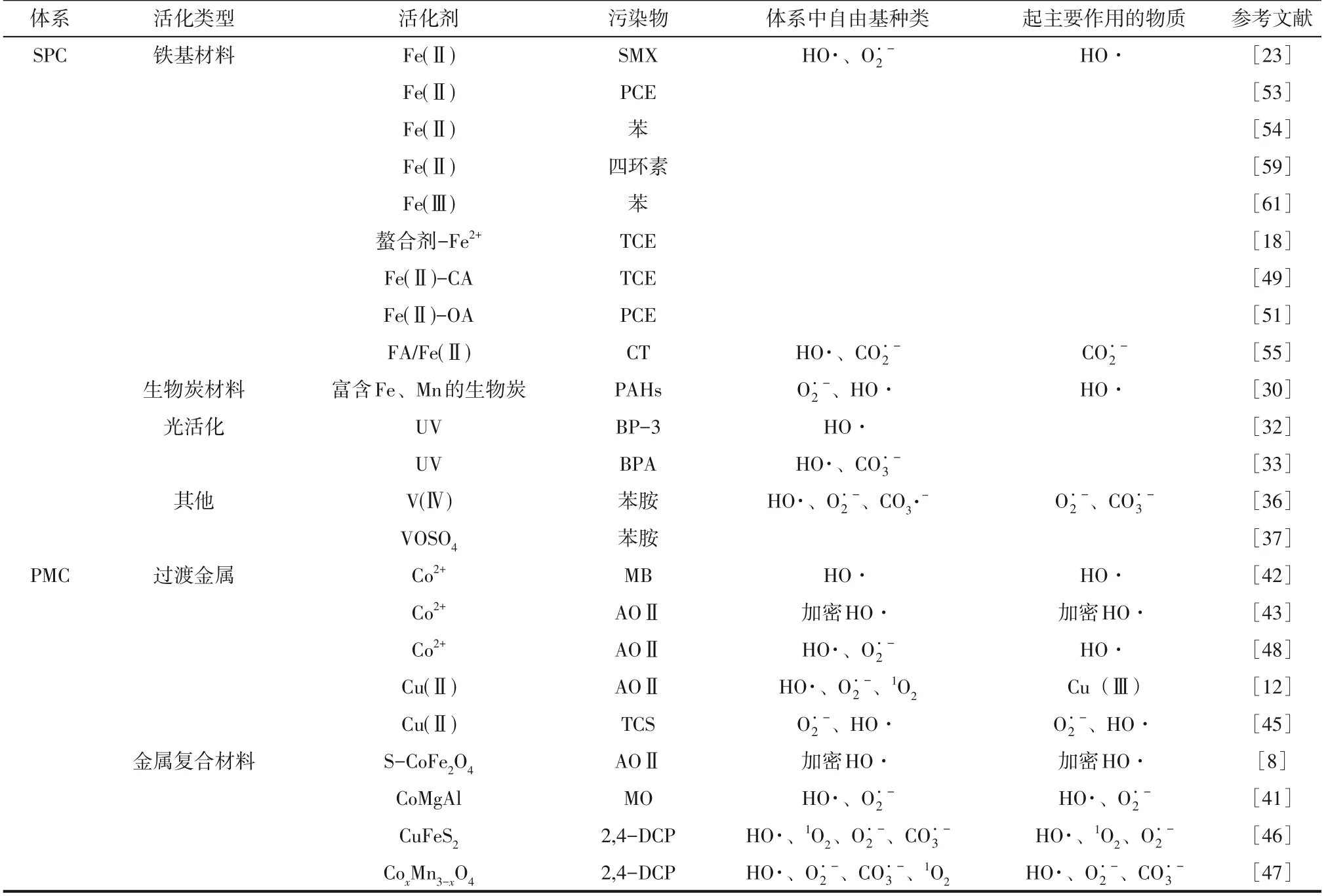
表6 不同活化剂活化SPC和PMC体系产生的自由基种类

图1 SPC和PMC的活化机制示意图
5 结语

目前的相关研究表明活化SPC 和PMC 体系具有良好的应用前景,但将该反应体系运用于受有机物污染的水修复时仍需关注以下问题。
(1)实际水体为复合污染,与实验室配制的标准溶液具有较大差异,需要进一步探究活化SPC和PMC 体系对水体的修复性能以及利用其进行实际水处理时的稳定性和安全性,厘清体系中产生的自由基对水体中污染物的去除机制。
(2)活化PMC体系关于自然环境(如有机质、共存离子)条件实验的研究较少,在实际的地下水修复应用中,自然环境是重要的影响因素,因此有必要进行深入研究。
(3)目前活化PMC 体系主要用于偶氮染料的脱色处理及酚类有机物的降解,可进一步拓宽其在降解有机污染物的应用。
(4)关于活化PMC 体系的研究较少,应进一步探索过渡金属离子及金属复合材料活化PMC 的催化机理,研究活化剂与PMC 之间的相互作用,为提高污染物去除率提供理论支持。
