砷胁迫下纳米硫对油菜幼苗生长、砷积累及土壤砷形态的影响
2022-06-24符佳豪范少茹庄秋荣徐敏月刘清泉佟海英汤诗杰原海燕
符佳豪 范少茹 庄秋荣 徐敏月 刘清泉 佟海英 汤诗杰 原海燕
摘要:为探究砷(As)胁迫下SNPs对油菜幼苗生长、砷(As)积累及土壤As形态的影响,以油菜为材料,通过培养基中添加SNPs和As,研究了As胁迫下SNPs对油菜幼苗生长和As积累的影响,并通过As污染土壤中添加SNPs研究了SNPs对As污染土壤中As化学形态的影响。结果表明,As胁迫显著抑制了油菜的生长,而SNPs添加不仅不同程度地缓解了As(Ⅴ)和As(Ⅲ)对油菜的毒害效应,还增加了根系和地上部As积累,100~300 mg/L SNPs处理下油菜株高、根长、干质量、地上部和根系As含量分别较单一As(Ⅴ)处理增加30.0%~42.9%、20.0%~28.9%、1.0%~9.3%、55.4%~173.0%、7.6%~31.0%,较单一As(Ⅲ)处理增加22.3%~40.0%、14.0%~31.5%、13.3%~29.8%、21.8%~30.0%、4.4%~14.0%。同时,油菜中As的转运系数(TF)和耐受指数(TI)也显著提高。另外,SNPs暴露1个月内As污染土壤中有效态As含量较原始As污染土壤有明显提高,15 d时提高18.1%,SNPs的添加增加了As污染土壤中松散结合态砷(L-As)、铝形态砷(Al-As)含量,且一定程度上降低了铁形态砷(Fe-As)、钙形态砷(Ca-As)和闭蓄态砷(O-As)含量。研究表明,SNPs在缓解油菜As毒害的同时还可增加其对As的积累,提高As污染土壤中As的生物有效性。
关键词:纳米硫;砷;油菜;植物修复;元素积累
中圖分类号:S634.301 文献标志码: A
文章编号:1002-1302(2022)12-0051-08
收稿日期:2022-03-14
基金项目:江苏省水利科技项目(编号:2021078);江苏省重点研发项目(编号:BE2018715)。
作者简介:符佳豪(1997—),男,河南沈丘人,硕士研究生,主要从事植物种质资源抗逆性评价、研究与利用研究。E-mail:fujiahao2333@163.com。
通信作者:原海燕,博士,副研究员,主要从事植物种质资源抗逆性评价与利用研究。E-mail:yuanhaiyan416@163.com。
砷(As)是一种有毒的类金属元素,土壤As污染不仅毒害农作物、降低土壤生产力,且As的生物蓄积性可通过食物链对人类健康造成威胁[1-2]。目前,我国土壤As污染依然严峻,其中农田污染对人类的影响更甚[3]。利用重金属超积累植物原位修复污染土壤的植物修复技术,因其无二次污染、投资少、不破坏生态环境等优势被认为是治理土壤重金属污染非常有前景的绿色方法[4-5],然而目前国内外已发掘的可用于实地修复的应用型重金属超积累植物资源却甚少,而且多数被发现的重金属超积累植物,亦普遍因生长缓慢、生物量小、修复深度不佳、效率低下等不足,阻碍了该技术的应用与快速发展[6]。而针对我国人口压力大、耕地资源紧张的国情和现状,在中低As污染土壤上利用外源物强化植物修复并进行非食用生产较其他修复技术而言更具有应用前景和现实意义。
近年来,越来越多的研究表明,纳米颗粒(NPs)对改善作物产量、养分管理、食品安全以及环境修复均具有较好的效果[7-9],其中,利用纳米材料强化植物吸收重金属进而提高植物修复效率的纳米-植物联合修复技术因环境友好性和高效性逐渐引起关注[10-12]。Singh 等研究了二氧化钛(TiO2)纳米颗粒对大豆(Glycine max)镉(Cd)积累的影响,结果表明,土壤中添加300 mg/kg TiO2纳米颗粒可使植株地上部Cd积累量增加约2.6倍[13]。Huang 等在不同剂量纳米零价铁(NZVI)对多年生黑麦草(Lolium perenne L.)生长和铅(Pb)积累影响的研究中发现,100 mg/kg NZVI处理下多年生黑麦草的生物量和Pb积累量均显著增加,Pb积累量较对照增加25.4%[14]。硫(S)作为植物必需大量营养元素对调节植物抵御逆境胁迫起着非常重要的作用。S元素作用的关键在于巯基(—SH)功能团,其中,非蛋白巯基半胱氨酸(Cys)、γ-谷氨酰半胱氨酸(γ-ECS)、谷胱甘肽(GSH)和植物螯合肽(PCs)等是植物体内As解毒的重要物质。Dhankher等研究发现,砷酸盐胁迫下,过表达γ-ECS基因后转基因拟南芥(Arabidopsis thaliana L.)植株鲜质量和As积累耐性均大大增强[15]。Wei等在砷酸盐胁迫下添加外源Na2SO4和GSH 不仅促进了As超积累植物蜈蚣草(Pteris vittata L.)As吸收,而且促进了As向植物地上部转移[16]。杨世杰等发现,土壤中施用单质S前期可提高有效态As含量,后期逐渐降低[17]。硫纳米颗粒(SNPs)作为一种新兴纳米材料,在农药、杀菌剂、医药、纤维工业等方面均有着重要的应用[18-19],笔者前期研究表明,外源SNPs不仅可以提高油菜产量,而且较普通硫肥对缓解植物重金属Hg、Pb毒害效果更佳[20-21]。
油菜(Brassica napus L.)为全球广泛种植的除食用外还具有多种工业用途的重要经济作物,不仅生物量大,适应性强,对重金属还具有较强的积累和耐受能力[22-25],是极具大面积推广应用前景的优良植物修复材料。目前国内外就SNPs对植物As积累影响的相关研究仅见Meselhy等在水稻(Oryza sativa L.)上的报道[26],As胁迫下SNPs对油菜生长和As积累的影响国内外尚未见报道。因此,本研究以油菜为试验材料,采用培养基培养与土壤培养,研究As胁迫下SNPs对油菜生长、As积累和土壤As形态转化的影响,对As污染环境下SNPs的环境效应和生物效应进行评估,为今后SNPs在As污染土壤修复研究与应用提供理论依据。
1 材料与方法
1.1 试验材料
砷酸钠(Na2HAsO4·7H2O)和亚砷酸钠(NaAsO2),购自山东西亚化学股份有限公司;硫纳米颗粒(SNPs,99.99%,47 nm)购自美国研究纳米材料公司;油菜种子(秦优10号)由江苏省农业科学院提供;供试土壤取自湖南省常德市石门县。
1.2 试验设计
1.2.1 不同浓度As(Ⅴ)与As(Ⅲ)对油菜生长的影响
1.2.1.1 含As培养基的配制
无菌条件下,准确称取一定量的Na2HAsO4·7H2O[As(Ⅴ)]与NaAsO2[A(sⅢ)]分别置于装有定量灭菌水的灭菌离心管中混匀,此为母液。待灭过菌的1/2 MS培养基冷却至快凝固时,将含As母液取出定量分别与培养基混合,分别配制成浓度为100、300、500 μmol/L As(Ⅴ) 以及25、50、100 μmol/L As(Ⅲ) 的1/2 MS培养基,而后将培养基按每盒60 mL倒入培养盒中冷却,同时做不含As的空白对照,共设CK、As(Ⅴ)100、As(Ⅴ)300、As(Ⅴ)500、As(Ⅲ)25、As(Ⅲ)50、As(Ⅲ)100等7个处理,每个处理均设置4个生物学重复(每个培养盒为1个生物学重复,下同)。
1.2.1.2 油菜种子的消毒与接种
油菜种子的消毒程序为70%乙醇(5 min)→0.1% HgCl2(10 min)→30% NaClO溶液(20 min)。而后移至超净工作台中用灭菌水清洗种子4~5次,每次 1 min,并将灭菌后的种子接种于冷却的培养基中,每培养盒接种12粒种子。
1.2.1.3 油菜的培养
将接种后的培养盒放入人工气候箱中培养,培养条件为昼22 ℃/夜20 ℃,每日光培养16 h、暗培养8 h,光照度为42 000 lx,种子生长10 d后收获并测量其生长指标。
1.2.2 As(Ⅴ)和As(Ⅲ)胁迫下添加SNPs对油菜生长和As积累的影响
1.2.2.1 SNPs悬浮液的配制
无菌条件下,取一定量的SNPs置于盛有定量灭菌水的灭菌三角瓶中,然后将三角瓶于超声水浴锅(KQ2200B,昆山超声仪器公司生产,功率200 W)中常温下超声分散 40 min,待形成稳定的悬浮液后备用。
1.2.2.2 As母液配制
无菌条件下,准确称取一定量的As(Ⅴ) 和As(Ⅲ)分别置于装有定量灭菌水的灭菌离心管中混匀备用。
1.2.2.3 含As和SNPs的1/2 MS培养基的配制
无菌条件下,待灭过菌的1/2 MS培养基冷却至快凝固时,将SNPs悬浮液取出定量分别与培养基混合后再加入定量的含As溶液配制成为所需浓度的培养基,而后按每盒60 mL倒入培养盒中冷却待用,同时做不含As和SNPs的空白对照,共设置CK 、As(Ⅴ)300、As(Ⅴ)300+SNPs100、As(Ⅴ)300+SNPs200、As(Ⅴ)300+SNPs300、As(Ⅲ)50、As(Ⅲ)50+SNPs100、As(Ⅲ) 50+SNPs200、As(Ⅲ)50+SNPs300等9个处理,As浓度单位为μmol/L,SNPs浓度单位为mg/L,每个处理均设置4个生物学重复。
1.2.2.4 油菜种子的消毒、接种、培养油菜种子消毒、接种、培养同“1.2.1.2”节与“1.2.1.3”节。
1.2.3 不同浓度SNPs对As污染土壤有效As转化效应的影响
在330 mL塑料杯中装入过2 mm筛的含As土壤150 g,将SNPs与土壤充分混合,调节土壤含水量为田间持水量的80%,将处理杯放在 5 ℃ 下恒温培养,每3 d补充1次水分(质量法),SNPs添加浓度设置为100、200、300 mg/kg。具体设置如下:As(CK)、As+SNPs100、As+SNPs200、As+SNPs300,4个生物学重复,于处理后15、30、45、60、90 d取样,共计5次,每次取土样10 g,置于室内陰凉处通风干燥,磨细过2 mm筛备用。
1.3 测定方法
1.3.1 生长指标测定
将幼苗从培养基中取出,小心仔细清洗其根部培养基,分别用自来水和去离子水冲洗4~5次,幼苗的株高、根长使用直尺测量,然后将地上部分与根系分离,置于烘箱内70 ℃连续干燥72 h,烘至恒质量后测定干质量、As含量。
1.3.2 油菜As含量测定
精确称取0.1 g样品粉末,加入5 mL HNO3混匀后应用2步消解程序,在 1 000 W 下升温10 min至180 ℃,然后在180 ℃下保持20 min,待样品冷却至50 ℃以下后移出样品溶液并定容至40 mL,使用ICP-OES(PerkinElmer Optima 8000;南京农业大学)测定As含量[20]。
1.3.3 土壤As含量测定
提取方法:取0.1 g土壤样品,精确称定,加入1 mL HNO3、3 mL HCl和 1 mL HF,石墨消解仪125 ℃消解2 h,定容至 40 mL,用ICP-OES测定As含量[20]。
1.3.4 土壤有效As测定
提取方法:取2.0 g土壤样品,置于20 mL离心管中,加入0.5 mol/L的NaHCO3溶液20 mL,轻轻摇匀后置于摇床(120 r/min)振荡2 h,离心过滤后用ICP-OES测定As含量[27]。
1.3.5 土壤As形态测定
精确称取0.5 g土壤样品,置于50 mL离心管中,加入 10 mL NH4Cl(1 mol/L)后,振荡30 min,再离心(常温,6 000 r/min,下同)5 min,过滤,滤液为松散结合态砷(L-As);饱和NaCl溶液6.25 mL清洗2次后离心,滤渣加入10 mL NH4F(0.5 mol/L)后,振荡 1 h,再离心过滤,滤液为铝形态砷(Al-As);饱和NaCl溶液6.25 mL清洗2次后离心,滤渣加入 10 mL NaOH(0.1 mol/L)后,振荡17 h,离心过滤,滤液为铁形态砷(Fe-As);饱和NaCl溶液6.25 mL清洗2次后离心,滤渣加入10 mL H2SO4(0.5 mol/L)后,振荡1 h,离心过滤,滤液为钙形态砷(Ca-As)。以上收集到的滤液用 ICP-OES 测定As含量,闭蓄态砷(O-As)含量为总As减去以上4种形态As所得[28]。
1.4 数据统计与分析
采用Office 016和SPSS 6软件进行数据分析及差异显著性检验,数据间的显著性检验用单因素方差分析中的Duncans方法。所有数据均采用“平均值±标准差”表示,采用OriginPro 021进行绘图。
2 结果与分析
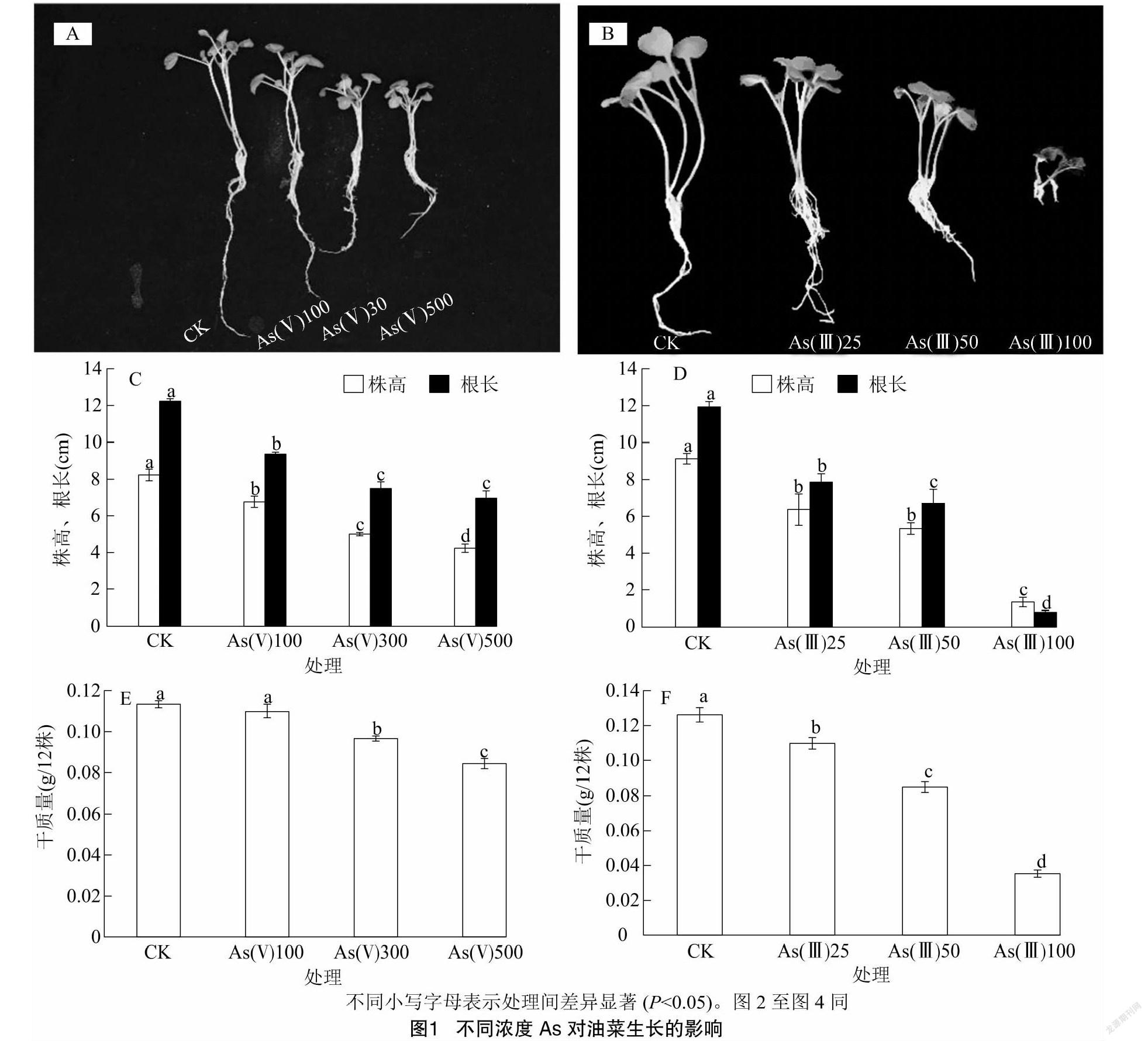
2.1 不同浓度As对油菜生长的影响
从图1-A至图1-D可以看出,随着 As(Ⅴ)、As(Ⅲ)浓度的增加,油菜的株高与根长呈逐渐降低趋势,100~500 μmol/L As(Ⅴ)与25~100 μmol/L As(Ⅲ)处理相较于对照均显著降低了油菜的株高和根长,株高分别降低17.6%~48.2%、30.3%~85.4%,根长分别降低23.4%~43.0%、34.1%~93.3%。不同As(Ⅴ)浓度胁迫下油菜干质量的分析表明,100 μmol/L As(Ⅴ)对油菜干质量抑制不明显,但300、500 μmol/L As(Ⅴ)均显著降低了油菜干质量,其中300 μmol/L As(Ⅴ)浓度下的油菜单株干质量较对照显著下降14.7%(P<0.05)。而25~100 μmol/L As(Ⅲ)均显著降低了油菜干质量,较对照下降13.0%~72.0%(P<0.05)。
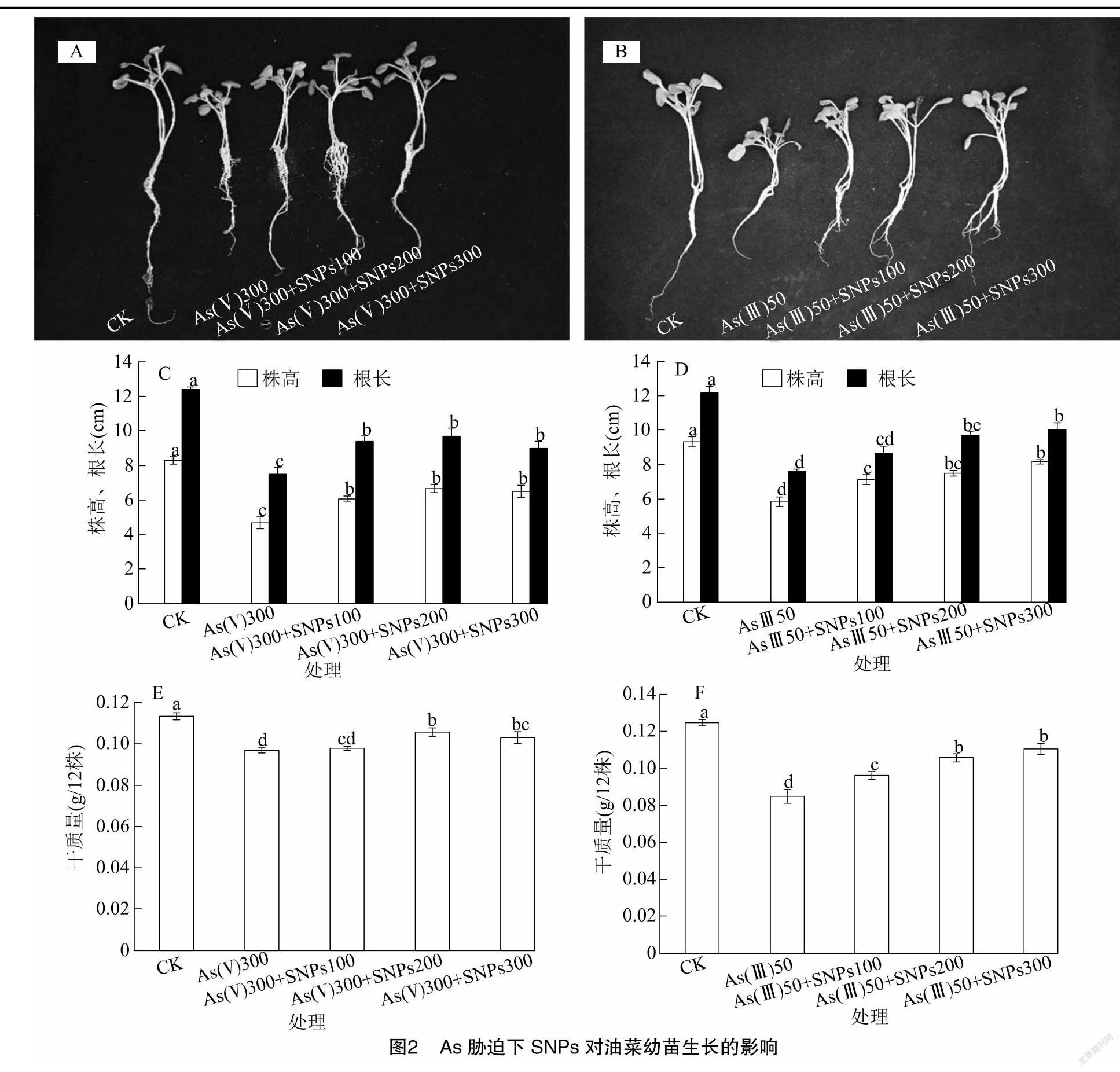
2.2 As胁迫下不同浓度SNPs对油菜生长的影响
由图2可见,300 μmol/L As(Ⅴ)与 50 μmol/L As(Ⅲ)均显著抑制了油菜地上部与根系的生长,As(Ⅴ) 胁迫下,油菜株高、根长、干质量较对照分别显著降低了43.8%、39.5%、14.7%,As(Ⅲ)胁迫下,油菜株高、根长、干质量较对照分别显著降低了37.5%、37.5%、31.8%。而SNPs的添加不同程度地缓解了As(Ⅴ)和As(Ⅲ)对油菜的毒害效应,100~300 mg/L 浓度SNPs分别较单一As(Ⅴ)处理油菜株高、根长、干质量分别增加30.0%~42.9%、20.0%~28.9%、1.0%~9.3%,较单一As(Ⅲ)处理油菜株高、根长、干质量分别增加22.3%~40.0%、14.0%~31.5%、13.3%~29.8%。其中,较单一As胁迫,As(Ⅴ)和As(Ⅲ)胁迫下添加 00 mg/L SNPs即可显著促进植物生长,200 mg/L与300 mg/L SNPs处理间差异不显著。
2.3 As胁迫下SNPs对油菜As积累的影响
由图3可见,单As胁迫下以及As和不同SNPs共同处理下油菜根系As含量均远高于地上部。与单As胁迫相比,As(Ⅴ)、As(Ⅲ)胁迫下添加200~300 mg/L SNPs均显著增加油菜地上部和根系As含量,其中,As(Ⅴ)胁迫下添加200~300 mg/L SNPs使地上部As含量增加133.3%~173.0%,根系As含量增加16.4%~31.0%(P<0.05); As(Ⅲ)胁迫下添加 00~300 mg/L SNPs使地上部和根系As含量增加22.6%~30.0%和6.7%~14.0%(P<0.05)。
2.4 As胁迫下SNPs对油菜As转运和耐受能力的影响
As胁迫下添加不同浓度SNPs对油菜As转运系数(TF)、耐受指数(TI)的影响见表1。由表1可见,As胁迫下添加不同浓度SNPs均能提高油菜中As的转运系数和耐受指数。相较于单一As(Ⅴ)胁迫,200 mg/L SNPs的添加使油菜中As转运系数和耐受指数分别显著提高69.2%、9.3%(P<0.05),同时,200 mg/L SNPs添加较单一As(Ⅲ)胁迫下油菜中As转运系数和耐受指数也分别显著提高40.9%、24.3%(P<0.05)。
2.5 SNPs对As污染土壤中有效态As含量的影响
由图4可见,SNPs暴露1个月内As污染土壤中有效态As含量较原始As污染土壤有明显提高,然而,随着SNPs暴露时间的延长,As污染土壤中有效态As含量逐渐降低,其中200 mg/kg SNPs暴露15 d时效果最显著,较原As污染土壤中有效态As含量显著增加18.1%(P<0.05)。
2.6 不同浓度SNPs对As化学形态的影响
SNPs对As化学形态的影响见表2,表2中数据为处理15 d时的结果,SNPs添加可增加松散结合态砷(L-As)、铝形态砷(Al-As)含量,但Al-As含量增加幅度较小,与不添加SNPs处理无显著差异,而L-As含量受影响较大,不同浓度SNPs添加均显著提高了As污染土壤中L-As含量,且 00 mg/kg SNPs的效果最優。与之相反,添加一定浓度SNPs在一定程度上降低了铁形态砷(Fe-As)、钙形态砷(Ca-As)和闭蓄态砷(O-As)含量, 其中不同浓度SNPs均显著降低了Ca-As含量。
3 讨论
As是一种公认的致癌物质,含As矿石的开采和冶炼,以及含As除草剂和杀虫剂等的使用均可造成As污染[29]。As的形态复杂多样,自然环境中主要以无机态五价砷[As(Ⅴ)]、三价砷[As(Ⅲ)]和有机态一甲基砷(MMA)、二甲基砷(DMA)为主。
As的存在形态决定了其毒性大小,通常可溶性无机As的毒性远大于有机As,而无机As中As(Ⅲ)的毒性远大于As(Ⅴ) [30]。本研究中,300 μmol/L As(Ⅴ) 处理使油菜干质量较对照降低14.7%,而50 μmol/L As(Ⅲ)处理下油菜干质量则较对照下降32.7%,As(Ⅲ)对油菜的生物毒性远大于As(Ⅴ),这与前人研究结果[31-32]一致。As一旦进入植物体内便会对植物形态、生理及生化过程造成一系列负面影响,如降低ATP合成,抑制酶活,减少营养元素吸收及光合色素合成,进而抑制植物生长[33-35]。
S是植物生长必需的大量元素。关于外源S缓解植物As毒害已有诸多报道,如Srivastava等对黑藻的研究显示,2 mmol/L外源S施加增加了黑藻总巯基(—SH)含量,提高了黑藻的As耐性和积累[36]。Wei等发现,外源添加Na2SO4和GSH可缓解As超积累植物蜈蚣草As毒害且促进As积累,并增强As向植物地上部的转运[16]。SNPs对植物吸收重金属的研究报道甚少,本研究结果表明,外源添加SNPs可显著缓解油菜As毒害,100~300 mg/L SNPs添加后油菜株高、根长、干质量较单一As胁迫处理增加22.3%~42.9%、14.0%~31.5%、1.0%~29.8%。有研究表明,植物对As的解毒策略主要是通过体内植物螯合肽(PCs)、金属硫蛋白(MTs)、谷胱甘肽(GSH)等含S巯基蛋白与As相结合后将As转运至液泡进而降低As毒害[37],Pickering 等发现芥菜型油菜(B. juncea L.)与拟南芥地上部与根部中有 96%~100%的As都与—SH相结合[15,38]。S是含—SH化合物合成的必需物质,因此,SNPs可能也通过增加—SH化合物的合成以提高植物对As的解毒能力。另外,纳米颗粒除具有化学反应活性强、吸附表面积大、低温改性、活性原子性等特点外,还具有独特的氧化还原特性[39-40],SNPs可能通过加速As(Ⅴ)还原为 As(Ⅲ) 的进程进而加快As(Ⅲ)与巯基化合物的结合和解毒。笔者前期研究表明,SNPs较普通硫肥对缓解植物重金属毒害效果更佳[20-21]。
運用纳米材料治理重金属污染水体以及土壤是近年来国内外研究的热点且已见诸多报道,但目前利用纳米材料辅助植物修复重金属污染土壤的研究则甚少。而本研究表明SNPs在缓解As毒害的同时还增加了As积累,添加100~300 mg/L SNPs使油菜地上部与根系As含量均显著增加且油菜中As转运系数和耐受指数也显著提高,这对利用SNPs提高植物修复效率具有重要的意义。已有文献报道,外源S的施加可增加土壤重金属的生物有效性进而增强植物对金属的吸收能力,Wang 等研究表明,外源S施加增加了土壤中Cu和Zn的生物有效性,进而促进了海州香薷对Cu的积累[41]。Cui 等发现,施硫量为200 mmol/kg时,土壤pH值下降约0.3,Zn和Cd的溶解度显著增加[42]。刘涛等研究显示,淹水条件下,外源添加硫酸盐增强了污染土壤中As的活化速率,试验15 d后,土壤溶液中As的浓度持续增加,硫酸盐增加了土壤中As的释放[43]。因此,SNPs增加油菜As积累可能是通过增加了As的生物有效性促进了油菜对As的吸收,另一方面SNPs增强了油菜的解毒能力,降低了As在细胞内的生物活性,使得油菜处于较正常的代谢水平从而增加了对As的摄取。
土壤中As的存在形态很大程度上决定了其移动性、毒性程度以及生物对其的吸收利用[44-45]。因此,土壤中有效As含量及其As形态不仅是判断土壤As污染的依据,也是评估As污染土壤修复效率的重要指标,这对于评测土壤As的生物有效性和土壤As环境风险具有十分重要的意义。本研究结果显示,SNPs暴露短期内可显著提高As污染土壤中有效态As含量,其中200 mg/kg SNPs添加 15 d时较原As污染土壤中有效态As含量显著增加18.1%。同时,SNPs的添加增加了As污染土壤中松散结合态砷(L-As)及铝形态砷(Al-As)含量,且在一定程度上降低了铁形态砷(Fe-As)、钙形态砷(Ca-As)和闭蓄态砷(O-As)含量。已有文献报道S可改变土壤As形态,邹丽娜发现As污染土壤施加高浓度S肥显著增加了非专性吸附态As含量,施加单质S降低了无定形铁氧化物态As含量[46]。杨世杰研究结果显示,土壤中施用单质S前期可提高有效态As含量,后期逐渐降低[17],本研究结果与之相似。本试验仅初步研究了SNPs单一因子对As污染土壤中有效态As含量的短期动态影响,而实地As污染农田土壤SNPs如何影响土壤As生物活性及植物吸收仍有待进一步研究。
4 结论
(1)单一As胁迫下,油菜生长严重受阻,株高、根长、生物量均大幅降低,植物体As积累量明显增加,As胁迫严重抑制了油菜的生长发育。(2)As胁迫下添加SNPs极大地缓解了As对油菜的毒害,与单一As胁迫相比,油菜株高、根长、生物量和As积累量均显著增加,油菜中As转移系数和耐受指数也相应提高。(3)SNPs添加1个月内可显著提高As污染土壤中有效态As含量,随着时间延长,有效态As含量逐渐降低,SNPs的添加增加了As污染土壤中松散结合态砷(L-As)、铝形态砷(Al-As)含量,且在一定程度上降低了铁形态砷(Fe-As)、钙形态砷(Ca-As)和闭蓄态砷(O-As)含量。
参考文献:
[1]Gautam A,Pandey A K,Dubey R S. Unravelling molecular mechanisms for enhancing arsenic tolerance in plants:a review[J]. Plant Gene,2020,23:100240.
[2]Wei B G,Yang L S. A review of heavy metal contaminations in urban soils,urban road dusts and agricultural soils from China[J]. Microchemical Journal,2010,94(2):99-107.
[3]胡红青,黄益宗,黄巧云,等. 农田土壤重金属污染化学钝化修复研究进展[J]. 植物营养与肥料学报,2017,23(6):1676-1685.
[4]Pilon-Smits E. Phytoremediation[J]. Annual Review of Plant Biology,2005,56:15-39.
[5]Yan A,Wang Y M,Tan S N,et al. Phytoremediation:a promising approach for revegetation of heavy metal-polluted land[J]. Frontiers in Plant Science,2020,11:359.
[6]Passatore L,Rossetti S,Juwarkar A A,et al. Phytoremediation and bioremediation of polychlorinated biphenyls (PCBs):state of knowledge and research perspectives[J]. Journal of Hazardous Materials,2014,278:189-202.
[7]Gomez A,Narayan M,Zhao L J,et al. Effects of nano-enabled agricultural strategies on food quality:current knowledge and future research needs[J]. Journal of Hazardous Materials,202 401:123385.
[8]Ioannou A,Gohari G,Papaphilippou P,et al. Advanced nanomaterials in agriculture under a changing climate:the way to the future?[J]. Environmental and Experimental Botany,2020,176:104048.
[9]Wang Y,Deng C Y,Cota-Ruiz K,et al. Improvement of nutrient elements and allicin content in green onion (Allium fistulosum) plants exposed to CuO nanoparticles[J]. Science of the Total Environment,2020,725:138387.
[10]Alka S,Shahir S,Ibrahim N,et al. Arsenic removal technologies and future trends:a mini review[J]. Journal of Cleaner Production,202 78:123805.
[11]Song B,Xu P,Chen M,et al. Using nanomaterials to facilitate the phytoremediation of contaminated soil[J]. Critical Reviews in Environmental Science and Technology,2019,49(9):791-824.
[12]Yadav K,Singh J,Gupta N,et al. A review of nanobioremediation technologies for environmental cleanup:a novel biological approach [J]. Journal of Materials and Environmental Science,2017(8):740-757.
[13]Singh J,Lee B K. Influence of nano-TiO2 particles on the bioaccumulation of Cd in soybean plants (Glycine max):a possible mechanism for the removal of Cd from the contaminated soil[J]. Journal of Environmental Management,2016,170:88-96.
[14]Huang D L,Qin X,Peng Z W,et al. Nanoscale zero-valent iron assisted phytoremediation of Pb in sediment:impacts on metal accumulation and antioxidative system of Lolium perenne[J]. Ecotoxicology and Environmental Safety,2018,153:229-237.
[15]Dhankher O P,Li Y,Rosen B P,et al. Engineering tolerance and hyperaccumulation of arsenic in plants by combining arsenate reductase and γ-glutamylcysteine synthetase expression[J]. Nature Biotechnology,2002,20(11):1140-1145.
[16]Wei S H,Ma L Q,Saha U,et al. Sulfate and glutathione enhanced arsenic accumulation by arsenic hyperaccumulator Pteris vittata L.[J]. Environmental Pollution,2010,158(5):1530-1535.
[17]杨世杰. 硫和砷在水稻体内的累积分布及其在土壤中赋存形态的变化[D]. 郑州:河南农业大学,2014.
[18]Cao X,Wang C,Luo X,et al. Elemental sulfur nanoparticles enhance disease resistance in tomatoes[J]. ACS Nano,202 15(7):11817-11827.
[19]Shankar S,Jaiswal L,Rhim J W. New insight into sulfur nanoparticles:synthesis and applications[J]. Critical Reviews in Environmental Science and Technology,202 51(20):2329-2356.
[20]Yuan H Y,Liu Q Q,Guo Z,et al. Sulfur nanoparticles improved plant growth and reduced mercury toxicity via mitigating the oxidative stress in Brassica napus L.[J]. Journal of Cleaner Production,202 318:128589.
[21]原海燕,劉清泉,张永侠,等. 纳米硫对铅胁迫下油菜幼苗生长和铅积累的影响[J]. 农业环境科学学报,202 40(3):517-524.
[22]Fu D H,Jiang L Y,Mason A S,et al. Research progress and strategies for multifunctional rapeseed:a case study of China[J]. Journal of Integrative Agriculture,2016,15(8):1673-1684.
[23]Grispen V M J,Nelissen H J M,Verkleij J A C. Phytoextraction with Brassica napus L.:a tool for sustainable management of heavy metal contaminated soils[J]. Environmental Pollution,2006,144(1):77-83.
[24]Elferjani R,Soolanayakanahally R. Canola responses to drought,heat,and combined stress:shared and specific effects on carbon assimilation,seed yield,and oil composition[J]. Frontiers in Plant Science,2018,9:1224.
[25]Zhang S,Song J. Geochemical cadmium anomaly and bioaccumulation of cadmium and lead by rapeseed (Brassica napus L.) from noncalcareous soils in the Guizhou Plateau[J]. Science of the Total Environment,2018,644:624-634.
[26]Meselhy A G,Sharma S,Guo Z,et al. Nanoscale sulfur improves plant growth and reduces arsenic toxicity and accumulation in rice (Oryza sativa L.)[J]. Environmental Science & Technology,202 55(20):13490-13503.
[27]肖 玲,趙允格. 石灰性土壤中有效砷提取剂的选择[J]. 陕西环境,1996(3):17-21.
[28]武 斌,廖晓勇,陈同斌,等. 石灰性土壤中砷形态分级方法的比较及其最佳方案[J]. 环境科学学报,2006,26(9):1467-1473.
[29]汪京超,李楠楠,谢德体,等. 砷在植物体内的吸收和代谢机制研究进展[J]. 植物学报,2015,50(4):516-526.
[30]Sharma V K,Sohn M. Aquatic arsenic:toxicity,speciation,transformations,and remediation[J]. Environment International,2009,35(4):743-759.
[31]Ullrich-Eberius C I,Sanz A,Novacky A J. Evaluation of arsenate-and vanadate-associated changes of electrical membrane potential and phosphate transport in Lemna gibba G1[J]. Journal of Experimental Botany,1989,40(1):119-128.
[32]Bertolero F,Pozzi G,Sabbioni E,et al. Cellular uptake and metabolic reduction of pentavalent to trivalent arsenic as determinants of cytotoxicity and morphological transformation[J]. Carcinogenesis,1987,8(6):803-808.
[33]Ahsan N,Lee D G,Alam I,et al. Comparative proteomic study of arsenic-induced differentially expressed proteins in rice roots reveals glutathione plays a central role during As stress[J]. Proteomics,2008,8(17):3561-3576.
[34]Dwivedi S,Tripathi R D,Tripathi P,et al. Arsenate exposure affects amino acids,mineral nutrient status and antioxidants in rice (Oryza sativa L.) genotypes[J]. Environmental Science & Technology,2010,44(24):9542-9549.
[35]Marin A R,Pezeshki S R,Masschelen P H,et al. Effect of dimethylarsenic acid (DMAA) on growth,tissue arsenic,and photosynthesis of rice plants[J]. Journal of Plant Nutrition,1993,16(5):865-880.
[36]Srivastava S,DSouza S F. Effect of variable sulfur supply on arsenic tolerance and antioxidant responses in Hydrilla verticillata (L.f.) Royle[J]. Ecotoxicology and Environmental Safety,2010,73(6):1314-1322.
[37]Zhao F J,Ma J F,Meharg A A,et al. Arsenic uptake and metabolism in plants[J]. New Phytologist,2009,181(4):777-794.
[38]Pickering I J,Prince R C,George M J,et al. Reduction and coordination of arsenic in Indian mustard[J]. Plant Physiology,2000,122(4):1171-1178.
[39]Fu R B,Yang Y P,Xu Z,et al. The removal of chromium (Ⅵ) and lead (Ⅱ) from groundwater using sepiolite-supported nanoscale zero-valent iron (S-NZVI)[J]. Chemosphere,2015,138:726-734.
[40]Liang S X,Jin Y,Liu W,et al. Feasibility of Pb phytoextraction using nano-materials assisted ryegrass:results of a one-year field-scale experiment[J]. Journal of Environmental Management,2017,190:170-175.
[41]Wang Y P,Li Q B,Hui W,et al. Effect of sulphur on soil Cu/Zn availability and microbial community composition[J]. Journal of Hazardous Materials,2008,159(2/3):385-389.
[42]Cui Y S,Dong Y T,Li H F,et al. Effect of elemental sulphur on solubility of soil heavy metals and their uptake by maize[J]. Environment International,2004,30(3):323-328.
[43]劉 涛,张翅鹏,郝瑶玲,等. 硫酸盐对土壤铁矿物还原转化及砷释放的影响[J]. 浙江农业学报,2020,32(4):678-684.
[44]苏春田,唐健生,陈宏峰,等. 黎塘岩溶区铁锰结核胁迫下土壤重金属元素形态分析[J]. 中国农学通报,201 7(1):95-99.
[45]Onyatta J O,Huang P M. Chemical speciation and bioavailability index of cadmium for selected tropical soils in Kenya[J]. Geoderma,1999,91(1/2):87-101.
[46]邹丽娜. 硫肥和猪粪肥对土壤-水稻系统砷迁移转化的影响及微生物作用机制[D]. 杭州:浙江大学,2018.
