东北酸菜发酵前后期细菌菌群多样性分析
2022-06-23周姝静孙全敏迟乃玉张庆芳
周姝静,孙全敏,迟乃玉,张庆芳*
(1.大连大学 生命科学与技术学院,辽宁 大连 116622;2.辽宁省海洋微生物工程技术研究中心,辽宁 大连 116622)
发酵蔬菜在我国有着悠久的历史,以其独具特色的风味和保健功能在食品行业占据着重要地位,深受广大群众的喜爱。近期更有研究表明,食用发酵蔬菜在抵抗新型冠状病毒肺炎(corona virus disease 2019,COVID-19)上具有一定效果[1]。东北酸菜是一种以大白菜为原材料的发酵蔬菜,口味咸酸,有开胃健食、润肠通便、杀菌抗炎、促进消化的效果,营养价值丰富[2]。因此,东北酸菜的相关研究已越来越受到广大学者的关注。
随着高通量测序技术的不断发展,发酵食品中微生物多样性及群落演替已开展了多方位的研究[3-6]。孙炜宁[7]在酸菜细菌区系中共注释到4个细菌门,分别为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)以及放线菌门(Actinobacteria);共注释到38个细菌属,其中包括乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、乳球菌属(Lactococcus)和明串珠菌属(Leuconostoc)4种乳酸菌属;杨希等[8]研究发现,在酸菜发酵的整个过程中乳杆菌属的相对丰度增加了81.34%,说明乳酸菌是酸菜发酵中的主要微生物;YANG X等[9]对来自3个不同家庭的酸菜进行了微生物群落动态分析,发现魏斯氏菌属(Weissella)、乳杆菌属(Lactobacillus)、梭状芽胞菌属(Clostridium)、肠杆菌属(Enterobacter)是酸菜中菌群结构的主要部分。虽然目前已有大量东北酸菜中菌群多样性的相关研究,但通过高通量测序结合理化指标及OD600nm值对东北酸菜发酵前后期进行对比的研究尚少。
东北酸菜传统发酵容器多为大型陶瓷缸或玻璃缸,传统方法虽然腌制工艺简便但极易污染杂菌。故本试验设计了一种东北酸菜小型发酵体系,使用无菌且统一规格的矿泉水瓶作为发酵容器,该发酵方式不仅极大的保证了取样的安全性也为今后进行相关东北酸菜产品开发提供了新思路。本研究以酸菜发酵过程中前、后期理化指标及OD600nm值波动较大的两个样本为研究对象,利用Illumina Novaseq测序平台对其进行16S rRNA高通量测序,研究东北酸菜发酵前、后期的细菌多样性及乳酸菌菌属变化差异,旨在为东北酸菜产品的开发提供更多理论依据。
1 材料与方法
1.1 材料与试剂
新鲜大白菜:辽宁省大连市金州区某农贸市场;硼砂、亚铁氰化钾、乙酸锌、亚硝酸钠、对氨基苯磺酸、盐酸萘乙二胺、氢氧化钠、酚酞(均为分析纯):上海麦克林生化科技有限公司;DP812土壤基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;16S rRNA基因V3~V4区引物合成及建库测序:由北京百迈客生物科技有限公司完成。
1.2 仪器与设备
PHS-3E型pH计:上海仪电科学仪器股份有限公司;CRY-2112恒温摇床:上海茸研仪器有限公司;DK-S26电热恒温水浴锅:上海精宏实验设备有限公司;Thermo Multiskan 1510酶标仪:芬兰Labsystems公司;AL204电子天平:上海梅特勒-托利多仪器有限公司;UV-1200型紫外可见分光光度计:上海美谱达仪器有限公司。
1.3 试验方法
1.3.1 酸菜的制作工艺流程及操作要点
挑选新鲜大白菜→清洗→烫漂→沥水→切丝混匀→装瓶→注盐水→封盖→恒温发酵→酸菜成品
操作要点:
挑选新鲜大白菜清理好外层叶片,将白菜顺着菜帮掰成若干片后,用清水清洗干净,再放入85~90 ℃开水中漂烫0.5 min(菜帮先入水浸烫),取出后放入冷水中漂洗,沥干表面水分后将白菜切成0.5~1 cm的均匀细丝。注意要将不同部位的白菜细丝混匀,选用555 mL的矿泉水瓶共30瓶,每瓶分装350 g混匀的白菜丝,再注入1.5%的盐水至满瓶,拧紧瓶盖,放置于25 ℃恒温培养箱中发酵一定时间,得到酸菜成品。
1.3.2 酸菜理化指标的测定
每瓶酸菜代表一个独立的时间点,从0 h开始取样测量,而后每隔12 h取样一次。将瓶内酸菜与发酵液倒入烧杯中,将其全部研磨后制成匀浆,分别称取10 g酸菜匀浆作为待测样品,进行理化指标的检测[10-12]。pH值的测定:使用pH计;亚硝酸盐含量的测定:参照GB 5009.33—2016《食品安全国家标准食品中亚硝酸盐与硝酸盐的测定》中盐酸萘乙二胺法;总酸含量的测定:参照GB 12456—2021《食品安全国家标准食品中总酸的测定》中的酸碱滴定法;OD600nm值的测定:使用紫外分光光度计测定在波长600 nm处的吸光度值;所有试验重复测定3次取平均值。
1.3.3 高通量测序
按照土壤基因组DNA提取试剂盒说明书提取样本DNA,以其为模板,采用引物对338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)进行PCR扩增,PCR扩增产物委托北京百迈克生物科技有限公司完成建库测序。
1.3.4 生物信息学分析
首先利用Trimmomatic软件和Cutadapt软件对初始序列进行质量过滤;然后利用Usearch软件和Uchime软件对序列进行拼接和筛选,得到最终有效数据;用Usearch软件对相似度为97.0%的有效序列进行聚类,获得操作分类单元(operational taxonomic unit,OTU)[13]。使用QIIME2软件进行α多样性分析,用MEGAN软件绘制分类学系统关系树,比较样品中菌群的进化关系及两样品在不同分类学分支上序列丰度的差异[14]。使用PICRUSt2软件对发酵前、后期两个酸菜样本中的微生物进行基因功能预测,并比较两个样本在不同功能之间存在的差异[15]。
2 结果与分析
2.1 酸菜样本理化指标及OD600nm值的检测
pH值代表着酸菜的发酵进程,总酸能体现出酸菜发酵后的酸香味,OD600nm值在一定程度上可以反映酸菜中的菌群浓度,亚硝酸盐含量反映了发酵蔬菜的安全性[16]。发酵过程中酸菜的pH值、总酸含量、OD600nm值及亚硝酸盐含量的变化见图1。

图1 酸菜发酵过程中理化指标及OD600nm值的变化Fig. 1 Changes of physical and chemical indexes and OD600nm value during sauerkraut fermentation process
由图1可知,当发酵12 h时,pH值下降至4.62,亚硝酸盐含量(9.43 mg/kg)达到峰值,OD600nm值(0.42)降至最低点,总酸含量(1.35 g/kg)处于均匀上升阶段。当发酵72 h时,pH值降至3.53,曲线趋于平稳;亚硝酸盐含量(2.67 mg/kg)也降至最低点,曲线趋于平稳;总酸含量(3.60 g/kg)升至最高点,随后保持不变。由此可知,发酵时间为12 h和72 h是整个发酵阶段内理化指标变化明显的时间点,将发酵12 h(发酵前期)对应的样本命名为SC1,发酵72 h(发酵后期)对应的样本命名为SC2。
2.2 酸菜样本细菌微生物高通量测序结果及质量评估
酸菜样本细菌微生物的高通量测序结果见表1。由表1可知,从两个酸菜样本中共获得160 457条原始序列,双端序列质控、拼接后共得到159 660条高质量序列,最终将高质量序列通过拼接、过滤和嵌合体后得到有效序列共158 188条,序列平均碱基长度为414 bp,样品平均鸟嘌呤(guanine,G)胞嘧啶(cytosine,C)含量为53.10%。此外,两个酸菜样本的测序质量值Q20>98%、Q30>95%,有效序列占比>98%,说明测序结果数据质量良好。

表1 酸菜样本细菌微生物高通量测序结果Table 1 High-throughput sequencing results of bacterial microbe in sauerkraut sample
2.3 基于OTU的Venn图分析
两个酸菜样本中OTU的Venn图见图2。由图2可知,样本SC1独有的OTU数量为4,样本SC2独有的OTU数量为3;两样本共有的OTU数量为54,占OTU总数的88.52%;两样本特有的OTU数目占全部OTU总数的11.48%;说明样本SC1和SC2中绝大部分的细菌种类相似。

图2 两个酸菜样本中OTU的Venn图Fig. 2 Venn diagram of OTU in two sauerkraut samples
2.4 酸菜样本细菌菌群的等级丰度曲线
等级丰度曲线可反映两样品所含物种的均匀度和丰富度,横轴方向上的曲线长度反映了物种丰富度,长度越长,说明物种的组成越丰富;纵轴方向上的曲线变化反映了物种均匀度,变化越平缓,说明物种组成的均匀程度越高[17]。两个酸菜样本细菌菌群的等级丰度曲线见图3。由图3可知,样本SC1所含物种丰富度大于样本SC2,样本SC2的物种均匀度大于样本SC1。

图3 两个酸菜样本的等级丰度曲线Fig. 3 Grade abundance curve of two sauerkraut samples
2.5 酸菜样本细菌菌群Alpha多样性分析
Alpha多样性主要的衡量指标包括超1(Chao1)指数、ACE指数、香农(Shannon)指数、辛普森(Simpson)指数、覆盖率[3]。Chao1和ACE指数衡量物种的丰度,指数越大,丰度越高;Simpson指数和Shannon指数反映了物种多样性,Simpson指数越小,Shannon指数越大,多样性越高[18]。两个酸菜样本细菌菌群的Alpha多样性指数分析结果见表2。
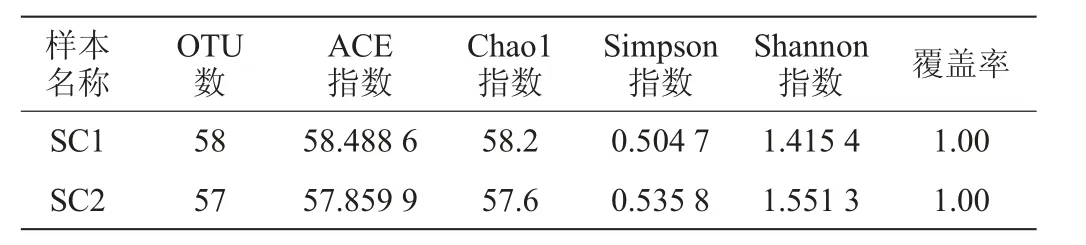
表2 两个酸菜样本细菌菌群的Alpha多样性分析结果Table 2 Alpha diversity analysis results of bacterial flora in two sauerkraut samples
由表2可知,样本SC1的物种丰富度及多样性均高于样本SC2。两样本的覆盖率均为1.00,表示测序覆盖率达到了100%,样本中物种全部被检测出来。结合两个样本的理化指标进行推断,样本SC1达到了整个发酵周期菌群多样性峰值,此时酸菜中细菌丰度最大;样本SC2代表发酵后期,随着发酵进程的结束,发酵后期酸菜中细菌的多样性及丰度值逐渐减少至平稳。
2.6 酸菜样本中细菌菌群结构分析
两个酸菜样本中细菌菌群的各分类水平见表3。由表3可知,酸菜样本SC1中的细菌菌群归属于7个门中的44个属,酸菜样本SC2中的细菌菌群归属于8个门中的42个属,在各分类水平的数量上相差不大。

表3 两个酸菜样本细菌菌群的各分类水平统计结果Table 3 Statistical results of each classification level of bacterial flora of two sauerkraut samples
2.6.1 基于门水平酸菜样本细菌菌群结构的分析
两个酸菜样本中细菌微生物在门水平上的菌群结构见图4。由图4可知,样本SC1和SC2在门分类水平上共注释到9个物种,共有细菌门为6个,包括蓝藻细菌门(Cyanobacteria)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)。其中,Proteobacteria相对丰度变化最大,其发酵前期的相对丰度为5.86%,发酵后期的相对丰度为10.49%,增加了4.63%。发酵前期独有的细菌门为髌骨细菌门(Patescibacteria)(0.01%),发酵后期独有的细菌门为绿弯菌门(Chloroflexi)(0.04%)和酸杆菌门(Acidobacteria)(0.01%)。

图4 基于门水平酸菜样本细菌菌群结构分析结果Fig. 4 Analysis results of bacterial flora structure of sauerkraut samples based on phylum level
2.6.2 基于属水平酸菜样品细菌菌群结构的分析
两个酸菜样本中细菌微生物在属水平上的菌群结构见图5。由图5可知,样本SC1共含44个细菌属,SC2共含42个细菌属,样本SC1和SC2均含有4种乳酸菌属,分别为魏斯氏菌属(Weissella)、明串珠菌属(Leuconostoc)、乳球菌属(Lactococcus)、乳杆菌属(Lactobacillus)。与样本SC1相比,样本SC2中4种乳酸菌属的相对丰度均有小幅度的下降。其中含量最丰富的乳酸菌属为Weissella,相对丰度由发酵前期的26.23%降至发酵后期的25.47%;Leuconostoc的相对丰度由发酵前期的1.46%降至发酵后期的0.27%;Lactococcus的相对丰度由发酵前期的0.60%降至0.41%;Lactobacillus的相对丰度由发酵前期的0.26%降至0.14%。此外,两样本中均检测到一些功能细菌,其中真杆菌属([Eubacterium]_coprostanoligenes_group)在样本SC1及SC2中的相对丰度分别为0.003%和0.008%,阿克曼菌属(Akkermansia)在两样本中的相对丰度分别为0.014%和0.005%。研究表明真杆菌属对调节血脂异常具有一定作用,经动物实验和部分临床实验证明了阿克曼菌属有作为益生菌剂的巨大潜力[19-20]。综上所述,采用本实验工艺制成的酸菜在食品功能方面具有一定优势。
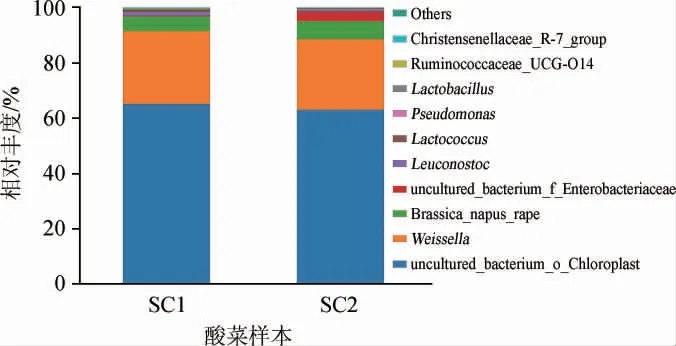
图5 基于属水平酸菜样本细菌菌群结构分析结果Fig. 5 Analysis results of bacterial flora structure of sauerkraut samples based on genus level
3 讨论
周艺萍[18]在研究盐分对新平酸腌菜主发酵期细菌多样性的影响中检测到未分类的蓝细菌属(unidentifiedCyanobacteria)含量高达30.02%;刘长根[21]在进行传统发酵蔬菜的菌群结构分析中发现蓝藻细菌门(Cyanobacteria)为优势菌门,未知叶绿体(unidentified Chloroplast)为优势菌属。本实验在SC1和SC2两样本中均检测到蓝藻细菌门(Cyanobacteria),相对丰度高达60%以上,该结果与刘长根[21]的研究结果相似。
乳酸菌作为发酵蔬菜中的主要益生菌,在酸菜的整个发酵阶段占据着重要地位。由酸菜发酵过程中的理化指标可知,发酵后期(72 h)酸菜的pH值为3.53,亚硝酸盐含量降至2.67 mg/kg且趋于平稳,分析原因为乳酸菌对大肠杆菌等致病菌有拮抗作用,污染菌在酸性环境下不耐受导致死亡。张庆芳等[22]研究发现,pH<4.0时,乳酸菌降解亚硝酸盐进行酸降解阶段。因此推断在发酵后期(72 h)积累的乳酸菌加速了亚硝酸盐的降解,导致亚硝酸盐降至最低。本实验中酸菜发酵前期(SC1)和后期(SC2)共存在4种乳酸菌属,分别为魏斯氏菌属(Weissella)、明串珠菌属(Leuconostoc)、乳球菌属(Lactococcus)、乳杆菌属(Lactobacillus)。魏斯氏菌属作为发酵前期和后期含量最多的乳酸菌属,不仅能赋予发酵食品特殊的酸香风味,还能适应高浓度的盐或酸性环境,对延长发酵食品的保质期有重要的研究意义[23]。近期研究发现,从食窦魏斯氏菌(Weissella cibaria)获得的多糖合成基因簇可以提高植物乳杆菌(Lactobacillus plantarum)的益生特性[24]。明串珠菌属(Leuconostoc)也是众多发酵食品中的优势乳酸菌菌群,具有产酸、产甘露醇、产胞外多糖、抑菌等多种特性[25]。ZHANG Q等[26]从四川泡菜中分离出一株肠膜明串珠菌(Leuconostoc mesenteroides)LM187,具有良好的耐酸、耐胆盐和降胆固醇等特性。CIRRINCIONE S等[27]研究发现一株乳酸乳球菌(Lactococcus lactis)和一株鼠李糖乳杆菌(Lactobacillus rhamnosus)具有增强发酵驴乳抗氧化活性的功能。
大肠杆菌志贺菌属(Escherichia-Shigella)、Erysipelatoclostridium、肠杆菌属(Enterobacter)等部分致病菌在酸菜发酵前期(SC1)和后期(SC2)中也被检测,相对丰度为0.01%左右,推测为初始腌制环境或白菜本身所携带。大肠杆菌富含硝酸还原酶,而白菜本身含有硝酸盐,所以在发酵初期(0~12 h),大肠杆菌等小部分杂菌促进了亚硝酸盐的积累,使12 h达到亚硝酸盐峰值;12 h的OD600nm值降至最低值,分析可能为大量亚硝酸盐的抑菌作用导致此时细菌总数降至最低。
此外,通过观察发酵前后期各物种及丰度变化情况,发现门和属水平上相差不大。分析原因可能为本工艺在密闭发酵环境下进行,和传统开放式发酵环境不同,本工艺属于封闭系统,与外界没有物质交换,发酵前期菌群来自于环境、水及蔬菜自身所携带,导致发酵前后期各物种及丰度变化不大。
4 结论
本研究采用一种新工艺发酵制备东北酸菜,其发酵12 h(前期)和72 h(后期)时,理化指标(pH、亚硝酸盐、总酸)及OD600nm值变化明显,发酵前期酸菜样本的物种丰富度及多样性均高于发酵后期,两个样本在门和属分类学水平上的菌群差异不大,发酵前期样本共含7个门的44个菌属,发酵后期样本共含8个门的42个菌属。两样本均含有4种乳酸菌属,分别为魏斯氏属(Weissella)、明串珠菌属(Leuconostoc)、乳球菌属(Lactococcus)、乳杆菌属(Lactobacillus),其中魏斯氏属(Weissella)相对丰度均最高,达25%以上,且在发酵后期4种乳酸菌的相对丰度略有下降。本研究发酵体系可以极大程度缩短东北酸菜的发酵周期且亚硝酸盐含量低、乳酸菌含量丰富,对今后相关产品开发具有一定的意义。
