钆携带剂用于中子俘获治疗的现状及进展
2022-06-23崔大庆李纪元刘志博
韩 祎,崔大庆,2,*,李纪元,刘志博,4,*
1.中国原子能科学研究院 放射化学研究所,北京 102413;2.斯德哥尔摩大学 材料与环境化学系,瑞典 SE-106 91;3.北京大学 化学与分子工程学院,北京 100871;4.北京大学-清华大学生命联合中心,北京 100871
中子俘获治疗(neutron capture therapy, NCT)是一种二元的、分子靶向的放射治疗法,对局部侵袭性恶性肿瘤如黑色素瘤、胶质母细胞瘤和复发性头颈部肿瘤提供了良好的肿瘤控制治疗方案。它的原理是利用可以与中子发生俘获反应的核素,在反应后放出射线,从而杀死肿瘤细胞而使患者生存期得以延长,这促进了NCT的发展和临床应用。镧系元素Gd因其在4f壳层[1]有7个未配对电子,所以有着非常强的弛豫效应和顺磁特性。在稳定同位素中,157Gd(天然丰度15.7%),有着最大的反应截面σ值(254 000 b,1 b=10-28m2),在和中子发生俘获反应后,放出1 330 keV高能γ射线和低能电子。157Gd的高能γ射线辐射范围较广,穿透力强,可损伤肿瘤细胞,抑制肿瘤生长[2-3]。然而,由于钆发射的二次粒子谱的复杂性,包括瞬发γ射线、内转换电子、X射线和俄歇电子,限制了这种治疗[4]的选择性。近年来,人们通过对钆携带剂不同的修饰来提高GdNCT[5]的靶向性。
1 GdNCT原理
放射疗法主要利用电离辐射产生的生物效应,使肿瘤细胞膜上的蛋白质等大分子物质变性失活,造成细胞凋亡坏死。细胞死亡后释放的抗原又可以激发机体免疫反应,起到类似原位肿瘤疫苗的效果[6],而其中内照射疗法则是将放射源引入体内,尽可能进入肿瘤内或者贴近肿瘤,有效地杀死肿瘤细胞。
GdNCT作为新型内照射疗法的一种,不仅有着非常强的放射生物学效应(relative biologi-cal effectiveness, RBE),还有着高于传统放射疗法的靶向性。Gd元素有七种稳定同位素,包括152Gd(0.205%)、154Gd(2.23%) 、155Gd(15.10%)、156Gd(20.60%)、157Gd(15.70%)、158Gd(24.50%)和160Gd(21.60%)[6]。在这些核素中,157Gd和155Gd具有最大的中子反应截面,分别为25.4万巴和6.08万巴,是硼(10B)的66倍和16倍。Gd在俘获中子反应后的作用产物分别是高能γ射线、内转换(internal conversion, IC)电子、X射线和俄歇电子。γ射线和IC电子的平均能量分别约为1 330 keV和66.5 keV,它们的路径长度分别是几厘米和几毫米。俄歇电子是高传能线密度(linear energy transfer, LET)的低能电子,它在水溶液中的路径长度只有几个纳米,其RBE效应与γ射线相比,俄歇电子引起的脱氧核糖核酸(deoxyribonucleic acid, DNA)损伤是其5~10倍。但是以157Gd为例,由于俄歇电子电离辐射局限于分子尺寸,即5~40 nm,所以为了提高GdNCT对DNA的破坏性,在肿瘤细胞中,157Gd必须尽可能靠近细胞核。具体反应过程如图1所示[7]。

图1 157Gd的中子俘获反应示意图[7]Fig.1 Schematic diagram of neutron capture reaction of 157Gd[7]
2 GdNCT优势和局限性
为了进行准确的治疗,许多医学成像方法如计算机断层成像(computer tomography, CT)、正电子发射断层显像(polyethylene terephthalate, PET)[8]、荧光成像(fluorescence imag-ine, FI)[9]、核磁共振成像(magnetic resonance imaging, MRI)[10]和光声成像(photoacoustic imaging, PAI)均被应用于联合治疗。特别是MRI,由于其深穿透性、无侵袭性、无电离辐射累积及软组织高分辨率,是目前临床广泛应用的诊断技术。
为了进行准确的治疗,许多医学成像方法如计算机断层成像(computer tomography, CT)、正电子发射断层显像(polyethylene terephthalate, PET)[8]、荧光成像(fluorescence imag-ine, FI)[9]、核磁共振成像(magnetic resonanceimaging, MRI)[10]和光声成像(photoacoustic imaging, PAI)均被应用于联合治疗。特别是MRI,由于其深穿透性、无侵袭性、无电离辐射累积及软组织高分辨率,是目前临床广泛应用的诊断技术。
在MRI扫描过程中,扫描仪会发射出一个射频(radio frequency, RF)脉冲,导致一些元素比如氢质子发生激励而产生磁共振现象。弛豫是自旋释放从射频脉冲接收到能量的过程。这一过程所需的时间就是弛豫时间,弛豫时间分为自旋-晶格弛豫时间又称为纵向弛豫时间(T1),另一种是自旋-自旋弛豫时间又称为横向弛豫时间(T2),它们的值在很大程度上取决于化学环境和原子核。
Gd在所有元素中具有最大的纯自旋磁矩,使其在医学成像上有着突出的物理性质。Gd(Ⅲ)螯合物是T1最常见的临床MRI对比剂[2,10]。与其他T1对比剂相比,Gd螯合剂可以通过降低T1在组织中的弛豫常数来提高信噪比(signal noise ratio, SNR),即Gd螯合剂缩短了氢质子的纵向弛豫时间,从而获得了明显的成像对比效果。
尽管Gd在医学成像中具有突出的物理性质,但Gd基对比剂(gadolinium based contrast agency, GBCA)在脑内沉积和滞留,在临床应用中带来了关键的安全问题。此外,γ射线的放射生物学效应(relative biological effectiveness, RBE)与硼中子俘获治疗(BNCT)产生的α粒子的RBE相比不足,是GdNCT的另一个不可改变的缺点。在过去的几十年里,人们在如何提高钆释放剂的选择性和降低其毒性这一领域做出了许多努力。
3 早期钆携带剂的发展
使用Gd螯合物作为NCT治疗的最早报道,与商用MRI对比剂有关。Brugger研究组[11]第一个报道了Gd螯合物作为NCT钆携带剂应用。采用钆-二乙基三胺五乙酸(gadolinium diethylenetriaminepentaacetic acid, Gd-DTPA)和钆-1,4,7四氮杂环十二烷-1,4,7,10-四羧基(Gd-1,4,7,10-tetraazacyclododecane-N,N′,N,N′-tetraacetic acid, Gd-DOTA)(图2)通过静脉注射治疗小鼠脑肿瘤。实验证明,这些Gd携带剂可明显浓聚在脑肿瘤组织,达到每克肿瘤组织含Gd 300 μg。使用Gd-乙二胺四双亚甲基膦(gadoterate ethylenediaminetetramethylene phosphonic acid, Gd-EDTMP)可将此浓度提高至800 μg,并且肿瘤组织与正常组织在Gd的摄取量上显示极大的差别。对于含钆螯合物Gd-DTPA另一种相关动物实验使用的是大鼠延森肉瘤模型[12]。大鼠瘤内注射Gd-DTPA后,瘤内Gd的质量分数约为13 750×10-6,中子照射治疗后对肿瘤的杀伤效果显著增强(肿瘤生长下降至肿瘤完全消退约80%)。神田公司[12]在一份简短的通讯中也报道了在新西兰大白兔左股动脉分支连续注射Gd-DTPA的实验结果,虽然Gd含量在肿瘤和其相邻正常组织间的分布没有差异,但是与对照组相比,注射含Gd药物后的肿瘤在治疗后第16—23 d内生长明显受到抑制。最近,Hosmane等[13]观察到9L脑瘤大鼠静脉注射Gd-DTPA后,实验组平均生存(33.5±3.0) d,而对照组平均生存(16.4±0.6) d,GdNCT后的大鼠存活时间显著延长。
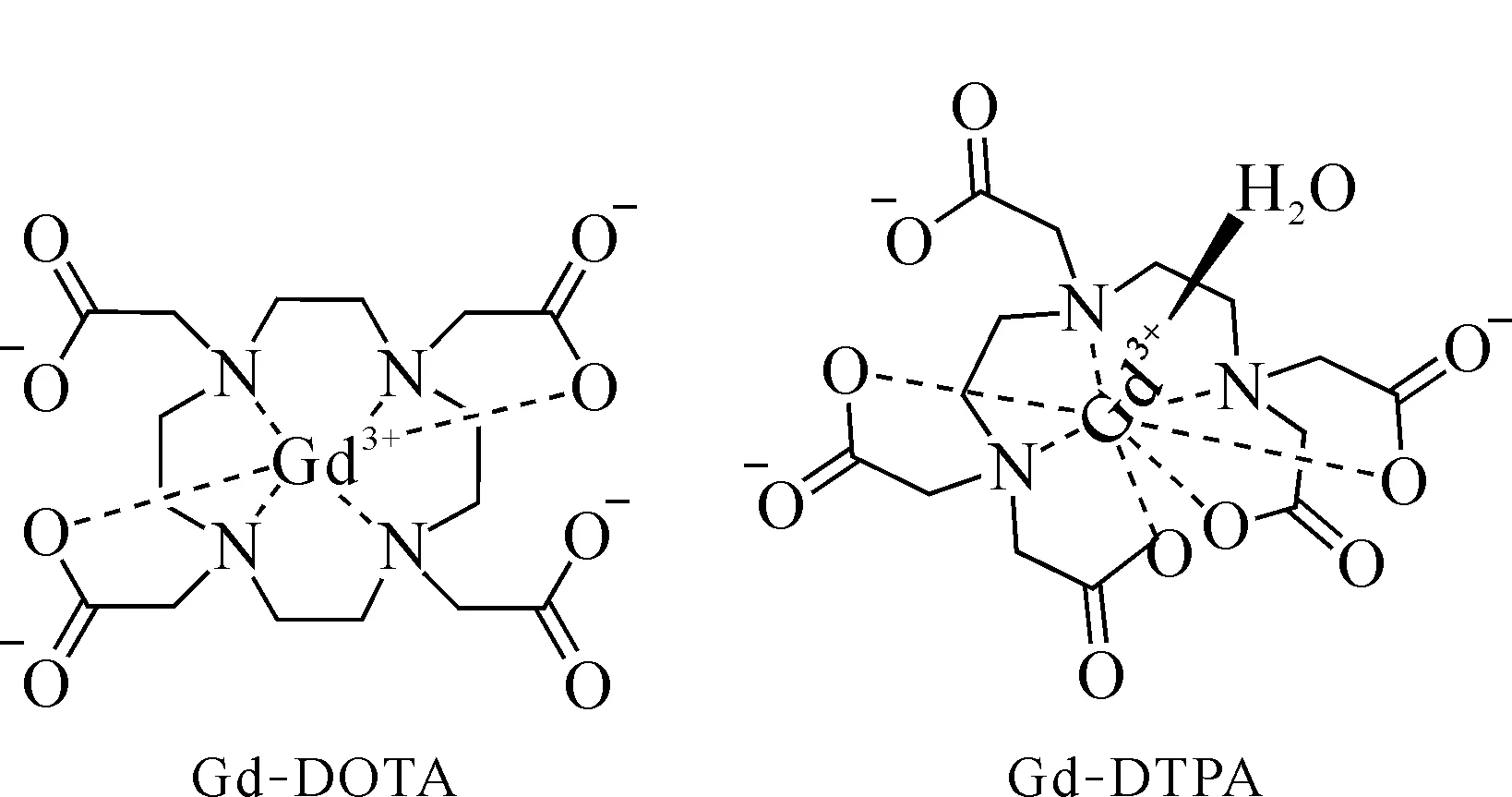
图2 简单157Gd螯合物的化学结构示意图[11]Fig.2 Chemical structures of gadolinium-based chelate complexes[11]
Gd-BOPTA(图3)是另一种临床使用的Gd MRI对比剂[14-15],实验采用四组大鼠肿瘤模型,分别注射相同剂量的Gd-BOPTA和Gd-DTPA。中子照射治疗后,明显发现Gd-BOPTA组的肿瘤生长缓慢。Gd-BOPTA的治疗效果强于Gd-DTPA的原因可能是:肿瘤对Gd-BOPTA选择性摄取量更高;Gd-BOPTA与白蛋白的结合力较弱,增加了Gd在肿瘤中的滞留;所以Gd-BOPTA在当时被认为是一种较有效的钆携带剂。

图3 Gd-BOPTA化学结构示意图[14]Fig.3 Chemical structures of Gd-BOPTA[14]
2010年,Rendina课题组[16]报道了第一个通过铂配合物将Gd接近肿瘤细胞核的例子。他们提出了一种新的Pt-Gd复合物(图4),通过功能化DTPA配体连接,可以有效地靶向肿瘤细胞的细胞核并以插入方式结合DNA。他们认为,因为PtDTPA较高的肿瘤细胞摄取率,从而使结合的Gd尽可能地接近肿瘤细胞DNA以充分利用GdNCT产生的俄歇电子RBE效应[12]。

图4 连接两个{PtⅡ (terpy)}(terpy=2,2′∶6′,2′-terpyridine) PtDTPA功能化的Pt-Gd复合物的化学结构[16]Fig.4 Chemical structure of the functionalized gadopentetate dimeglumine ligand linked to two {PtⅡ (terpy)} (terpy=2,2′∶6′,2′-terpyridine) PtDTPA[16]
4 钆携带剂研究现状
为提高肿瘤对钆携带剂的摄取率,现有通过构建叶酸受体[5]适配体、具有核穿透性的RGD(GRGDNP, RGD)肽[17]和肿瘤微环境(tumor microenvironment, TME)响应结构等提高其靶向性[2];通过脂质体包裹的钆化合物也被用来延长其在体内的循环时间[18-19]。此外,其他材料如低密度脂蛋白[20]、壳聚糖[21]、碳基纳米结构[22]和聚合物基结构[23]已被应用于增强GdNCT的治疗效果。
4.1 钆-硼中子俘获治疗
将硼中子俘获治疗(BNCT)与钆中子俘获治疗(GdNCT)相结合形成新的钆-硼中子俘获治疗(GdBNCT)方法显然可以弥补上述钆携带剂不足。两种不同的二次辐射模式的整合可以带来特殊的治疗效果。有两种可能的策略:第一种策略是同时使用两种NCT携带剂,一种携带10B,另一种携带157Gd;第二种策略是开发同时含有10B和157Gd化合物的中子俘获治疗药物。Crich课题组[24]开发了一种基于聚(乳酸-co-乙醇酸)(poly(lactic-co-glycolic acid),PLGA)和硼化姜黄素(boronated curcumin,图5)的治疗平台。

图5 叶酸偶联PLGA RbCur/Gd纳米颗粒(PLGA-NP-Folate)示意图[24]Fig.5 Schematic representation of folate conjugated PLGA RbCur/Gd nanoparticles(PLGA-NP-Folate)[24]
如体外实验所示,观察到该联合方法明显改善了肿瘤的治疗效果。与临床使用的硼携带剂硼苯丙氨酸(L-para-boronophenylalanine, BPA)相比,其肿瘤硼浓度含量更高(图6)[24]。对于第一个策略,Icten等[25]利用硼酸钆(gadolinium boron oxide, GdBO3)和Fe3O4的生物偶联来实现GdBNCT的治疗。其以Fe3O4、硼砂或硼酸和三价钆盐为原料,水热法制备纳米复合材料,然后用柠檬酸和异硫氰酸荧光素掺杂的二氧化硅进行生物偶联,最后用叶酸处理。其10B和157Gd的含量分别约为每微克1.8×1014和1.2×1014个原子。并且在HeLa和A549细胞上通过荧光显微镜和细胞流式仪,都证明了叶酸作为靶点的优秀靶向性。各项实验结果都证明GdBO3和Fe3O4生物偶联物是可用于靶向治疗、荧光成像和核磁共振成像的药物。
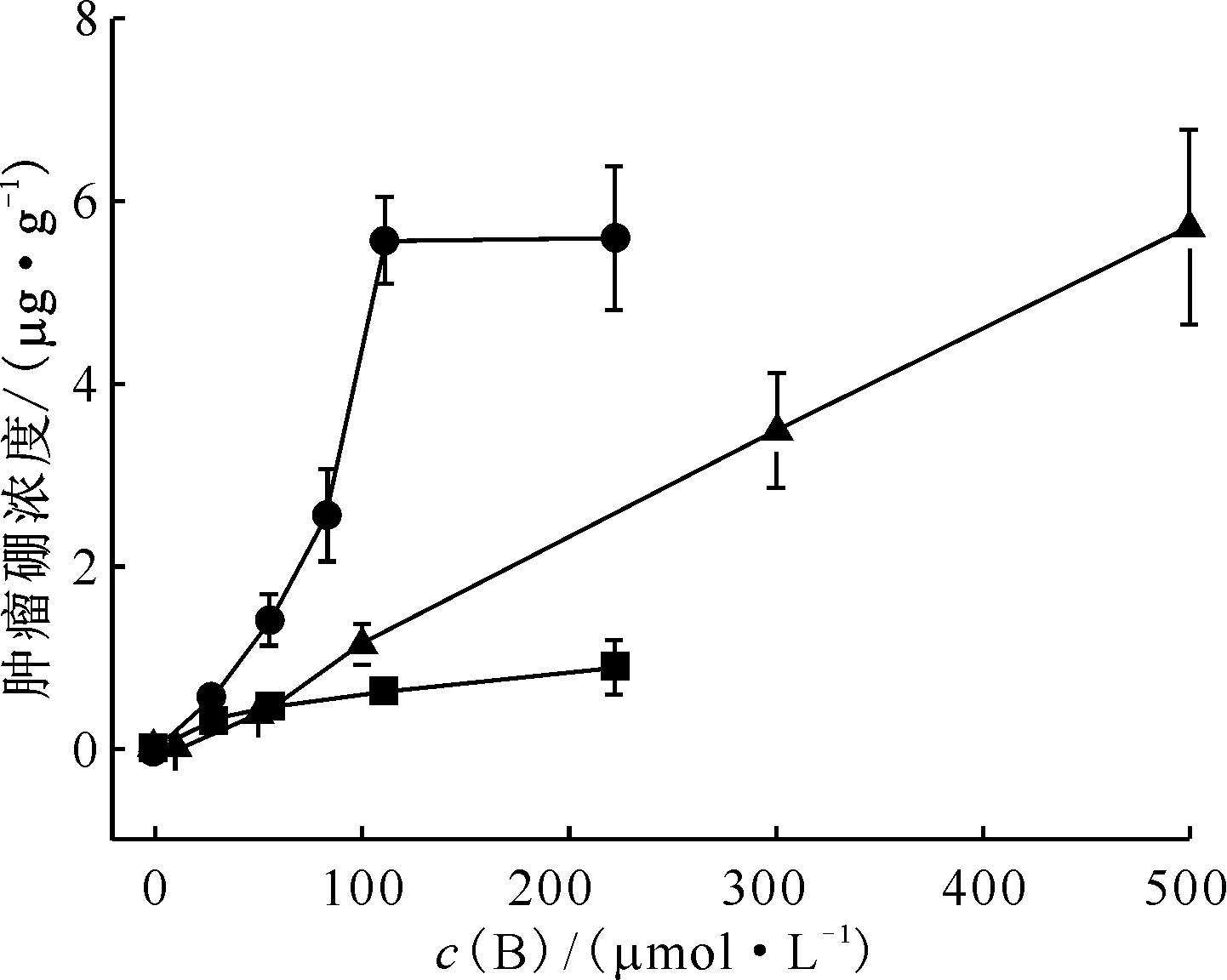
■——PLGA-NP-Ctrl,●——PLGA-NP-Folate,▲——BPA图6 在37 ℃下增加BPA浓度(10~500 μmol/L硼)孵育3 h或PLGA-NP-Ctrl或PLGA-NP-Folate(28~220 μmol/L硼)孵育6 h时IGROV-1细胞中的硼内化情况[24]Fig.6 Boron internalization in IGROV-1 cells on incubation in the presence of increasing BPA concentrations (10-500 μmol/L boron) for 3 h at 37 ℃ or with PLGA-NP-Ctrl or PLGA-NP-Folate(28-220 μmol/L boron) for 6 h at 37 ℃[24]
4.2 钆药物的多种构型
脂质体因其生物相容性、长循环特性和稳定体内载物的能力,在药物输送系统中具有重要意义。脂质体包裹的钆携带剂可以克服钆螯合物递送的各种困难,并获得更好的治疗结果。Langguth课题组[26]研究了脂质体Gd-DTPA的抗肿瘤疗效;脂质体大小约为136~152 nm,这样的尺寸避免了Gd-DTPA的过早释放;1 h后,大约50%的Gd-DTPA仍包裹在脂质体中。Ramaldes课题组[19]开发了具有放射性标记的159Gd-DTPA-BMA的脂质体(图7),他们发现该脂质体的细胞毒性大约是游离的Gd-DTPA-BMA的1 170倍。

图7 脂质体样品中159Gd的γ谱[19]Fig.7 Gamma spectrum of 159Gd in liposome sample[19]
Fukumori课题组[21]利用戊二醛作为交联剂,通过乳液法制备了高水溶性Gd-DTPA壳聚糖微球(CMS-Gd-DTPA),用于中子俘获治疗。红外光谱表明,壳聚糖与Gd-DTPA之间的静电相互作用加速了富钆壳聚糖微球的形成。CMS-Gd-DTPA中位直径为11.7 μm,含有11.6%(质量分数)的钆,可在瘤内注射后用于GdNCT。与单独Gd-DTPA相比,CMS-Gd-DTPA的钆体外释放明显延迟(图8)。
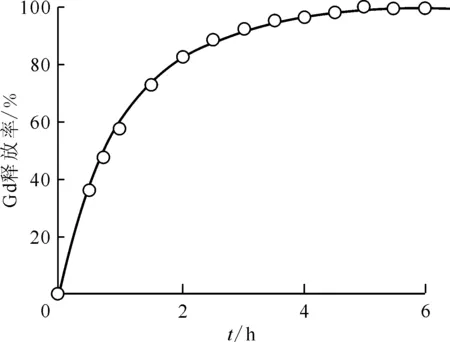
图8 CMS-Gd-DTPA和10 mL GST交联后的Gd体外释放实验(37 ℃,磷酸盐缓冲溶液(PBS,pH=7.4),Gd质量分数11.6%,平均粒径11.7 μm)[21]Fig.8 In vitro release profile of gadolinium from CMS-Gd-DTPA cross-linked with 10 mL GST having 11.6% of gadolinium and 11.7 μm of the mass median diameter in isotonic phosphate buffer solution(pH=7.4) at 37 ℃[21]
金属富勒烯笼中含有一个或多个金属原子,是一类具有不同寻常的电子和磁性的新型材料。长崎课题组[22]发现构建Gd@C82可以像溶解C60等富勒烯一样,加入PEG-b-PAMA使其易溶于水,形成一个透明、复杂的直径约20~30 nm的轭合物(图9)。中子辐照用Gd@C82-PEG-b-PAMA纳米颗粒孵育colon-26腺癌细胞后,该肿瘤细胞绝大部分被杀死,并且本研究中的含Gd纳米粒子(GdNPs)在细胞毒性实验中,细胞存活率与对照组相比没有差别,比以前报道的钆携带剂毒性要小得多[23]。

图9 GdNPs制备工艺示意图[22]Fig.9 Schematic of the preparation process of GdNPs[22]
4.3 刺激响应型药物递送
磷酸钙(calcium phosphate tribasic, CaP)纳米颗粒作为人类骨骼和牙齿的无机矿物,具有较高的生物相容性和良好的生物降解性,因此其在医疗领域的应用越来越受到关注。它不容易被微生物降解,但是在pH=7.4时可适度溶解,在pH≤6可逐渐溶解,所以CaP纳米颗粒在递送到细胞时仍可保持完整,而细胞进入内溶酶体后由于pH降低所以迅速溶解,这使得它在药物递送方面具有极大的潜力。Kataoka课题组[27]构建了磷酸钙胶束与聚阴离子嵌段共聚物杂交,并与临床MRI对比剂Gd-DTPA/CaP相结合(图10)。细胞毒性实验中Gd-DTPA/CaP在100 μmol/L下对癌细胞无毒,而在此浓度下,超过50%的癌细胞在热中子照射后被杀死。此外,由于Gd-DTPA/CaP在肿瘤中的摄取量显著增加,因此可通过MRI来精确定位肿瘤位置(图11)。

图10 Gd-DTPA/CaP复合胶束靶向肿瘤GdNCT方案[27]Fig.10 Scheme of Gd-DTPA/CaP hybrid micelles targeting tumors for GdNCT[27]

○——Gd-DTPA/CaP+热中子照射,□——Gd-DTPA+热中子照射,△——Gd-DTPA/CaP,×——Gd-DTPA图11 Gd-DTPA/CaP在体内MR成像引导下的中子俘获治疗[27]Fig.11 In vivo MR imaging-guided neutron capture therapy with Gd-DTPA/CaP[27]
4.4 活性导向性药物
环状RGDs(cRGDs)是一种含有一系列精氨酸(Arg)-甘氨酸(Gly)-天冬氨酸(Asp)作为环状成分的三肽,它通过结合αvβ3和αvβ5整合素来靶向肿瘤,这些整合素在肿瘤血管生成位点并在肿瘤细胞中过表达。RGDs之所以吸引人是因为它们比抗体小,容易通过化学方法大规模合成,具有低毒性和低免疫原性,可以很容易地偶联到纳米系统上达到成像和治疗的目的。Lee课题组[17]用环状RGDs作为肿瘤靶向配体,包覆超微氧化钆纳米颗粒(GNPs,粒径为1.0~2.5 nm)(图12)。涂层中使用了五种商用cRGD。通过一锅法合成了cRGD包覆的GNPs (cRGD-GNPs)。它们的纵向水质子弛豫度r1值为10.0~18.7/(s·mmol/L),r2/r1值为1.4~1.7(r2为横向水质子弛豫度),是Gd螯合物的3~5倍。使用制备五种cRGD-GNPs样品溶液中的一种,在肝脏肿瘤模型小鼠上进行T1MRI成像,证实了cRGD-GNPs的肿瘤靶向性[17]。静脉注射该溶液后对感兴趣区域(region of interested, ROI)的信噪比(SNR)进行研究,如图13,T1MRI图像中观察到肝脏肿瘤区摄取量约是正常部位的3倍。这些结果表明,cRGD-GNPs是潜在的具有肿瘤靶向性的诊疗一体化药物。
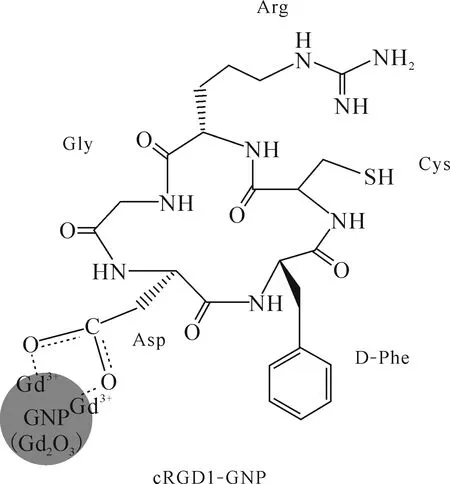
图12 cRGD1-GNP表面包被结构[17]Fig.12 Surface-coating structure of the cRGD1-GNP[17]
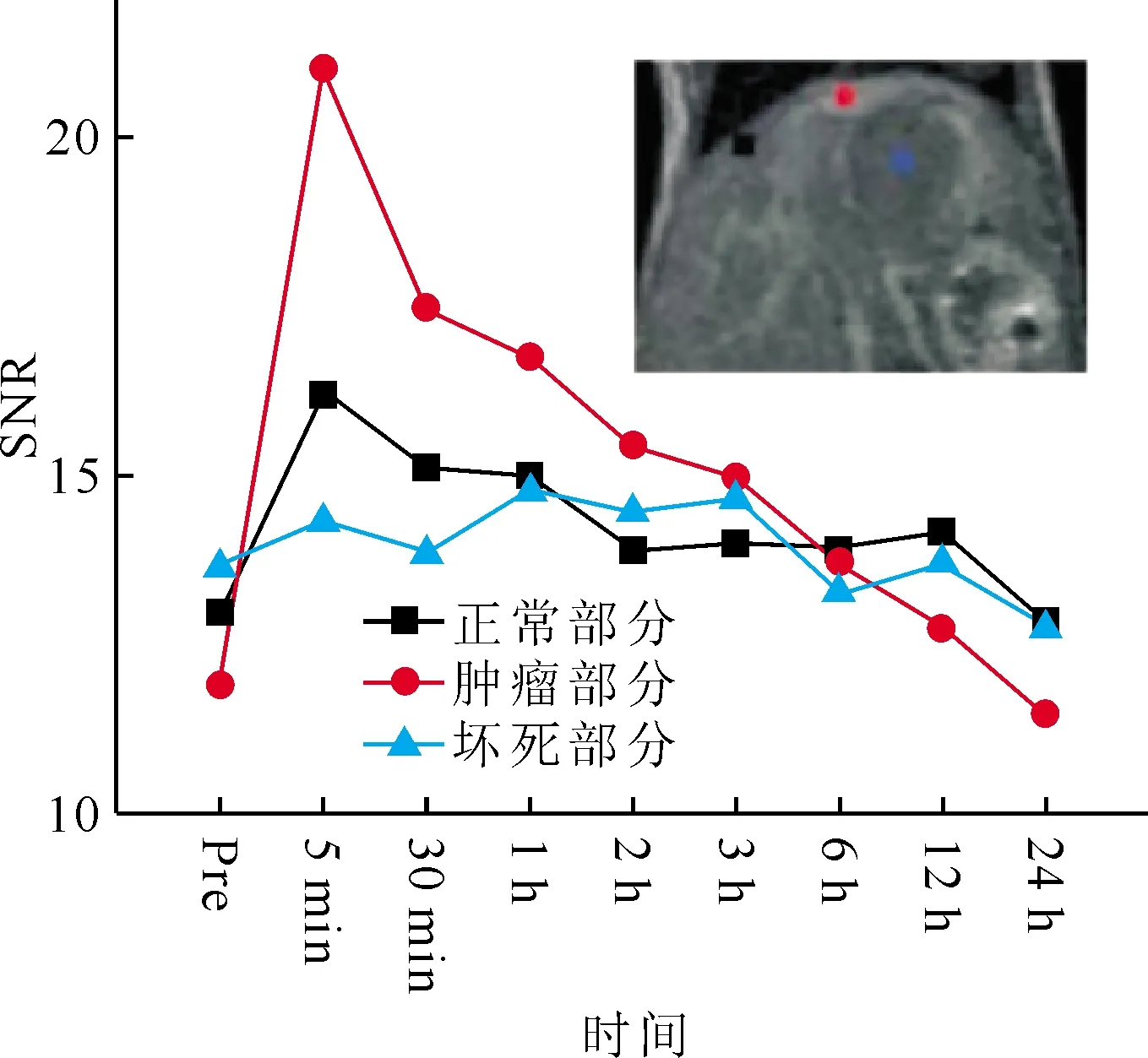
Pre代表静脉注射后成像图13 肝脏正常部分、肿瘤部分、坏死部分ROI的信噪比随时间变化图[17]Fig.13 Plots of SNRs of ROIs in the normal part, the tumor part, and the necrotic part of the liver as a function of time[17]
5 结 论
Gd在NCT中的应用因其具有较高的中子截面和良好的MRI成像而倍受关注。虽然GdNCT早在多年前就被提出,但由于缺乏具有较高肿瘤选择性的钆携带剂,使GdNCT发展滞后。为了充分利用俄歇电子的RBE效应,需要合成能够尽可能靠近细胞DNA的新型钆携带剂。现有钆携带剂的报道也为我们解决GdNCT问题提供一些发展思路,例如使用靶向性载体,可以大大提高肿瘤对钆携带剂的摄取,延长其滞留时间;利用钆的治疗特性,通过测量局部Gd浓度来优化中子辐照时间和传递的辐射剂量;可以联合应用BNCT和GdNCT,这样可避免肿瘤复发的几率,提高治疗肿瘤的效果。
