神经精神药理学治疗药物监测共识指南:2017版
2022-06-23C.Hiemke,N.Bergemann,H.W.Clement等
作者C.Hiemke1,2,N.Bergemann3,H.W.Clement4,A.Conca5,J.Deckert6,K.Domschke7,G.Eckermann8,K.Egberts9,M.Gerlach9,C.Greiner10,G.Gründer11,E.Haen12,U.Havemann-Reinecke13,G.Hefner14,R.Helmer15,G.Janssen16,E.Jaquenoud17,G.Laux18,T.Messer19,R.Mössner20,M.J.Müller21,M.Paulzen11,B.Pfuhlmann22,P.Riederer6,A.Saria23,B.Schoppek24,G.Schoretsanitis25,M.Schwarz26,M.Silva Gracia12,B.Stegmann12,W.Steimer27,J.C.Stingl10,M.Uhr28,S.Ulrich29,S.Unterecker6,R.Waschgler30,G.Zernig23,31,G.Zurek32,P.Baumann33
主译李文标34
译者果伟34,贺静34,鲍爽34,路钊34,牛梦溪34,阮灿军34,臧彦楠34,王勇35,张玲34,刘辰庚34,李洁35
审校汤宜朗36,37,王传跃34,王刚34
作者单位
1.Department of Psychiatry and Psychotherapy,University Medical Center of Mainz,Mainz,Germany
2.Institute of Clinical Chemistry and Laboratory Medicine,University Medical Center of Mainz,Mainz,Germany
3.Kitzberg Hospitals,Center for Psychosomatic Medicine and Psychotherapy,Bad Mergentheim,Germany
4.Department of Child and Adolescent Psychiatry,University of Freiburg,Freiburg,Germany
5.Servizio Psichiatrico del Comprensorio Sanitario di Bolzano,Bolzano,Italy
6.Department of Psychiatry,Psychotherapy and Psychosomatics,University Hospital of Würzburg,Germany
7.Department of Psychiatry and Psychotherapy,Medical Center-University of Freiburg,Faculty of Medicine,University of Freiburg,Freiburg,Germany
8.Psychiatric Hospital,Kaufbeuren,Germany
9.Department of Child and Adolescent Psychiatry,Psychosomatics and Psychotherapy,Center of Mental Health,University Hospital of Würzburg,Germany
10.Federal Institute for Drugs and Medical Devices (BfArM),Bonn,Germany
11.Department of Psychiatry,Psychotherapy and Psychosomatics,RWTH Aachen University,Aachen,and JARA -Translational Brain Medicine,Aachen,Germany
12.Clinical Pharmacology,Department of Psychiatry and Psychotherapy and Department of Pharmacology and Toxicology,University of Regensburg,Regensburg,Germany
13.Department of Psychiatry and Psychosomatics,University of Göttingen,Göttingen,Germany
14.Psychiatric Hospital,Vitos Klinik,Eichberg,Eltville,Germany
15.Center of Epilepsy,Bielefeld,Germany
16.Medical Laboratory Stein,Limbach Group,Mönchengladbach,Germany
17.Psychiatric Hospital,Königsfelden,Brugg,Aargau,Switzerland
18.Institute of Psychological Medicine,Haag in Oberbayern,Germany
19.Danuviuskliniken,Psychiatric Hospital,Pfaffenhofen,Germany
20.Department of Psychiatry and Psychotherapy,University of Tübingen,Tübingen,Germany
21.Psychiatric Hospitals Oberberggruppe,Berlin,Germany
22.Psychiatric Hospital Weisser Hirsch,Dresden,Germany
23.Experimental Psychiatry Unit,Department of Psychiatry1,Medical University of Innsbruck,Innsbruck,Austria
24.kbo-Isar-Amper Klinikum München-Ost,Psychiatric Hospital,Munich-Haar,Germany
25.Department of Psychiatry,University of Bern,Bern,Switzerland
26.Department of Laboratory Medicine,Ludwig Maximilian University,Munich,Germany
27.Institute of Clinical Chemistry and Pathobiochemistry,Technical University Munich,Munich,Germany
28.Max Planck Institute of Psychiatry,Munich,Germany
29.Aristo Pharma GmbH,Berlin,Germany
30.Psychiatric Hospital,Feldkirch,Austria
31.Private Practice for Psychotherapy and Court-Certified Witness,Hall in Tirol,Austria
32.Medical Laboratory Bremen,Bremen,Germany
33.Department of Psychiatry,University of Lausanne,Prilly-Lausanne,Switzerland
译者及审校者单位
34.中国 北京 首都医科大学附属北京安定医院,国家精神心理疾病临床医学研究中心,精神疾病诊断与治疗北京重点实验室
35.中国 天津 天津市安定医院
36.Department of Psychiatry and Behavioral Sciences,Emory University School of Medicine,Atlanta,USA
37.Atlanta VA Medical Center,Decatur,GA,USA
(上续本刊2022年1期20页)
2.2 剂量相关参考浓度范围
对于TDM结果的解释,除了治疗参考浓度范围外还有另一个浓度范围,即所谓的剂量相关参考浓度范围。治疗参考浓度范围的应用是药效动力学问题,而剂量相关参考浓度范围的运用是药代动力学问题。后者比较的是测得的药物浓度与理论预期药物浓度范围。参照药代动力学研究,优先考虑没有合并用药或药物基因组异常的患者群(“正常”患者),在日维持剂量(Daily maintenance dose,Dm)、给药间隔(Dosing interval,di)、总清除率(Total clearance,CL)和生物利用度(Bioavailability,F)已知情况下,某种药物在某个“正常”患者体内的预期平均稳态浓度(Average steady-state concentration,Cav)可通过下面的公式计算:
Cav=(Dm/di)×(F/CL)
(1)
剂量和给药间隔可以从处方中获得,药代动力学参数可以从药代动力学试验中获得。通过日剂量(1 mg/24 h=1 000 000 ng/1 440 min)和文献中获得的总表观清除率CL/F(ml/min)的标准差(Standard deviation,SD),可以通过公式(1)计算出Cav±SD(ng/ml)。计算的过程中,必须注意不同参数的计量单位,所有剂量单位必须换算为ng,所有体积单位换算为ml,时间单位换算为min。例如:文献报道某药物的CL/F值是(100±50) ml/min,表观清除率的变异系数为50%,日剂量为20 mg/d时,其Cav值为139 ng/ml{20 000 000 ng/1 440 min×[1/(100 ml/min)]=139 ng/ml}。Cav的标准差为69 ng/ml,Cav±SD范围为69~208 ng/ml。假设给药间隔是24 h,1次/d给药,Haen等建议把Cav±SD的范围作为剂量相关参考浓度范围[470-471]。均值减去SD值为这一范围的低值,而均值加SD值为这一范围的高值。统计发现,这个范围覆盖了18~65岁人群正常条件下68%血药浓度范围。2011版共识指南[524]从文献中提取到83种神经精神药物的表观总清除率(CL/F)数据±SD,用于计算剂量因子。用日剂量乘以这些因子(F/CL)±SD,即可获得剂量相关参考浓度范围,并可用于TDM结果的解释(见表5)。当患者的血药浓度测得值在剂量相关参考浓度范围内时,就认为患者的血药浓度正常。可以认为高于或低于这个范围的血药浓度就提示可能存在潜在的异常情况,诸如依从性差、药物相互作用、药物代谢酶的基因多态性或者与药物排泄相关的器官存在病变。
剂量相关参考浓度范围的概念非常有用。许多依从性差或药代动力学异常的患者都能被鉴别出来[470]。当给药间隔小于药物的消除半衰期(t1/2)时,平均稳态血药浓度公式既有效又有用。然而,当半衰期短,而且给药间隔长于t1/2时,用等式(1)计算的值就难以预测TDM所用的Cmin值。图3以丙戊酸为例对这个问题进行了解释。丙戊酸的t1/2是14 h,服用方式是1次/d或2次/d。
日剂量900 mg,通过公式(1)计算的丙戊酸剂量相关参考范围是(94±35)μg/ml,与给药间隔无关。然而,药-时曲线显示,如果1次/d或2次/d给药,给药剂量为900 mg,则丙戊酸谷浓度明显低于Cav[(49±15)μg/ml]。

图3 丙戊酸日剂量900 mg给药间隔时间为12 h(实线,Cmin1)和24 h(虚线,Cmin2)达到稳态后的预期血药浓度-时间曲线。丙戊酸的平均消除半衰期(t1/2)是14 h。圆圈和误差线表示的是预期谷浓度(Cmin)和平均浓度(Cav)±标准差(SD)
如果2次/d给药,每次给药剂量为450 mg,则Cav值为(69±25)μg/ml。Cav范围明显更接近给药间隔小于14 h的Cmin值。因此,计算的Cav被认为是预测血药浓度比较合适的指标。然而,在1次/d的给药条件下,最后一次服药后24h的Cmin比平均Cav低54%。结果表明,当用等式(1)计算剂量相关参考浓度范围时必须考虑上述局限性。依赖于给药间隔这一缺陷可能与很多药物有关,如度洛西汀、帕罗西汀、文拉法辛、氨磺必利、帕利哌酮、喹硫平、锂、丙戊酸、佐匹克隆、托莫西汀或纳曲酮。当给药间隔大于t1/2时,Cmin的计算值比Cav低30%以上。总的来说,表5中32%的化合物符合上述特征。
此外,基于Cav的计算还有另外一个缺陷。剂量相关参考浓度范围的正确性难以通过检测来验证,而Cmin与此相反,易于检测验证,因为TDM是基于对药物最低血中浓度(谷浓度)的检测而得到的。Cav是由药时曲线下面积(AUC)除以给药间隔时间计算出来的。它不像Cmin那样有明确的静脉采血时间点。基于Cav的计算还有一个缺陷,就是它忽视了药物浓度在1 d内的波动(如图3所示),而这些波动与药物的耐受性和疗效有关[206]。
因为这些缺陷,本次更新决定对剂量相关参考浓度范围的计算进行修改。不用去纠结药代动力学教科书中描述的细节(见文献[77,306]),稳态浓度可以通过公式(1)的扩展式或运用Bateman方程来计算。Gex-Fabry等[404]使用这一方法描述了药物吸收后时相的变化规律,也就是tmax(药物峰浓度的时间点)和tmin(Cmin的时间点)之间的时间间隔,计算消除相的药物浓度。
假设为一室模型,并且药物浓度呈指数下降,吸收后时相任何时间点的预期稳态药物浓度Ct可以按照下式计算:
Ct =[(Dm/di)×(F/CL)]×[(ke×di)/(1-e-ke×di)]×(e-ke×t)
(2)
式中,Dm是稳态浓度下的剂量,称为维持剂量;CL/F是表观总清除率(为了计算方便使用其倒数);di是给药间隔时间;ke是消除速率常数,可以用消除半衰期t1/2按照公式ke= ln2/t1/2求出来;t是采血时间。
假设di为24 h,t是最后一次服药到采血的时间间隔,即△t,可用下面的公式(3)估算预期Cmin:

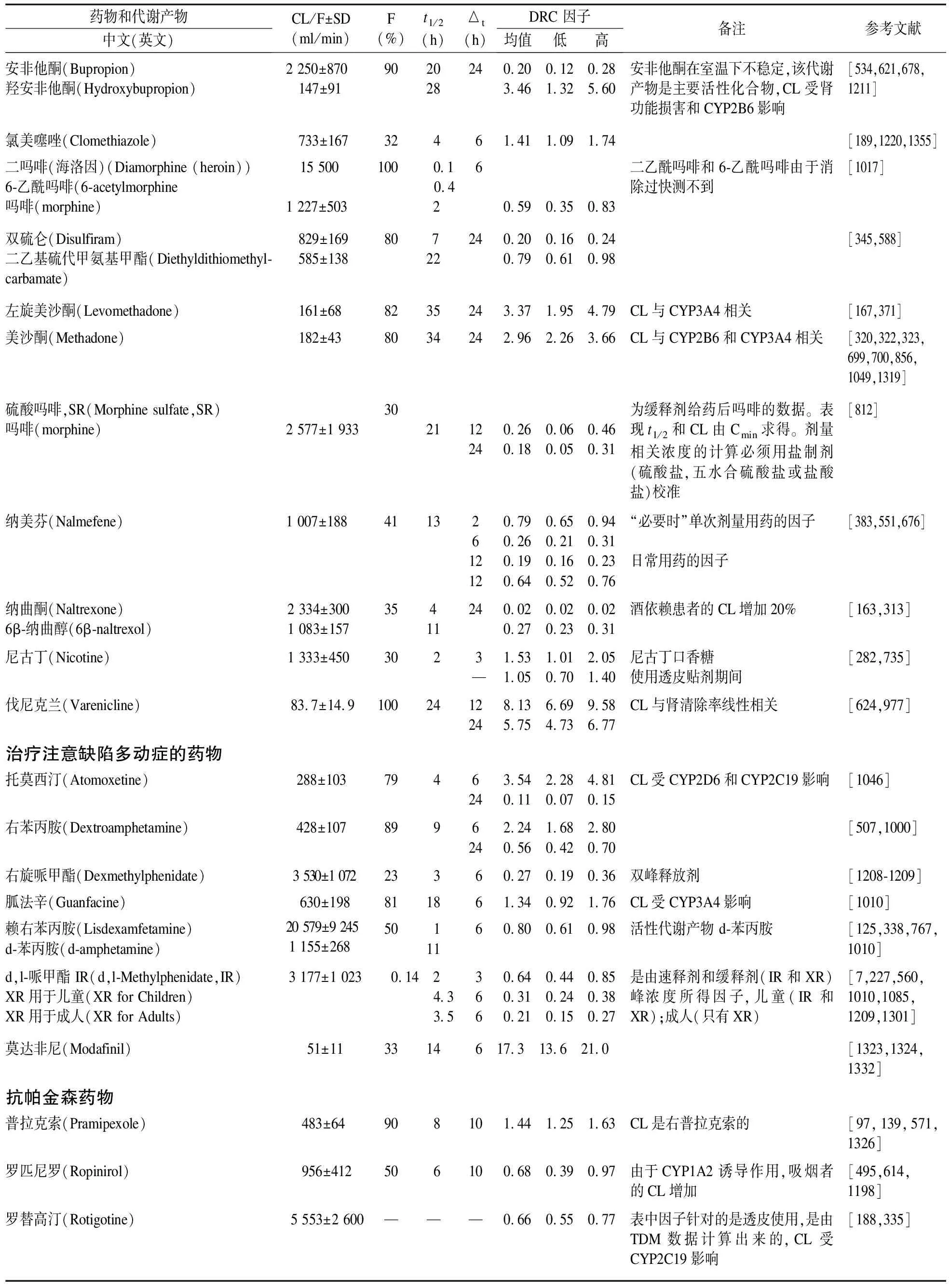
表5 表观总清除率(如清除率/生物利用度、CL/F)、生物利用度(F)、平均消除半衰期(t1/2)末次服药至采血间隔时间(△t)和用于计算母药、代谢产物和活性部分的剂量相关参考浓度范围的剂量相关浓度(DRC)因子

续表5

续表5

续表5
续表5
Cmin=(Dm/24)×(F/CL)×[(ke×24)/(1-e-ke×24)]×(e-ke×△t)
(3)
TDM检测的预期药物浓度就可以用日剂量、CL/F、t1/2和末次给药与抽血之间的间隔时间Δt 计算出来。与计算Cav一样,药代动力学参数CL/F和t1/2可以从药代动力学试验中获得,日剂量和Δt由处方医生确定。
运用公式(3)的一部分,可以用软件,如MS-Excel软件,确定和计算出已知CL/F和t1/2药物的DRC因子。
DRC因子=(F/CL) × [(ke × 24)/(1-e-ke×24)] × (e-ke ×△t)
(4)
剂量确定后,预期Cmin可以用DRC因子乘以日剂量计算出来。预测Cmin理论预期值与Cav相比是更加复杂的计算过程,并且需要使用t1/2,而它在个体间也有差异。由于引起t1/2差异与引起清除率差异的因子可能是相同的,所以TDM指南假设在一组依从性好的患者中测得的血药浓度的平均值的SD反映了表观总清除率(CL/F)的正常变异。基于这一假设,认为群体CL/F的个体间差异等于Cmin的差异。文献中报道的CL/F的SD就可以转化成Cmin,用于计算剂量相关参考浓度范围的均值±SD,与前面基于Cav的计算相同[471]。已经对这种计算方法是否能够预测血药浓度进行了实际的测试。
表5列出了包括母药、代谢产物和活性部分在内的172种化合物的DRC因子。这些因子采用文献报道的药代动力学数据,并用公式(4)计算而来。按照药物使用推荐方案,确定Δt。西酞普兰或文拉法辛缓释剂(XR)每天早晨使用1次,Δt就是24 h。像阿米替林这类药物,一般是早晨和晚上各用1次,Δt就定为12 h。像镇静催眠药是睡前给药,早晨抽血,Δt就定为10 h。表中列出的因子可用于计算血药浓度范围的下限和上限值。用DRC低因子(DRC因子-SD)和DRC高因子(DRC因子+SD)分别乘以日剂量就可以得到剂量相关参考浓度范围。当每天用药1次或2次时,表5分别列出了Δt是12 h和24 h的DRC因子。氯美噻唑或莫达非尼这类不在tmin测定血药浓度的药物,表5提供了建议采血的时间点的DRC因子。
根据公式(2)到公式(4),以及文献中报道的有关正常患者药代动力学研究得到的药代动力学参数CL/F和ke,还有药品生产厂家提供的药品说明书(SPC)中建议的给药间隔时间和日剂量进行的这些计算的有效性,采用实际获得的TDM研究中报告的正常患者Cmin值进行对照比较,来评价其合理性。如果理论值得到实际数据的证实,那么计算的剂量相关参考浓度范围就被采纳。如果实际的平均Cmin落在理论上的剂量相关参考浓度范围内,就属于这种情况。
如果Δt与表5所列数值不同,可用公式(2)计算出吸收后时相(从峰浓度时间点算起)任何时间点的预期血药浓度。
源自最初平均药物浓度的剂量相关参考浓度范围的概念[471],现在把剂量相关参考浓度范围定义为Cmin的范围,可以用处方剂量和药代动力学参数计算出来。
定义
本版指南报道的“剂量相关参考浓度范围”是指某种药物在稳态浓度下谷浓度均值±SD。均值±SD包含了服用药物的“正常”患者群体浓度的68%。所谓“正常”患者是指年龄在18~65岁,体重70kg,没有药代动力学相关合并症、合并用药或影响药物代谢的遗传变异的患者。剂量相关参考浓度范围可由DRC低因子和DRC高因子乘以日剂量获得。
剂量相关参考浓度范围是辨别血药浓度异常患者的识别性参考范围。开展TDM工作时,TDM实验室报告的实测血药浓度应该与运用本指南表5中的数据计算出来的理论值进行比较(参见后面的实例)。当患者的血药浓度落在预期剂量相关参考浓度范围内时,可以认为这个浓度是“正常”的,也就是说浓度与处方剂量相符。高于或低于预期范围的浓度提示存在潜在的异常,如部分不依从、药物-药物相互作用、药物代谢酶的基因多态性或与药物消除相关器官的疾病。这种异常可能约占患者的1/3。因此,均数±SD的范围(覆盖68%的患者)被认为是“正常”患者的范围。这一假设的价值仍然需要研究证实。一旦观察到异常情况,TDM临床药理学意见(见下文)中需对可能的理由加以阐述,并且应该阐明其原因。
2.3 血药浓度与剂量的比值(C/D比值)
血药浓度与剂量的比值(Cmin/D,常缩写为C/D)是分析药代动力学异常的又一个参数[271,500]。采用TDM数据,用药物的稳态谷浓度除以患者的用药剂量可以很容易地计算出C/D比值。C/D比值与总消除率成反比[271,292]。高C/D比值表明药物消除慢,低C/D比值表明药物消除快。
通过不同患者组别的比较,C/D比值可以辨别药物-药物相互作用[169,586,918,1054-1055]。Jerling等测定了个体内阿米替林和去甲替林C/D比值,发现了左美丙嗪、奋乃静和卡马西平的相互作用效应,通过联用与不联用这些药物印证了以前的C/D比值结果[573]。通过多次检测相同患者的C/D比值,还有助于鉴别患者对药物(如氯氮平)的部分不依从[1142]。个体内C/D比值的变异应小于20%。超过20%的变异提示存在依从性问题或药物-药物,药物-食物,或药物-疾病相互作用导致的药代动力学改变。
C/D比值还可以用于估算达到预期靶值血药浓度所需要的剂量[48]。举例来说,某药C/D比值的测得值是0.5 (ng/ml)/mg,治疗参考浓度范围是30~100 ng/ml,要达到30 ng/ml的靶值浓度所需日剂量是60(=30/0.5)mg;要达到100 ng/ml所需日剂量就应该是200(=100/0.5)mg。
2.4 代谢产物与母药的比值
神经精神药物经I相代谢酶作用的生物转化可以产生与母药具有相似或不同药效学特性的代谢产物。代谢产物具有相似药理学性质的实例有:去甲替林(母药是阿米替林)、N-去甲多塞平(母药是多塞平)、地昔帕明(母药是米帕明)、去甲氟西汀(母药是氟西汀)、O-去甲文拉法辛(母药是文拉法辛)和9-羟利培酮(母药是利培酮)。这些药物的母药与活性代谢产物浓度之和(活性部分)可用于TDM指导下的剂量调整。代谢产物与母药相比具有不同药理学性质的实例有:卡马西平-10,11-环氧化物(比卡马西平毒性更大),N-去甲氯米帕明(具有去甲肾上腺素能活性,母药是氯米帕明),N-去甲氯氮平(具有拟胆碱能活性,母药是氯氮平),N-脱烃基喹硫平(具有去甲肾上腺素能活性,母药是喹硫平)。奥氮平、舍曲林和西酞普兰的主要代谢产物对母药的药效或耐受性似乎没有贡献。如果代谢产物缺乏药理活性,测定代谢产物似乎是没用的。但是,从药代动力学的角度来看,测定有活性和无活性代谢产物都可以提供有用的信息。代谢产物与母药的比值(MPR)是对体内代谢酶活性的直接测量[265,580,602,693,759,760,1074]。当特定的CYP同工酶是参与I相代谢的主要酶时,MPR甚至可以反映这种CYP酶的表型(见表6)。MPR可以鉴别药代动力学相互作用与遗传变异导致的异常代谢。对文拉法辛和利培酮而言,MPR低是CYP2D6酶弱代谢(PM)基因型的指标。该指标区分PM基因型与EM基因型的敏感度是91%[759]。高MPR代表酶活性增强,表明患者处于超快代谢(UM)状态。另外,酶诱导效应,如吸烟诱导CYP1A2,也可以依据MPR的增强效应辨别出来。已有多篇文章报道了如何运用N-去甲舍曲林与舍曲林的MPR鉴别患者对舍曲林的依从性[173,985,1023]。
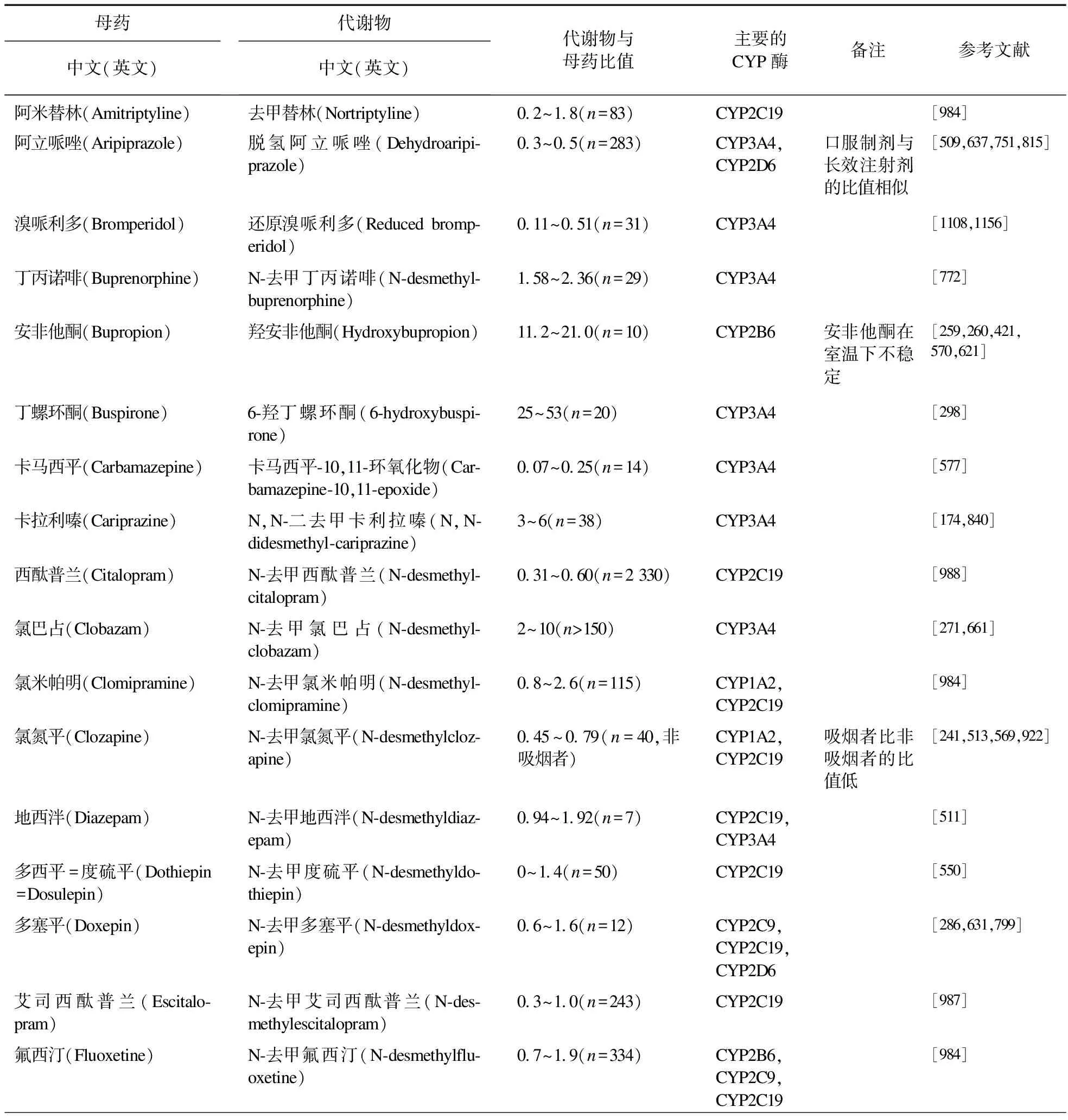
表6 神经精神药物代谢产物与母药的比值(MPR)。MPR范围是稳态谷浓度下比值的均值-SD与比值的均值+SD之间的范围
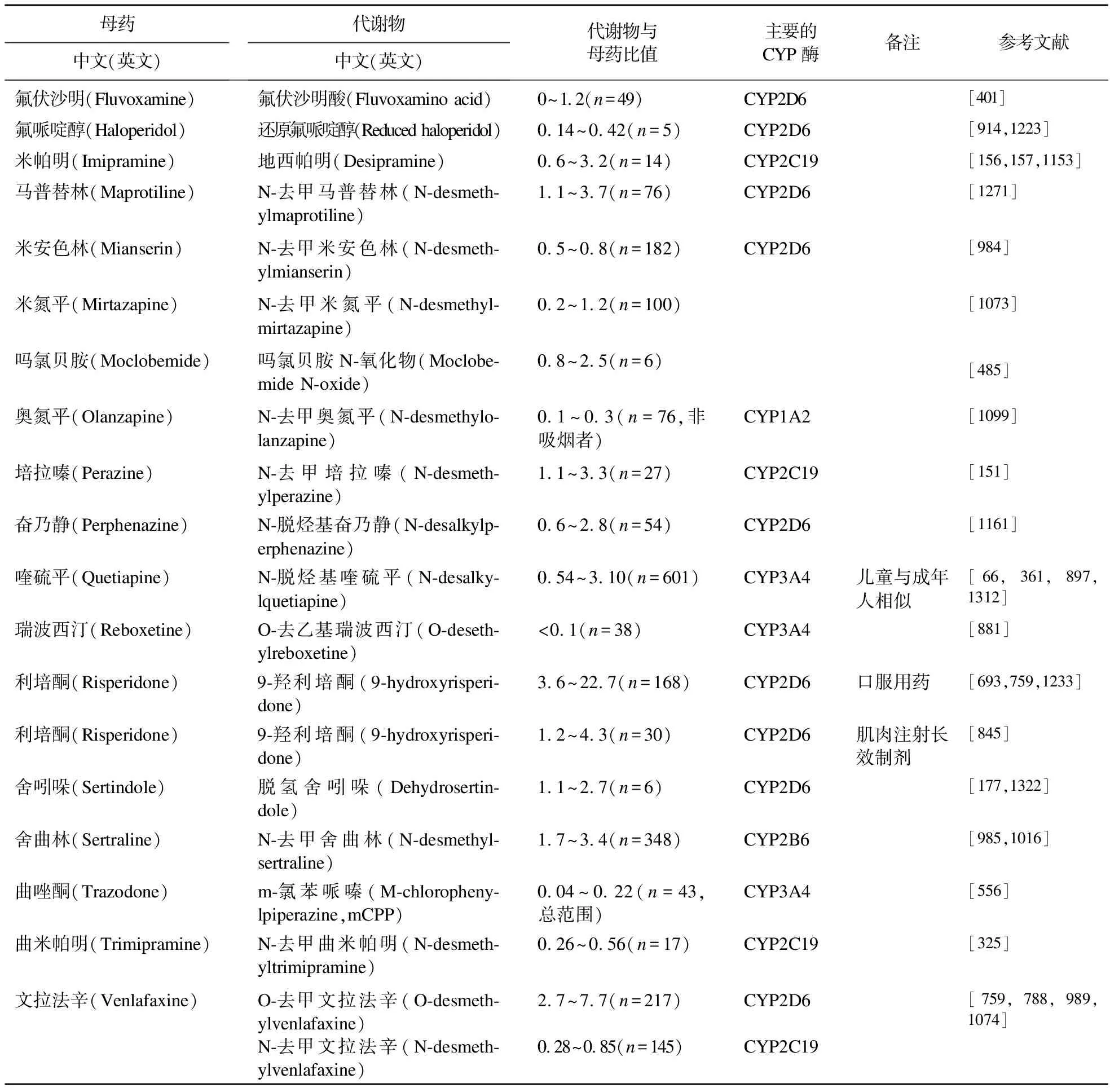
续表6
采用MPR确定患者的代谢表型时,必须严格控制混杂因素,以免得出错误的结论。特别是当母药和代谢产物的消除半衰期不同时,正确的采样时间至关重要。
采用MPR预测CYP基因变异的有效性已在利培酮和文拉法辛上得到证实[602,760,1074,580,759]。就利培酮和它的代谢产物9-羟利培酮而言,对CYP2D6酶区分EM和PM的MPR截断值是1.0,灵敏度是91%,特异度是86%,阳性预测值是35%,而阴性预测值是99%[759]。文拉法辛与其代谢产物O-去甲文拉法辛的情况与此相似。其MPR截断值1.0的灵敏度是93%,特异度是86%,阳性预测值是40%,阴性预测值是99%[759]。MPR值辨别UM与EM的敏感性差。这些基因型的表型交叉重叠。因此,需要注意的是CYP2D6的UM基因型只能解释30%的UM表型。考虑到这些局限性,我们建议仅用MPR确定患者的代谢表型特征。
定义
“代谢比值”一词在文献中的使用不一致,有母药与代谢产物的浓度之比,也有代谢产物与母药的比值。为避免混淆,我们使用代谢产物与母药的比值(MPR)。表6列出35种神经精神药物的MPR值是对活体内参与相关药物代谢的酶活性的估计。假定药物的分布正常,平均MPRs±SD以标准剂量计算,如果不在均值±SD的范围内,就有可能存在部分不依从或药物代谢异常,应加以阐明。
2.5 探针药物表型测定
药代动力学表型采用所谓“探针药物”实验进行测定。这类测定方法是过去发现药物代谢由遗传决定之后出现的。曾用于以下几种药物:异喹胍、美酚妥因、司巴丁以及抗抑郁药去甲替林[21]。系统的研究也已确定经不同CYP酶代谢的化合物。运用这一知识,开发并确证了使用特定探针药物的表型分型实验,例如咖啡因用于CYP1A2;依非韦伦(Efavirenz)用于CYP2B6;氯沙坦(Losartan)或甲苯磺丁脲(Lolbutamide)用于CYP2C9;奥美拉唑或美酚妥因用于CYP2C19;右美沙芬、异喹胍或美托洛尔用于CYP2D6;咪达唑仑或红霉素用于CYP3A4;氯唑沙宗用于CYP2E1[218,283,343,373,425,527,533,644,722,847,1121,1170]。受试者服用探针药物,尽量采用无药理作用的剂量,然后测定母药及酶反应产生的代谢物浓度。其浓度或浓度比值反映各种CYP酶在体内的活性。质谱检测药物分析技术的进步使得采用6种或6种以上探针药物的鸡尾酒混合剂成为可能。这种方法可以一次实验定量测定几种同工酶的活性。基于实际应用的探针药物基因分型实验的目的是确定特定药物的最佳剂量。但是,目前,这种技术仍不成熟。只有少数药物是单一同工酶代谢的,很难依据表型测定结果计算出最佳剂量。已经发现通过分析所用药物的浓度(如TDM)更为可行。然而,表型分型实验已经建立,用于药代动力学相互作用的评估,特别是在药物研发阶段。当体外研究资料显示一种新药具有CYP抑制或诱导作用时,建议进行表型分型实验加以阐明。此外,探针药物表型分型是TDM的有益补充。如采用咖啡因作为探药,已经阐明了吸烟对CYP1A2的诱导作用,这种诱导作用在戒烟后4 d内消失[342]。
2.6 血药浓度测定的指征
表7列出了精神科和神经科实施TDM的指征。这些指征的有效性需要针对特定的案例进行检验和评价。与其他诊断性检查一样,只有当有证据显示TDM结果能够回答特定问题时,才需要申请TDM。
对于那些已经建立了治疗参考浓度范围或治疗指数窄的药物,在首次处方或剂量调整后,针对剂量滴定而进行血药浓度测定是非常有价值的。有足够的证据显示,即使没有特殊问题,TDM对服用锂盐、三环类抗抑郁药、多种抗精神病药或抗癫痫药治疗的患者也是有好处的。对锂盐而言,出于安全原因,TDM甚至是必须的。
依从性(包括完全不依从和部分不依从)问题在药物治疗方面很常见,代价很大。英文中“adherence”一词比“compliance”更为恰当,因为“adherence”这个词是把患者当作治疗决策的平等伙伴来看待的[49]。一般而言,50%用于治疗慢性病的药物没有按照处方使用[1356]。在对精神分裂症患者[90,603]和抑郁症或双相情感障碍患者的研究中,完全不依从的发生率在10%~69%[264,716,795,1345]。在接受胆碱酯酶抑制剂治疗的大样本痴呆患者中发现,在为期12个月的观察时间内的治疗依从率是34%[473]。部分或完全不依从影响治疗的有效性。世界卫生组织的一份报告[1325]显示,改善依从性可能比任何药物治疗的改进对人们健康状况的影响都要大得多。判断依从性的方法有药丸计数、加用可在尿液中检测到的显色剂、查看病历记录、问询患者或关注主管医生对依从性的临床判断[14,612,1034,1246,1247,1286]。研究显示,临床医生不能准确预测患者的服药依从性[171,725,1034]。监测血药浓度比其他方法更具优势,可提示处方医生药物浓度是否达到了足以产生预期临床效应的水平。对于癫痫患者,药物浓度监测证实,完全无依从性远多于足以控制癫痫的情况。研究发现,大多数因为癫痫发作来就医的患者的抗癫痫药浓度都低于治疗浓度[1138]。参照预期剂量相关参考浓度范围的浓度变化提示患者是否服药,是快代谢者或慢代谢者。

表7 测定精神疾病和神经疾病患者血药浓度的典型指征
同时测定代谢产物是另一个判断药物依从性的方法。但是,结果解释必须考虑合并用药对酶的抑制或诱导作用(见表2和表3)。Reis等[985-986]通过多次监测母药及其代谢物血清浓度水平的方法,分析了服用舍曲林患者的服药依从性问题。去甲舍曲林与舍曲林血清浓度比值的变化能准确反应患者不依从或部分依从的问题。如上所述,本共识指南提供了35种神经精神药物的代谢物与母药的浓度比值(见表6)。通过每天采取多个血样,计算不同时间点实测血药浓度与预期浓度的差异,可以区分低血药浓度是否由生物利用度降低、代谢增强,或依从性差所致。因此,预测时间依赖性药物及其代谢物血药浓度的药代动力学模型能够辨别不同类型的不依从问题[5,584,1141,1192]。
预防复发是维持治疗的主要目的。复发会导致再住院,而TDM降低复发率的成本-效益很高。研究表明,氯氮平血药浓度的变化能够预测复发[391,1219]。TDM可以通过提高医生对患者用药依从性的警觉性,降低复发或复燃的风险。
建议
我们建议在维持治疗下定期监测血药浓度,至少每3~6个月测定1次,以预防复发和再次住院。如果怀疑患者用药不依从,或者存在影响药物药代动力学的合并用药及吸烟情况,可增加TDM的频次。
当推荐剂量下的临床症状改善不充分,药物的耐受性又良好时,TDM能够阐明药物浓度是否过低,以及是否需要增加剂量。
当在推荐剂量下,在临床症状改善的同时伴有药物不良反应,TDM能够阐明药物不良反应是否因血药浓度过高所致,以及能否在不降低疗效的同时减少剂量。
当合用药是药物代谢酶的抑制剂或诱导剂(见表2和表3),而所服药物又是受抑制或诱导的酶的底物(见表2和表3)时,就会发生药代动力学药物-药物相互作用,应该在TDM指导下进行剂量调整,从而避免因药代动力学药物-药物相互作用导致治疗无效、耐受性降低或中毒[364,412,1081,1236]。当患者接受CYP1A2底物类药物,如氯氮平、度洛西汀、米氮平、奥氮平、雷沙吉兰或罗匹尼罗(见表1)治疗时,必须考虑吸烟的影响。
对于存在药物代谢酶基因变异的患者,可能有必要调整剂量或者改用其他替代药物。Kirchheiner(Stingl)等[630,633,1145]在药代动力学和药效学结果的基础上计算出CYP2D6慢代谢型和超快代谢型患者的服药剂量。这种基于遗传药理学证据进行剂量调整的方法已经被一些国际学术联盟[如遗传药理学临床应用联盟(Pharmacogenetic Clinical Implementation Consortium,CPIC)]采纳,并被相关循证指南(遗传药理学变异情况下如何调整治疗)所采纳,用于三环类和SSRIs类抗抑郁药[516]。然而,即使在确认CYP基因型异常的情况下,我们仍然推荐进行TDM,因为大多数CYP同工酶并非底物特异性,而且基因型只能粗略地预测个体血药浓度可能的改变程度[905,906,1136]。
孕妇或哺乳期妇女接受任何神经精神药物治疗时,为了降低母亲方面的复发风险,同时减少胎儿或婴儿由于药物暴露所导致的风险,应保证血药浓度在治疗参考浓度范围内[35,280,289]。怀孕期间,肾清除率升高,CYP同工酶2A6、2C9、2D6和3A4,以及尿苷二磷酸葡萄糖醛酸基转移酶(UGT) 1A4和2B7的活性升高;而CYP1A2和CYP2C19,以及N-乙酰转移酶2(NAT2)活性降低[532,773,903]。因此,孕妇和/或哺乳期妇女,至少应该每3个月进行1次TDM,产后24 h内也应进行TDM[103,681]。
许多神经精神药物未被批准用于儿童或青少年[416,1308]。迄今为止,绝大多数神经精神药物的治疗参考浓度范围都是基于成人的研究,有关儿科人群血药浓度与临床疗效和不良反应关系的数据十分缺乏[327,1298]。临床试验相对缺乏以及超说明书用药导致用药剂量不当及不良反应的风险增加。药物的药代动力学和药效学随发育而改变[328,794,939,945,1230],因此,用药剂量以及临床疗效不能按照成人的情况推测。儿科患者用药的安全性和有效性不明确,而该人群的处方数增加[327],医生和照护者的责任加重。在这种情况下,强烈推荐通过TDM实现药物治疗的个体化,以便提高药物的安全性。患有精神疾病的青少年,共病药物滥用非常常见,服用抗精神病药的依从性常常很差[538],因此更应强烈建议对这些患者实施TDM。把在成年患者建立的治疗参考浓度范围外推,用于儿童患者,特别是幼儿,需要针对每一种药物进行研究,针对儿童神经精神疾病初步的TDM研究结果差异很大。幸运的是,有几项研究证明儿童/青少年的治疗参考浓度范围与成年人相似。这些研究涉及舍曲林[1177]、阿立哌唑[949,1311]和氟伏沙明[677]。对多数药物来说,儿童和青少年使用相同剂量后的血药浓度的个体差异大。与成年患者相似,血药浓度与用药剂量显著相关[56,57,240,654,1177,1185]。最后,有证据显示,为了达到成年人的参考浓度范围,有必要使用更高的体重标化剂量;有些药物,如喹硫平[400]、氯氮平[1314]和利培酮[647]的参考浓度范围有别于成年人。
但是,对儿童患者实施TDM比成年患者要困难得多,原因是样本采集是有创的,并且需要患者的配合[939]。如下所述,有关常规TDM的替代样本,如唾液和更为方便的采样(如干血斑)技术的适用性研究正在进行中,以便减轻儿童患者的不便和不适[362]。
除了呼吁针对儿童和青少年开展更多的临床试验和药代动力学-药效学研究外,还需要对开始药物治疗的儿童和青少年进行积极和标准的监测和随访。已经建立对这类观察、评价,以及对很多患者进行标准化TDM检测的登记方法,汇集有关神经精神药物在日常条件下的给药方案、血清药物浓度、疗效和耐受性药物警戒数据(证据),建立了针对儿童和青少年患者的TDM网站(http://www.tdm-kjp.com)。这项措施有望降低儿科患者暴露于无效或难以耐受的精神药物治疗的风险[399]。
衰老过程会伴随着进行性多器官功能储备的损害[731],因此,老年患者应该进行TDM[1212],特别是肾脏排泄和肝脏功能可能下降更明显[628,651],I相反应比II相反应受损更为严重。肾小球滤过、肾小管重吸收和排泌功能随年龄以及体重和分布容积而改变。肝脏的清除能力降低,可达30%,主要是肝脏血流量下降,而不是代谢酶活性降低。一些学者[651]认为,CYP同工酶的年龄依赖性改变并不重要,另一些学者对CYP2D6活性的轻度降低表示怀疑,但对CYP2C和CYP3A没有质疑[1060]。老年患者常常对药物过于敏感,其脆弱性是个大问题。老年人在遭受应激事件后,内稳态失衡的风险增加,恢复稳定状态的能力下降[164]。例如,老年患者的胆碱能系统似乎特别敏感[695,908]。很多精神药物,如氯氮平、三环类抗抑郁药和帕罗西汀具有抗胆碱能活性。使用这些药物可以出现谵妄,认知功能下降和严重药物不良反应[212]。比如,去甲替林的抗胆碱活性随血药浓度增加而增强,甚至在治疗浓度下就可以发生[212]。药物不良反应风险的增加促使很多学者制定了识别老年患者潜在不适当用药的标准,如Beers标准[32]、PRISCUS清单[304,537,1057]、STOPP[393]及其他标准[874-875,1022]。另一方面,老年患者又经常得不到包括抗抑郁药在内的,对其有益的药物[209]。还有,上述脆弱性增加了老年患者并发合并症以及多种药物合用的可能,使得药物治疗更加复杂[164,207]。最后,精神药物超说明书用药的情况在老年患者人群似乎更为多见[561,1140]。显然,有关对老年人运用精神药物TDM的可用资料仍然不足。其结果是,已经发表的有关对这一人群实施TDM以优化治疗的推荐意见非常缺乏。常常建议进行“监测”,但是总是没有明确包含TDM[872,1123,1200]。
患有智力障碍的精神病患者,常用二代抗精神病药治疗。实用指南推荐,对这部分患者至少在使用利培酮和奥氮平[270]治疗时,应实施TDM。出于伦理和法律原因,智力障碍患者被排除在临床试验之外,但是此类患者又需要药物治疗。对于此类患者,可能很难区分病情加重的原因是病源性的还是药源性的。推荐使用TDM作为客观指标指导这类患者的药物治疗[270,272,494,1062]。
C反应蛋白(CRP)活性增高提示存在炎症或感染,在接受氯氮平或利培酮治疗的情况下,推荐进行TDM,以减少因血药浓度升高导致的中毒风险[501]。
对于药物滥用和依赖患者而言,具有确切疗效的药物都是TDM的备选药物[163,396,477,496,689]。这些药物的浓度个体差异很大[163]。对于阿片受体激动剂替代治疗,过量使用可能是致命的[686]。另外,不依从率很高。但是,这类患者的不依从类型与其他患者不同[685,747,1358]。药物滥用患者通常乐于接受替代药物。但是他们可能会认为用药剂量不足,从而自行加大剂量或加用非法途径获得的药物。还有一些患者会停用替代药物。阿片依赖患者,药物治疗只有在保证依从性的前提下才能有效[1291]。阿片受体激动剂,如消旋美沙酮、R-(-)-美沙酮(左美沙酮)、丁丙诺啡合用或不合用纳洛酮,还有吗啡缓释制剂,用于阿片依赖的口服维持治疗。在特定情况下,也可以静脉注射二乙酰吗啡(海洛因)。强烈建议TDM用于美沙酮或R-(-)-美沙酮、丁丙诺啡以及吗啡缓释剂。以药物特性和患者特征为基础,对于酒精依赖治疗药物,如阿坎酸、纳曲酮或双硫仑,以及纳曲酮用于阿片依赖的戒断治疗进行TDM的益处进行了评价[163]。TDM具有潜在增强这些药物疗效的作用,并且能够发现由于药物代谢酶基因变异或者药物-药物相互作用所致的药代动力学异常[1183]。我们必须意识到,由于物质滥用相关障碍患者依从性不同,血药浓度不仅可以降低,也可能会增高。
对于涉法精神病患者,药物治疗在减少暴力及攻击行为风险和精神疾病负担方面都很重要[41,493,824-825,1201]。为了达到这个目的,确保患者的依从性(主要是抗精神病药)非常重要,因为大多数涉法精神病患者不愿意接受药物治疗[824-825]。Castberg和Spigset[184]分析了一个高度安全的法医精神科的数据,发现涉法精神病患者的处方剂量虽然比对照组高,但是奥氮平的剂量相关血药浓度明显偏低,而喹硫平却偏高。强烈推荐对这类患者实施TDM,特别是在门诊进行监督治疗的患者。
对于涉及申诉精神药物不良反应(例如,多巴胺D2/D3受体激动剂导致的病理性赌博)的诉讼案例,TDM有助于法庭认证的证人(如法庭专家证人)证明或反驳原告确实服用了所诉药物,并达到了可以引起所诉伤害的血药浓度水平[1345]。数据显示,在曾经诊断过抑郁症且开过抗抑郁药,并要求伤残抚恤金赔偿的原告中,55%的血液中测不到抗抑郁药[398]。另有11%的原告的抗抑郁药浓度接近零,远低于治疗参考浓度范围的下限。所以,总计有66%诉求伤残抚恤金的法庭诉讼的原告不能证明其确实服用了所诉抗抑郁药[398]。这一点意义重大,作为患者必须对其康复负责。只有在治疗失败的情况下,患者才能享受疾病福利或残疾补偿。那么,在上述实例中,66%的原告不能达到这一标准,涉嫌公共健康保险欺诈。
针对“原研药与仿制药的互换使用” 这条指征,应该实施TDM,而不是观察和等待是否出现疗效下降或耐受性降低的问题[206,242]。在一项比较原研药与仿制药的志愿者研究中,文拉法辛仿制药比原研药在吸收相的浓度高出50%,结果导致药物不良反应的发生率增加。这一点不同于西酞普兰原研药和仿制药。另外,仿制药之间的差异可能高达45%。对仿制药的要求是,其AUC0-24h或AUC0-∞和Cmax在原研药的80%~125%(125 %~80 %=45 %)。药物吸收起始相的差异可能更大,而AUC0-∞和Cmax仍然在80%~125 %的范围内。
其他TDM指征还有在网络上购买非处方药和假劣药品[741,1093,1302]。假劣药品可能不符合纯度和剂量标准,从而增加药物不良反应的风险。
在药物警戒项目中,药物的使用安全性在自然条件下受到监测[379,444,445,450,470,648,662,946]。一旦发现不良事件,血药浓度测定是最有助于澄清问题的手段[569]。
2.7 测定血药浓度的推荐等级
TDM的价值会因临床具体情况和药物种类的不同而有所不同。就可疑用药依从性欠佳或中毒的情况而言,定量测定血药浓度是目前能够普遍接受的做法,且适用于所有药物和各类患者。然而,在很多国家,关于TDM是否应该成为临床常规仍然存在争议。以实验性证据为依据,神经精神药物实施TDM的必要性被划分为从“强烈推荐”到“潜在有用”4个推荐等级,具体如下:
定义
第一级:强烈推荐
证据:治疗参考浓度范围已经建立。临床对照研究已经证明了TDM的益处。有导致耐受性降低或中毒的报道。
建议:强烈建议将TDM用于剂量滴定过程和特定适应证,例如对于锂和卡马西平而言,TDM已是其标准化治疗的一部分。
临床结果:血药浓度在治疗参考浓度范围内时,药物起效或病情缓解的可能性最大。血药浓度在治疗参考浓度范围以下时,急性期治疗的有效率与安慰剂相似;而长期治疗存在病情复发的风险。血药浓度在治疗参考浓度范围以上时,存在不良反应或者中毒的风险增加。
第二级:推荐
证据:文献报道的治疗参考浓度范围来自于有效治疗剂量下的血药浓度,并且与临床疗效相关;有血药浓度高于治疗参考浓度范围导致耐受性降低或不良反应增加的报告。
建议:建议将TDM用于剂量滴定和特定适应证,或解决相关的问题。
临床结果:TDM可以增加治疗无效患者产生疗效的可能性。血药浓度低于治疗参考浓度范围,存在疗效低的风险;血药浓度高于治疗参考浓度范围,存在无法耐受或中毒的风险。
第三级:有用
证据:治疗参考浓度范围由获得批准的用药剂量下的血药浓度计算而来。与药效学相关的血药浓度尚未获得,或者仅基于对TDM数据的回顾分析,个案报道或非系统的临床经验。
建议:TDM适用于特定的适应证或相关问题的解决。
临床结果:TDM可用于控制血药浓度是否符合剂量相关参考浓度范围。通过增加因血药浓度过低而无效者的用药剂量,有可能获得更好的临床疗效。
第四级:可能有用
证据:血药浓度与临床效应不相关,其原因可能是由于药物独特的药理学特性,比如不可逆性地阻断某种酶;或者用药剂量调整可直接依据临床症状进行,比如镇静催眠药的睡眠诱导作用。
建议:不建议将TDM用于剂量滴定,但是对特定适应证或者解决相关问题可能有一定的帮助。
临床结果:TDM仅限用于特定适应证。
依据我们对文献的评价,在154种神经精神药物中,TDM必要性分级为“强烈推荐”的有19种药物,“推荐”的有39种药物,“有用”的有61种药物,“可能有用”的有35种药物(见表4)。TDM被强烈推荐用于大多数三环类抗抑郁药可以降低中毒的风险[168,669,827,934,959,961,964,1304]。多数三环类抗抑郁药的血药浓度与临床效应的关系(浓度-效应关系曲线)已经阐明。选择性5-羟色胺再摄取抑制剂(SSRIs)临床疗效对剂量的依赖性弱,但具有显著性意义,而在大剂量下的耐受性降低[564]。尽管TDM在临床实际中的接受程度确实有限[8,974,1175],有关其应用价值的证据正在不断增加。有报道显示,在西酞普兰治疗的早期,如开始治疗后1周,进行TDM很有益处[896]。将TDM用于SSRI类药物的另一局限性是对于血药浓度与临床效应关系进行分析时所用方法的不完善。有研究者采用更成熟的方法对原来未发现浓度-效应关系[1175]的帕罗西汀浓度与临床疗效的数据,进行了再分析,发现了明确的相关性,并且与体内5-羟色胺转运体的占有率几乎一致[329]。与多数SSRI类药物出现之前的抗抑郁药相比,SSRI类药物的毒性较低[79,277,526,1178,1297]。对于四环类抗抑郁药马普替林、米安色林和米氮平来说,药物浓度与治疗效果之间的关系仍缺乏具有显著统计学意义的证据,类似的情况还包括曲唑酮和瑞波西汀,以及单胺氧化酶抑制剂吗氯贝胺和反苯环丙胺。
TDM被强烈推荐用于典型(第一代)抗精神病药物如氟哌啶醇、奋乃静和氟奋乃静,及非典型(第二代)抗精神病药物如氨磺必利、氯氮平和奥氮平(见表4)。超剂量用药可能导致锥体外系反应。对于氯氮平来说,其血药浓度和癫痫发作之间存在着很强的相关性。通过TDM避免过量使用典型抗精神病药物,对大多数患者来说是为了保证生活质量而不仅仅是为了安全[237]。当患者由口服制剂改为长效注射剂时,抗精神病药的TDM也是很有用的。反之亦然。
使用第一代和第二代抗精神病药(利培酮、帕利哌酮、奥氮平、阿立哌唑)的长效制剂针对的是精神分裂症患者的不依从问题。人们一直认为长效抗精神病药的血药浓度稳定,耐受性好,疗效高。但是,长效与口服抗精神病药的疗效(如预防复发)和副作用的差异尚缺乏明确的证据,似乎更有赖于药物的种类和剂量,或者血药浓度[640,641]。因此,稳态峰-谷血药浓度的波动(见图2)并不总是缓释制剂更低(取决于tmax和t1/2)[1078],而且并非所有的研究都证明血药浓度波动大与不良反应增加呈正相关。现有长效抗精神病药的药代动力学研究很少,推荐的治疗参考浓度范围与其他剂型几乎一样[28,1113]。
情感稳定剂或抗躁狂药锂盐、丙戊酸和卡马西平的治疗参考浓度范围和中毒浓度已经确定。因此,强烈推荐对这些药物实施TDM(见表4)。锂盐的TDM甚至已是标准疗法的一部分[230,281,317,463,707,1076,12,83,1307]。对于长期锂治疗,推荐的血锂浓度范围是0.5~0.8 mmol/L。急性期锂治疗时,可以将其浓度上调至1.2 mmol/L。
已经证明有效的抗痴呆药包括多奈哌齐、卡巴拉汀、加兰他敏、美金刚。尽管有证据表明TDM可能有助于痴呆的治疗,但是极少应用[468]。有证据显示,多奈哌齐血药浓度大于50 ng/ml患者的症状改善程度明显优于血药浓度低于此值的患者[499,1013]。
对于抗癫痫药,TDM已经很成熟了,不仅用于毒性相对较大的老药[912],也用于新药[562,681]。
对于抗帕金森药,目前还没有建立起TDM。有关多巴胺激动剂参考浓度范围的数据非常少。左旋多巴血药浓度与短期临床疗效之间具有中等程度的相关性[867]。但是由于抗帕金森药物具有浓度依赖性镇静作用,这些神经药物的药代动力学特性已经被收入本版指南(见表1~表6)。TDM可以避免过量中毒。
3 精神科和神经科TDM的实施
3.1 TDM血药浓度测定的申请
有效TDM服务的基本要求是要有适宜的分析检测方法,并能在合理的时间内,如在48h内,获得血药浓度测定结果。这个时间是指从血样到达实验室直到发布检测结果以及由掌握药代动力学和药物治疗学知识的人员对治疗提供专业意见所需要的时间[314]。如图4所示,TDM始于送检申请,止于医学专业人员对患者治疗方案的最终调整。

图4 TDM指导神经精神药物治疗的示意图
如上所述,TDM只有在有证据提示其结果能够解答特定问题时才有申请的必要。申请TDM的典型指征见表7。单次测定经常不足以解决问题。例如,要弄清楚患者血药物浓度过低的原因,可能需要间隔一定时间进行多次测定,才能搞清楚其可能的原因是服药依从性差,生物利用度降低,还是消除异常加快。
TDM申请单必须具备完整的格式要求(见图5),这是有效测定血药浓度和合理进行结果解释的基础[923,1159]。申请单应该包括患者的姓名、病历号、人口学数据、诊断、用药情况、申请原因、待检药物的商品名和通用名及给药剂量、复方制剂、最后一次改变药物剂量的时间、服药时间、取血时间,还应提供对临床表现的简短评价,以方便结果的解释。如图5所示,我们推荐使用症状评定量表,如临床总体印象(Clinical global impression,CGI)量表[467],评价疾病的严重程度(CGI-S)和记录病情的改善或加重(CGI-I)。简明UKU副作用量表对评价药物不良反应及其严重程度也非常有用[717]。然而,反馈问卷调查结果显示,临床医生经常不太愿意在表格中填写太多内容,而且填入的信息经常不准确。另一方面,填写完整的申请单需要医生熟悉药物治疗方案且接受过TDM相关培训。因此,作为替代,可以通过电话反馈与感兴趣的医师联系。可将实验室的网站地址印在申请单上,以方便客户下载申请单及其他文件。
当需要实验室对结果做出解释时,需要准确完整地填写申请单。通过计算机联网的TDM申请更具优势,成本低而且可以引导医生便捷地填写结果解释所需要的相关信息。
3.2 样本采集
3.2.1 血液样本的采集 一般情况下,TDM样本为血浆或血清。至于血清、血浆哪个更好,目前的意见尚不一致,仍然缺少明确的实验数据证明血清和血浆中药物浓度到底有何差异。已有的几项比较研究显示,来源于血清或血浆的血药浓度数据可以相互替代[513]。对于大多数实验室来说,采血管不应含EDTA、柠檬酸盐、肝素或者其他添加剂,1ml血浆或血清就足够了。本指南所提到的神经精神药物浓度,与文献保持一致,均指总药物浓度。没有实验证据表明测定非结合(游离)药物浓度更有优势,而且测定游离药物浓度对分析方法的要求很高[87]。如米帕明,能迅速、完全地通过毛细血管简单扩散而从脑中消除[994]。其消除过程不受白蛋白、脂蛋白或红细胞的影响。而去甲替林,其游离形式的药物浓度与药物效应无明显的统计学相关性[929]。因此,至少对于精神药物来说,其临床效应可能依赖于总药物浓度。除唾液外,其他基质,如尿液、脑脊液、泪液、头发或母乳中神经精神药物的浓度,尚未用于TDM,也无经过验证的治疗参考浓度范围可用。
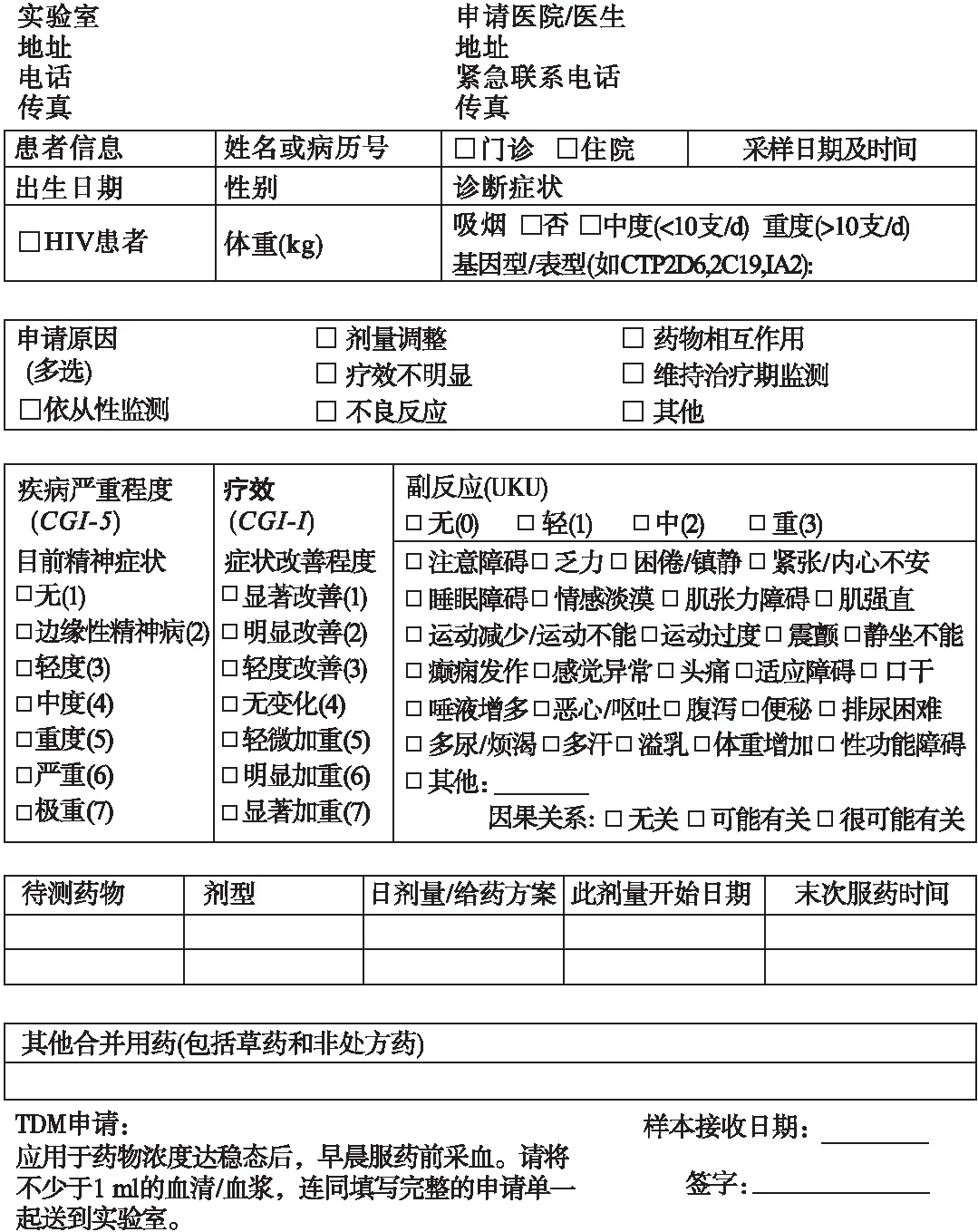
图5 神经精神药物TDM申请单的推荐样表
干血斑采血可以作为常规静脉采血的一种替代手段。该采样方法的主要优点是微创取样、采血量少、易于运输保存以及良好的稳定性。高灵敏度的现代分析技术,如液相色谱-串联质谱法(LC-MS/MS)或超高效液相色谱-串联质谱法(UPLC-MS/MS),使得用干血斑进行TDM成为可能[810,913,916,1303]。不过,以下几点必需加以考虑:干血斑浓度必须校准为血浆/血清浓度,还应考虑红细胞压积的影响,采血量和不同类型滤纸对结果的影响。固定体积干血斑采样技术和在线解吸、纸喷雾分析以及全自动干血斑萃取等自动化技术已经出现。然而,为了使干血斑采血能像全血采样一样成为通用性好且经济有效的替代方法,需要临床常规TDM实验室进行进一步的临床验证[1303]。
至于采血时间,必须考虑到TDM指导神经精神药物治疗多依赖稳态下的最低药物浓度(Cmin)。固定剂量下连续用药经过4~6个消除半衰期后达到稳态(见表4)。谷浓度是最长给药间隔的终末浓度。考虑到临床实际,用于测定最低药物浓度Cmin的样本采集时间通常选在当日早晨第1次给药前,对于大多数神经精神药物而言,这就是最低药物浓度时间(tmin)。然而,一个常见的问题是,在2次给药之间不同时间点都有可能采血,将导致对报告的错误解读,而真正的谷浓度可能会更低或更高。据报道[1205],对于抗生素,有高达55%的不当血药浓度是由采血时间不正确造成的。
抗帕金森病药和用于治疗注意缺陷多动障碍的药物哌甲酯需要在药物达到峰浓度(Cmax)时,即tmax时采血。这些药物大多数消除半衰期较短,其临床效应多与Cmax有关。
接受长效或缓释制剂治疗者的采样:对于使用长效抗精神病药治疗的患者,最好在下一次注射前采血。血药浓度取决于药物从储库的释放和消除。当然,如果出现意外的药物不良反应,可以随时进行TDM,没有必要测谷浓度,但应该报告具体的给药方案以利于结果解释。
有些抗精神病药的长效制剂,如氟哌啶醇癸酸酯、利培酮或阿立哌唑的长效针剂,肌肉注射后吸收缓慢。第一代长效抗精神病药物在注射后1~14 d,血浆药物浓度达到最大值,表观消除半衰期为2~3周[1179]。帕利哌酮棕榈酸酯也表现出类似的药代特征[1113],表观消除半衰期为25~49 d[976]。利培酮微球的平均达峰时间为4周,表观消除半衰期为4~6 d[1179]。长效奥氮平双羟萘酸盐在注射部位缓慢释放到肌肉组织[714]。然而,当奥氮平的双羟萘酸盐接触到血或血浆时便迅速溶解,导致血浆奥氮平浓度升高,可引起明显的镇静和谵妄,即所谓的注射后综合征[714,1179]。每月注射1次的阿立哌唑长效制剂,由于溶解度低、吸收缓慢,其平均表观吸收半衰期长达4周。注射后5~7 d,血浆药物浓度达到最高。每月给予阿立哌唑400 mg或300 mg后,平均表观终末消除半衰期分别为47 d和30 d[365,751]。
就文拉法辛、哌甲酯、帕利哌酮[110]或喹硫平[356]等的口服缓释剂型而言,为了作出正确的结果解释,应特别留意给药时间的影响(见表4)。这些剂型的血药浓度达峰时间都会延长,而药物的终末消除半衰期基本不变。
3.2.2 唾液样本用于TDM 唾液具有非侵入性采样的优点[30,39,613]。唾液曾经用于几种抗癫痫药物的优化治疗[911],目的是确认是否服药[683]和结果的定性解释[914]。长期以来人们一直认为唾液中的药物浓度反映的是血液循环中药物的游离部分(即非蛋白质结合的部分)。对多数精神药物而言,这部分可能仅占总血药浓度的10%,甚至更低。因此在过去使用唾液代替血浆或血清时,检测技术是个大问题。如今,改进的方法已经具备足够的精密度和准确度来分析唾液中的药物浓度[913,914]。使用改进的方法发现血液与唾液中药物浓度的比值差异很大,并且不能完全支持唾液含有血药浓度游离部分的假设。血液与唾液中药物浓度的比较表明,唾液实际上不能取代血液作为TDM的基质[914]。血浆和唾液中单羟基奥卡西平(MHD,即奥卡西平主要代谢物)的浓度有明显的正相关性[706]。卡马西平、苯妥英钠和苯巴比妥的这种相关性差,但也有一定意义[316]。但是对于丙戊酸,这种相关性则不明显[315]。有报道,唾液不能代替血液进行美沙酮的监测[1084]。
对于阿米替林和去甲替林,没有发现唾液和血浆中的浓度相关[87]。许多神经精神药物是碱性药物,其pKa值>9。药物在血液和唾液间的分布取决于pH值。当唾液受到刺激分泌增加时,其pH升高。对于哌甲酯,唾液与血清中药物浓度的比值和唾液样本的pH值之间呈负相关[1133]。样本采集的标准化与优化非常必要[682]。总之,将唾液作为测定药物浓度的基质还需要更多的数据支持。
3.3 血样的保存与运送
除少数情况外,血清或血浆样本可以在4 ℃避光贮存最少24 h,多数药物的样本可以在非冷冻条件下运送[506]。例外的药物,如安非他酮和/或哌甲酯,对光或氧敏感。对于这类药物的测定,样本必须在采血、离心后立即冷冻,或者进行提取,以保持稳定(见表4)。对于奥氮平检测,如果在72 h内不能进行分析,血清或血浆样本必须在-20 ℃冷冻保存[506]。当样本必须冷冻保存及运送时,血清或血浆必须在冷冻前就分离好,因为不可能从冰冻的血液中得到血清或血浆。实验室需要在其网站或申请单上注明样本应如何采集(如血浆体积、标签内容)、贮存及运送。
3.4 实验室测定
药物及其代谢物定量分析方法的选择性和灵敏度是成功实施TDM的基本条件。分析方法必须经过验证[185,715]。验证的内容包括所有能证明分析方法能够定量测定特定生物基质中被分析物浓度并与测定目的相符的可靠性、重现性的一整套程序。验证的基本参数包括:准确度、精密度、特异性、灵敏度、重现性及稳定性。验证过程中需要记录分析方法适用于检测目的的适用性和可靠性的各项性能指标。分析数据是否可被接受与所用分析方法的验证标准直接相关[185,370,并见(http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_ guideline/2011/08/WC50010 9686.pdf)]。
神经精神药物的检测应优先选用配备适当检测方法的色谱技术(首选HPLC)[318]。这类技术足够精密、准确、耐用,几乎适用于所有神经精神药物的分析。其缺点之一是在色谱分离前需要进行样本前处理,限制了样本检测通量。可以在进行HPLC分析前,通过自动化的样本前处理来增加检测通量。有些实验室通过柱切换HPLC技术简化样本前处理,将血清或血浆直接进样到HPLC系统。这类技术适用于许多抗抑郁药[446,486-487,490-491,1274,1288]和抗精神病药[638-639,1026-1028,1287,1289]的分析检测。另一类高通量色谱技术是高效液相色谱配备质谱检测器(LC-MS),特别是串联质谱检测器(LC- MS/MS)[1032]。LC-MS/MS是灵敏度和选择性最高的分析技术。这类技术只需要简单的样本前处理,如蛋白质沉淀和稀释,而且能够同时分析多个化合物。Kirchherr和Kühn-Velten报道的一项LC-MS/MS方法就是一个很好的范例[635],能同时检测50多种精神药物。LC-MS/MS方法的主要缺点是设备昂贵并需要训练有素的专业人员。另外,定量分析可能会受到基质效应和离子抑制效应的影响。但是通过色谱分离技术将基质和目标分析物很好地分离以及使用稳定同位素标记的标准品作为内标进行校准,可以将这些影响降至最低,优先使用氘标类似物作为内标[1047]。近几年,LC-MS/MS的使用频率越来越高[37,914,915,917],它的巨大优势是灵活性,劣势是成本高,但已逐渐降到可以接受的价格。因此,LC-MS/MS成为当今许多专业实验室进行神经精神药物TDM优先选择的分析方法。然而,由于其性价比高和耐用性好,高效液相色谱配备紫外或荧光检测器仍然是许多低至中等通量实验室的选择。
在怀疑药物中毒时,TDM方法必须保证在1~2 h内获得药物分析结果[364]。就此应用目的而言,自动化方法更具优势。LC-MS/MS的高选择性使其在这方面的应用更具优势。
分析手性异构体时,需要在定量分析前对药物进行立体选择性衍生化,或通过手性柱分离。串联质谱是首选检测方法。例如,使用传统检测器,如荧光检测器或紫外检测器,对美沙酮异构体进行TDM时,经常受到合并用药或同时使用的其他滥用药物的干扰。如果使用质谱检测器,特别是串联质谱检测器,这些问题就迎刃而解了。
在治疗参考浓度范围内,日内和日间精密度的变异系数(CV%)不应超过15%,准确度不应超过标称值的15%[185,370]。
为保证药物浓度测定的质量和可靠性,必须进行内部和外部质量控制。样本必须含有适宜的内标,且每批样本必须包含有室内质控样本。如果没有市售质控品,则须由分析检测人员以外的人制备质控品,并且需要单独称量标准品。如今市售质控品已经覆盖越来越多的精神活性药物。只有质控结果在规定范围内才可报告测定结果。如质控结果在规定范围之外,就必须弄清原因,并做好记录。
尽管所有国家都没有法律上的要求,但实验室必须参加室间质量评价项目。最早的神经精神药物室间质评项目是1972年由Cardiff Bioanalytical Services Ltd.公司首先开展的[1306]。该项服务已由LGC(www.lgcstandards.com)或Instand e.V.(www.instand-ev.de)等室间质量评价项目的供应商接管。此外,参考资料也可以从毒理学与法医化学学会(www.gtfch.org)的临床毒理学课题组获得。
3.5 稳态谷浓度的计算
当将TDM检测得到的药物浓度与预期稳态谷浓度Cmin进行比较时,其实是已经假定了在最低药物浓度时(tmin)采血。测定稳态谷浓度,最好选在首次服药或调整剂量后至少4个消除半衰期,并在β-消除相末端采血。大多数神经精神药物的t1/2为12~36 h(见表4)。值得注意的例外情况是喹硫平、文拉法辛和曲唑酮的消除半衰期在6 h左右,而氟西汀、多奈哌齐和阿立哌唑则具有较长的消除半衰期。在临床实践中,对大多数神经精神药物而言,最佳的采血时间为固定剂量用药1周后的清晨服药前,通常为末次服药后的12~16 h(如果是1次/d,清晨服药,则为24 h)。如因某些原因,采血时间不得不安排在早晨的晚些时候,则患者在采血前不应服药。门诊病人,提供末次服药的具体时间非常重要,以便计算预期谷浓度。预期谷浓度可以采用下面的公式(5)推算出来:
Cmin=Ct×e-ke(tmin-t)
(5)
其中Ct是时间为t时的药物浓度,tmin是Cmin的时间,ke是消除速率常数(ke= ln2/t1/2)
以氨磺必利为例,它的平均消除半衰期是16h(见表5,ke= 0.043 3/h),每日1次用药(早8∶00)。由于患者被告知须在TDM采血后再服药,所以患者在取血当天没有服药。由于种种原因,最终于上午11∶00取血。血药浓度测定值(Ct)为351 ng/ml,服药后24 h的Cmin计算结果:
公式(5)也可以用于取血时间在吸收相之后,达到tmin之前的情况下Cmin的估算。
例如,对锂盐来说,它的消除半衰期是24 h(见表5),每晚20∶00单次给药,取血时间为上午8∶00(t=12 h),测得的血药浓度值(Ct)为1.0 mmol/L,那么服药后24 h(tmin)时的Cmin应为:1.0e-ke(24-12)= 0.71 mmol/L
3.6 结果的解释、沟通及建议
神经精神药物及其活性代谢产物的浓度及参考范围(见表4)应当以质量或摩尔浓度的形式一同报告。我们推荐使用质量而非摩尔单位,这样更便于药物浓度与剂量相对应。不同实验室检测结果的表示方式可能存在差异。临床医生需留心实验室检测结果的单位(如ng/ml,μg/L,μmol/L,或nmol/L)。在比较不同实验室间或文献中的结果时尤其应该注意这一点。摩尔浓度与质量浓度的相互换算系数在表4中已给出。
当药物浓度低于最低定量限时应该注明。最低定量限是标准曲线的最低浓度点[370],且要求其准确度至少应在80%~120%的范围内,精密度不大于20%。
浓度检测结果具有时效性,以便临床及时作出决策。24 h内取得治疗药物浓度检测结果最理想,不过48 h的报告时间也足以满足大多数情况的需要。在疑似中毒时,需要几小时内就能反馈结果[364]。为帮助临床快速干预那些存在中毒或难以耐受风险的患者,实验室需要知道主管医生的紧急联络方式(如电话号码),一旦监测到药物浓度超过警戒浓度(表4)就应及时告知医生(如打电话)。
我们强烈推荐每一份TDM报告都提供结果解释和药理学建议。专业的结果解释并充分利用相关信息是保证TDM报告临床获益充分与否的关键[82,314,469,471,519,979,1159]。结果报告中的剂量调整建议及其他意见必须以能够获得的最佳证据为依据。专业知识对计算药物的调整剂量或鉴别药物间相互作用是必不可少的。临床医师最好选择能够提供这种服务的实验室。否则,主管医生、临床药理学家或经过训练的临床专家必须自行解读结果。如果TDM结果提示患者可能需要检测基因型,就应该咨询相关专家。
一些地方甚至有法律规定需要临床药理学家共同参与这项工作。在瑞士,精神科医师或许可以开具CYP基因检测,但只有临床药理学专业医师开出的此类申请才能经医保报销。
诊断和给药剂量是结果解释的重要信息,因为它们关系着对检测结果是否合理的判断。再者,要核实血样是不是在推荐的条件下抽取的,尤其当门诊患者血药浓度高于预期时更应如此。若药物在采血前数小时服下,血药浓度可达谷浓度的数倍之高(图2)。如采血时间是在吸收后时相,可以用公式(5)方便地计算出稳态谷浓度。
进行结果解释时,必须核查血药浓度是否在治疗参考浓度范围(表4)内,是否与剂量相符(表5)。当药物浓度不在治疗参考浓度范围时,比较明智的做法是要考虑这种药物治疗参考浓度范围的证据等级。任何不在剂量相关参考浓度范围(表5)的药物浓度都提示TDM实验室应主动寻找可能存在的药物-药物相互作用或基因多态性导致的慢代谢或超快代谢,肝和肾等器官的功能改变,年龄或疾病相关的患者药代动力学改变,依从性问题,未达稳态,甚至患者未告知处方医师正在服用其他药物(如圣约翰草)等原因。还应该考虑患者的日用药剂量是单次还是多次给药。
通常有必要把患者服用的所有药物的代谢通路、代谢酶、底物和抑制剂的性质都列出来以利于结果解释。因此,本版更新的指南依据文献资料给出了药物代谢酶的底物(表1)、抑制剂和诱导剂的特性(表2和表3),以便探讨可能的药物之间相互作用的原因。
对于疼痛的治疗,较低浓度的三环类抗抑郁药就已足够。这个浓度可能在“剂量相关参考浓度范围”(表5)内,但不在针对抑郁症建立的“治疗参考浓度范围”(表4)内。
实验室有时会建议一段时间后再次取样,因为通常在一些血药浓度过高或过低的案例中,重复测定有助于发现患者的依从性(如服药不规律等)或明确患者是否是超快或慢代谢者。
正如下面的病例解释那样,TDM建议必须结合临床表现。调整剂量是最常见的建议。
3.6.1 如何应用TDM共识指南进行结果解释-病例分析 为了阐明如何运用共识指南中的信息解释实验室检测结果,对3个有代表性的病例分析如下:
病例1

患者:51岁/男性/住院患者/吸烟(>10支/d)诊断:偏执型精神分裂症检测目的:依从性不详疾病严重程度:严重(CGI-S 6分)病情改善:无变化(CGI-I 4分)药物不良反应:未报告待测药物/剂量:氯氮平 250mg/d用药开始时间:5周前 末次剂量调整:2周前末次服药:12 h前合并用药:乙酰水杨酸、辛伐他汀、舍曲林实验室结果• 氯氮平:224 ng/ml(治疗参考范围 350~600 ng/ml,见表4)• N-去甲氯氮平:175 ng/ml
解释
TDM指征与本版共识指南相符(见表7)。在250 mg的治疗剂量下,按照临床总体印象量表(CGI-I)评分,患者疗状没有得到缓解(见图5)。TDM需要阐明是患者的依从性差还是需要增加剂量来提高治疗效果。
氯氮平的浓度测定结果为224 ng/ml,低于350~600 ng/ml的治疗参考浓度范围(见表4),但在氯氮平及其代谢物的剂量相关参考浓度范围内(见表5)。氯氮平250 mg/d的剂量下,预期剂量相关参考浓度范围(按照表5中DRC因子的低值和高值计算)是:氯氮平250×(0.43~1.59)=108~398 ng/ml;N-去甲氯氮平250×(0.50~1.25)=125~313 ng/ml。N-去甲氯氮平与氯氮平浓度比值是0.78,符合0.45~0.78的代谢物与母药比值(MPR)的预期(见表6)。此患者吸烟,未联合使用表2中的抑制剂,但表3显示吸烟会诱导参与氯氮平代谢的CYP1A2酶。
推荐
推荐增加剂量来提高疗效,根据浓度剂量比0.9 ng/ml/mg,可以推算出达到推荐的治疗浓度(350~600 ng/ml),需要的剂量是400 mg/d。
病例2

患者:70岁/女性/住院患者/吸烟(>10支/d)诊断:重度抑郁发作检测目的:药物不良反应和临床改善疾病严重程度:中度(CGI-S 4分)病情改善:明显改善(CGI-I score 2分)药物不良反应:胃肠功能紊乱待测药物/剂量:文拉法辛缓释胶囊225mg/d用药开始时间:3周前末次剂量调整时间:1周前末次服药:24 h之前合并用药:左美丙嗪实验室结果• 文拉法辛:168 ng/ml• O-去甲文拉法辛:251 ng/ml• 活性成分:419 ng/ml(治疗参考范围100~400 ng/ml,见表4)• N-去甲文拉法辛:143 ng/ml
解释
TDM指征与本版共识指南相符。在225 mg的治疗剂量下,尽管这名70岁的患者发生了药物不良反应,但依据CGI-I量表的评分,她的病情得到了明显改善(见图5)。TDM必须阐明药物不良反应是否与文拉法辛活性成分的高浓度相关,能否在降低剂量的同时确保患者的疗效。
血药浓度测定结果显示,文拉法辛和O-去甲文拉法辛组成的活性部分总浓度为419 ng/ml,略高于100~400 ng/ml的治疗参考浓度范围(见表4),同时也略高于剂量相关浓度的参考范围。在225 mg/d的剂量下,预期剂量相关参考浓度范围(按照表5中DRC因子的低值和高值计算):文拉法辛为225×(0.12~0.36)=27~81 ng/ml;O-去甲文拉法辛为225×(0.78~1.30)=176~293 ng/ml。因此,预期的活性部分浓度应该在203~376 ng/ml之间。根据表1,文拉法辛是CYP2D6和CYP2C19的底物。该患者O-去甲文拉法辛与文拉法辛的浓度比值为1.49,低于代谢物与母药的预计比值(MPR=2.7~7.7,参见表6)。表明该患者的CYP2D6表型为慢代谢型。N-去甲文拉法辛与文拉法辛的浓度比值为0.85,与正常CYP2C19表型一致(参见表6)。该患者合并用药左美丙嗪,同时吸烟。根据表2,左美丙嗪是CYP2D6的抑制剂,而CYP2D6催化O-去甲基文拉法辛的生成。根据表3,吸烟会诱导CYP1A2,但不会影响文拉法辛的代谢(表1)。因此,不良反应很有可能是由于左美丙嗪对CYP2D6的酶抑制作用造成高药物浓度导致的。另外,N-去甲文拉法辛的浓度143 ng/ml,高于预期浓度范围(34~74 ng/ml),因此,进一步证明了该患者CYP2D6的表型为慢代谢型。由于左美丙嗪是CYP2D6的底物,其血药浓度可能也高,特别是对慢代谢表型者,对于不良反应可能也有贡献。
建议
该患者所报告的药物不良反应可以由文拉法辛和O-去甲文拉法辛的浓度过高来解释,引起浓度偏高的原因很有可能是药物相互作用和衰老。该患者可能是由于左美丙嗪对CYP2D6的抑制作用而表现为慢代谢表型的。降低给药剂量有可能提高患者的耐受性,同时又不会降低疗效。另外,由于患者的胃肠道不良反应也可能是左美丙嗪引起的,因此也可以选用一种非CYP抑制药替代左美丙嗪,例如,可选用匹泮哌隆。
病例3

患者:51岁/男性/住院患者/吸烟(<10支/d)诊断:双相情感障碍,躁狂发作期检测目的:临床疗效差/依从性不详疾病严重程度:偏重(CGI-S 5分)病情改善:无变化(CGI-I 4分)药物不良反应:无待测药物/剂量:丙戊酸/900 mg/d;奥氮平/10 mg/d用药开始时间:6周之前末次剂量调整时间:2周之前末次服药时间:12 h之前合并用药:无实验室结果:• 丙戊酸:37 μg/ml(治疗参考浓度范围50~100 μg/ml,见表4)• 奥氮平:7 ng/ml(对双相情感障碍的治疗参考浓度范围未知。鉴于10 mg的剂量是联合用药的剂量,8~23 ng/ml可作为推荐治疗范围)• N-去甲奥氮平:2 ng/ml
解释
TDM指征与本版共识指南相符。CGI-I 量表的评分为4分,病人的病情没有改善(见图5)。TDM可以解释该患者是否按照处方剂量服药以及增加剂量是否对患者有益。
丙戊酸(丙戊酸盐)的浓度测定结果为37 μg/ml,低于治疗参考浓度范围(表4),也低于预期剂量相关浓度。丙戊酸在900 mg的剂量下,预期剂量相关浓度的参考范围(计算方法参考表5中DRC因子)应该达到55 980~121 329 ng/ml(=56~121 μg/ ml)的水平。奥氮平和它的代谢产物的浓度分别为7 ng/ml和2 ng/ml。这两个浓度值与治疗效果无关,因为尚未建立适应证为双相情感障碍的治疗参考浓度范围。然而,在10 mg/d的剂量下,奥氮平的预期浓度可以计算出来(见表5),应该在12~25 ng/ml的范围内。该患者的奥氮平浓度只有7 ng/ml,显然低于预期浓度。另一方面,代谢物与母药的比值为0.29,与预期值(见表6)相符。该患者是一名中度吸烟者,表3显示吸烟诱导CYP1A2,同时表1又显示奥氮平是CYP1A2的底物。依从性问题可以很好地解释奥氮平浓度低于预期,而代谢物与母药的比值正常。然而,吸烟加速奥氮平代谢是另外一种可能的解释。
建议
患者疗效不佳的原因可能是由于血药浓度偏低。应该关注患者的依从性,并加以确认。如果患者的依从性为完全依从,增加剂量可能有助于病情改善。
以上3个病例展示了如何使用表1~表6中的信息来解释实验室数据,从而得出有价值的结论,并为合理药物治疗提供实质性建议。由于TDM结果的解释有赖于复杂的数量关系,所以临床神经精神药理学、药代动力学及TDM信息运用方面的培训非常必要。定期举行TDM结果解释实例讨论会是非常重要的学习方式。同时,也建议初级精神科医生应该在专家指导下进行TDM结果的解释。
3.7 遗传药理学检测与TDM相结合
在一定的情形之下,开药之前进行遗传药理学检测,有可能避免血药浓度不在治疗参考浓度范围或剂量相关参考浓度范围情况的发生,尤其是这种异常是由基因多态性引起药物过慢或过快代谢(药代动力学层面)所致[247,248,332,568,569,632-634,658,1135,1229]。遗传药理学检测应该与TDM相结合的阐释见图6。
依据德国遗传学检测委员会(GeKO)和临床药物遗传学实施联盟[515,517,1229],以及FDA和EMA等监管部门一致的推荐意见,需将药物代谢酶基因型检测与TDM相结合的最主要的指征如下:
(1)药物的治疗指数窄,并且遗传学上的代谢缺陷会增加中毒风险,应优先检测基因型;
(2)患者所用药物在代谢方面的个体差异大,过量给药的中毒风险大,应优先检测基因型,如三环类抗抑郁药;
(3)患者在服用一种药物后呈现出药物或其代谢产物血药浓度异常的,再使用另外一种药物前需确定患者的代谢状态,应该进行事后基因型分析如超快代谢者服用可待因(参见可待因药物标签针对超快代谢者的警告[331])。
对于基因分型为慢代谢者(PM)或超快代谢者(UM)的患者,不一定需要更换药物,而应根据TDM结果和临床判断进行剂量调整。
在临床实践中,除卡马西平外,尚未推荐进行药效学方面的遗传药理学检测[354]。
用于检测药代动力学和药效学基因变异的试剂盒现已上市,但是目前的证据不足以推荐将其直接纳入日常临床工作,进一步开展大型的多中心临床试验研究完全必要。
3.8 临床决策
TDM结果对患者的个体化用药剂量调整具有指导作用(见图7)。医生必须清楚,在理想条件下,TDM实验室提供的附有推荐剂量及其他建议的报告均是基于已有证据而作出的[518,520]。然而,一方面实验室工作人员临床经验有限;另一方面大多数临床医生的药代动力学知识不足。因此必须意识到,理想的TDM是一个交叉学科,需要实验室与临床专家密切沟通才能完成。
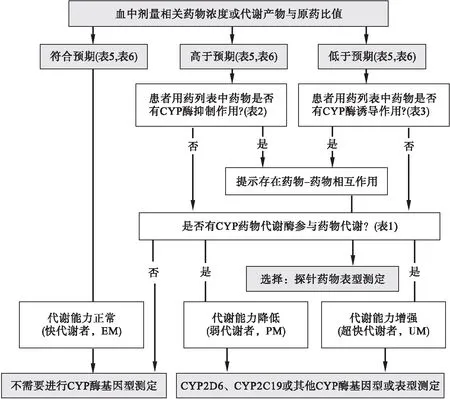
图6 应用细胞色素P450(CYP)酶基因型测定和探针药物表型测定与TDM相结合的框架图
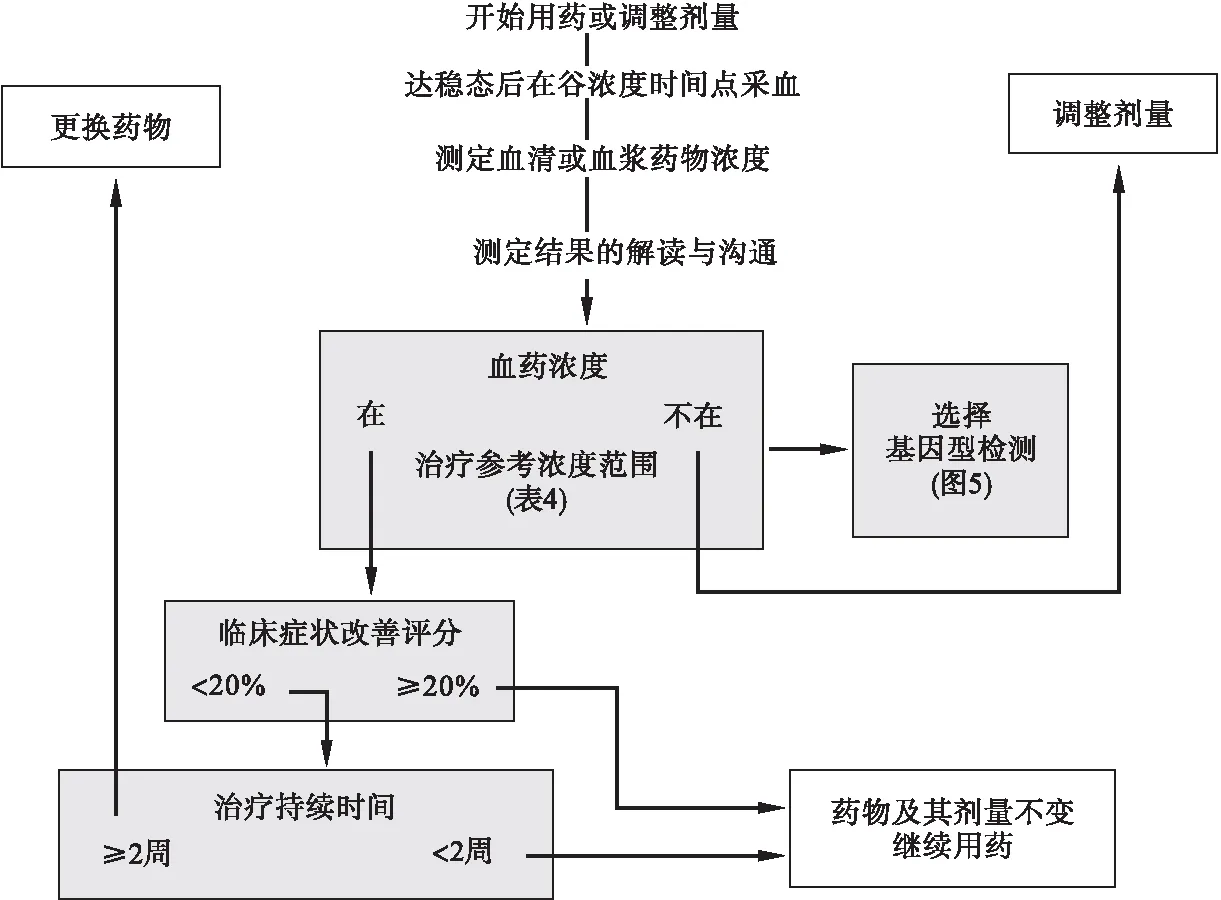
图7 在TDM指导下情感稳定剂、抗抑郁药、抗精神病药和抗癫痫药的剂量滴定。临床决策需考虑稳态血药浓度、临床疗效和用药时长。
如果测得的药物浓度在治疗参考浓度范围内,那么只有当患者出现药物不良反应或治疗无效时,才推荐调整剂量。必须由患者的主管医生决定是否改变治疗方案。另一方面,如果主管医生不接受TDM报告提供的建议,那么应提出具体的理由,以便对医生的决定进行评价,以免对患者造成伤害。AGNP-TDM小组已经正式发布了进行这种评价的准则[1345]。
如果已知患者具有异常高的药物清除率,给予高于最大推荐剂量的药物可能有利于治疗,因为这类患者在使用标准剂量下,血药浓度很可能低于推荐的治疗参考浓度。然而,如果患者血药浓度足够高,且持续的治疗时间足够长,如2周以上,患者的病情仍然改善不到20%,那么就应该更换药物。还可以选择换用不经过肝脏CYP酶系统代谢的药物,如抗抑郁药米那普仑或抗精神病药氨磺必利。
如果在推荐剂量下,患者出现药物不良反应,同时其症状又有所改善,那么测定血药浓度可以帮助鉴别药物不良反应是否与血药浓度过高有关。在这种情况下,可以减少药物剂量,通常不会降低药物的疗效。
采用抗抑郁药、抗精神病药和情感稳定剂治疗时,已有充分的证据表明,如果在第2周末症状仍无改善,就可以预测继续治疗的疗效往往不佳[196,239,615,696,1130,1131,1162]。因此,我们推荐在进行抗抑郁药和抗精神病药剂量滴定时,主管医生应在基线期和治疗的第2周对患者进行症状评分[239],同时进行血药浓度测定。图7是上述建议的简要路线图。
当剂量调整后或合用已知能抑制或增强待测药物代谢的药物时,建议再次进行血药浓度检测,并应该延迟到血药浓度重新达到稳态后再进行。为此,必须考虑该药物的终末消除半衰期(见表4)。最后,如果患者在血药浓度低于治疗参考浓度范围的情况下,症状仍然得到了改善,应该考虑逐渐减量直至停止药物治疗,因为药物在治疗中可能仅仅起到了安慰剂的作用,继续治疗带来的可能只有不良反应和费用支出。
3.9 TDM的成本与效益
已有证据显示TDM具有良好的成本效益(参见[1204])。证据表明,TDM可有效减少三环类抗抑郁药的中毒风险[168,961-962]。让患者试服小剂量阿米替林或去甲替林,可以通过检测血药浓度估算出患者对药物的清除率和消除半衰期,从而计算出达到有效治疗稳态浓度所需要的剂量[159]。这种在药代动力学指导下确定用药剂量的方法可以显著降低治疗成本[1089]。与经验性用药患者相比,药代动力学指导下的用药方案,可使患者早出院6 d,早工作55 d。关于SSRI类药物,Lundmark等[734]发现,在127例老年门诊患者中,当引入TDM指导用药后,有38例患者减少了用药剂量,从而使药费下降了16%。有一篇关于西酞普兰治疗费用大幅度降低的报道,就是因为TDM明显缩短了患者的住院时间[894]。这项关于住院患者的研究中,TDM指导下的药物治疗可使患者达到足够高的西酞普兰血清浓度(>50 ng/ml),与未达到治疗参考浓度的患者组相比,住院时间减少了23 d。如果血药浓度在7 d内不能达到50 ng/ml,往往预示着治疗失败[895]。使用文拉法辛治疗的抑郁症患者也有类似的报道[1129]。另外,TDM还可以有效降低复发率,再加上TDM对再次住院前患者用药依从性的监测,TDM的成本效益是很高的。住院1 d的费用,相当于实验室检测1次血药浓度的4~16倍。总的来说,TDM可以提高患者依从性,加快临床疗效的出现或缩短住院时长,预期成本效益显著。但是,关于TDM的成本效益,还需要更多的研究。
4 总结和展望
这次AGNP共识指南的第2次更新描述了TDM的实际应用,以便推进TDM在精神科和神经科的合理使用。若能得到充分使用,TDM会成为一个出色的精准医学工具,用于优化患者个体的药物治疗方案。在过去的数十年里,有关药物在人体内代谢和作用机制的知识显著增加。然而,在药理学知识与临床实践之间仍有一道鸿沟[518,1094],而TMD就是这一鸿沟之上的桥梁。本次更新,特别强调了阐释患者药代动力学特征的方法。整合药物的治疗参考浓度范围、剂量相关参考浓度范围、代谢物与母药的比值,以及所用药物性质如CYP底物、抑制剂和诱导剂的特性,还有CYP酶及转运体的基因型等信息,可以帮助我们认识和记录神经精神药物药效学和药动学个体差异。运用这些信息,可以更合理地调整给药剂量,更好地协调疗效、耐受性及治疗费用之间的关系。尽管在日常临床实践中,TDM的应用确实在不断进步,但是TDM的质量改进仍然需要常抓不懈。在新药临床试验中有必要将药代动力学检测纳入研究范畴。新药研究的一大缺陷是,没有从立法的角度明确要求新药注册必须获得最佳疗效时的血药浓度范围。药品说明书应该补充TDM相关的数据。最后,但同样重要的是,应该在精神科住院医师培训中讲授这些知识[86]。
