能谱CT成像对行单孔电视胸腔镜外科手术的非小细胞肺癌患者的疗效评估及影响预后的危险因素分析
2022-06-23李炳超
李炳超
(北大医疗鲁中医院放射科 山东 淄博 255400)
随着科学技术的发展,肺癌的治疗手段多样化,如手术、化疗、放疗、靶向治疗等,手术作为最有效的主要治疗手段,临床上最为多用。一部分肺癌患者无法进行肺叶切除选择亚肺叶切除,尚有部分患者合并心肺功能障碍无法耐受肺叶切除[1]。亚肺叶切除包括楔形、解剖性肺叶切除。解剖性肺叶切除不仅保证边缘,在叶间和段间淋巴结清扫有较大的优势[2]。研究发现对于2 cm以下的非小细胞肺癌(non-small cell lung carcinoma,NSCLC)患者采用肺段切除,复发率和总体生存率与肺叶切除无明显差异[3]。随着胸腔镜技术的发展,胸腔镜由3~4个切口减少至1~2个切口[4]。国内外已经将胸腔镜应用于肺叶切除。目前对于终末期肿瘤患者的评估缺乏有效的治疗方法[5]。因此本文选取2015年1月—12月于北大医疗鲁中医院行单孔VATS的NSCLC患者46例,分析能谱CT成像对行单孔VATS NSCLC患者的疗效评估及影响预后的危险因素。
1 资料与方法
1.1 一般资料
选取2015年1月—12月于北大医疗鲁中医院行单孔VATS的NSCLC患者46例,其中男36例,女10例;年龄36~79岁,平均年龄(67.34±5.23)岁;病理分型:腺癌26例,鳞癌18例,大细胞癌2例;分期为ⅡA、ⅡB型。
纳入标准:①心肺功能差不能进行肺叶切除者;②肿瘤直径≤2 cm者;③CT显示毛玻璃样变50%以上者;④患者无胸腔手术史;⑤能接受随访者。排除标准:①心肺功能差者;②有胸腔手术史者;③合并其他肿瘤者;④精神异常者;⑤存在其他严重疾病者。
1.2 方法
患者全身麻醉后气管插管,健侧单侧通气,于腋前线取4 cm的切口,在监视器下进行腔镜操作,完成解剖肺段切除,术中将病灶、淋巴结和切缘送至冰冻,根据结果决定是否行肺叶切除和纵隔淋巴结清除。
应用GEDiscovery CT750HD宝石CT对患者进行常规和宝石能谱成像(gemstone spectral imaging,GSI)模式增强扫描。电压0.5 ms在140 kVp、80 kVp转换,电流550 mA,碘海醇用量为患者体质量指数×2.5,注射速率3.0 mL/s,加用0.9%氯化钠溶液,采用自动压力追踪法及延迟40 s进行扫描。将图像传送至GEAdvabtageWorkstation4.6工作站,根据WHO、RECIST、mRECIST标准进行检测。采用GSⅡ软件测量静脉晚期中心及边缘区CT、碘含量(I),计算CTmrec、Im-rec。CTm-rec=(中心区+边缘区)/2。CTmrec%=(术后-术前CTm-rec)/术前CTm-rec×100%。Im-rec=(中心区+边缘区)/2。Im-rec%=(术后-术Im-rec)/术前Im-rec×100%。边缘区为手术外缘,坏死区与肿瘤的交界处,中心区为坏死区中心。
1.3 评价指标
对所有患者随访5年,检测病灶最大面积S、最大直径L、强化区最大直径LE、中心和边缘区均值,碘含量均值。WHO、RECST、mRECIST制定CTm-rec、Imrec标准,包括完全缓解(CR)、部分缓解(PR)、病情稳定(SD)、病情进展(PD)。将性别、年龄、新TMN分期、病理类型、清除淋巴结总数、N1淋巴结转移率和第10组淋巴结转移纳入单因素和多因素进行危险因素分析。
1.4 统计学分析
采用SPSS 20.0统计软件进行数据分析。计数资料以频数(n)、百分比(%)表示,行χ2检验,采用秩和检验对预后因素进行单因素生存分析,采用COX比例风险模型进行多因素方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1 CTm-rec、Im-rec的疗效评价标准
CTm-rec、Im-rec的疗效评价标准与WHO、RECIST、mRECIST有所不同,见表1。
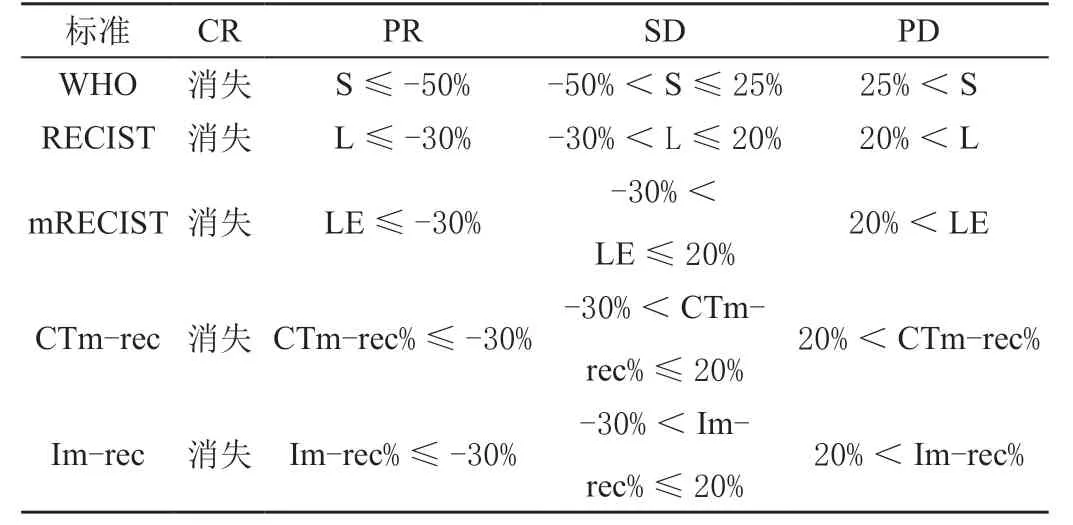
表1 CTm-rec、Im-rec的疗效评价标准
2.2 不同标准敏感性的比较
Im-rec标准中1年生存率随着病变程度的加重下降。RECIST标准中SD、PR、CR之间差异无统计学意义(P>0.05);RECIST、mRECIST中PD、SD,CTm-rec中PR、PD,Im-rec中PR、SD差异有统计学意义(P<0.05)。见表2。

表2 不同标准敏感性的比较
2.3 单因素生存分析
经过随访,5年后46例患者中生存26例,生存率为56.52%。单因素生存分析发现新TNM分期、清除淋巴结总数、N1淋巴结转移率、第10组淋巴结转移与VATS术NSCLC患者的预后有关,见表3。

表3 单因素生存分析
2.4 多因素logistic回归分析
通过logistic多因素回归分析发现,TNM为ⅡA期清除淋巴结总数≤6、N1淋巴结转移>50%、第10组淋巴结转移都是影响VATS术NSCLC患者预后的危险因素(P<0.05),见表4。

表4 多因素logistic回归分析
3 讨论
随着胸腔镜技术的快速发展,VATS在胸外科领域已经广泛普及[6],目前手术是早期NSCLC患者首选的治疗方法,在美国相关指南中,更是成为治疗肺癌的推荐手术[7]。VATS切口在腋前线第4肋间,取消了观察孔,该部位肋间隙宽,胸壁肌层次少,弹性高,对机体的创伤小,疼痛较轻,不影响感觉和运动功能。VATS作为一种微创的手术方法,可最大限度保留肺功能,减轻疼痛[8]。同时,VATS大致还原了开胸手术的手术视角,对于具备开胸手术经验的医师来说,对于这种手术操作和思路与开胸手术相似的VATS,也能够比较轻松地接受、学习和实践应用。GSI能谱CT较普通CT具有较高的时间和空间分辨率,对物质中的成分进行分析,鉴别组织的良恶性、肿瘤分级和分化、疗效的评估[9]。
本研究采用GSI能谱CT对NSCLC患者行VATS术进行评估,提示WHO、RECIST、mRECIST不能评估行单孔VATS NSCLC患者早期预后。Im-rec标准中1年生存率随着病变程度的加重下降。说明Im-rec标准比CTm-rec更为敏感,原因可能是CT受空气和水的影响但是不影响碘含量,碘含量准确反映血管通透性,能够评估肿瘤组织的血含量[10]。
经过随访,5年后46例患者中生存26例,生存率为56.52%。单因素生存分析发现新TNM分期、清除淋巴结总数、N1淋巴结转移率、第10组淋巴结转移与VATS术NSCLC患者的预后有关。第7版TNM分期具有一定的局限性,病例地区不完善,治疗标准不同。本研究中新TNM分期5年生存率差异具有统计学意义(P<0.05)。有资料显示[11-12],低分化的非小细胞肺癌患者其复发风险分别是中分化患者的1.4倍和高分化患者的2.1倍,对于组织分化程度低的患者术后可以给予辅助化疗,杀死残留在体内的癌细胞,从而降低术后复发风险,提高手术效果,对于肺癌的手术治疗,清除淋巴结越多,发生转移的概率越小,但是对患者创伤较大。清除淋巴结数量总数在6个以上生存率越高,N1淋巴结转移率50%以上、第10组淋巴结转移生存率越低。淋巴结转移是肺癌扩散重要的途径。癌细胞首先侵入肺段淋巴结、肺门淋巴结(第10组)、纵隔淋巴结[13]。因此肺门淋巴结是决定有无纵隔转移的关键,是影响预后的重要因素。
需要注意的是,本研究仍存在一定不足,一是研究数据均来源于本院,研究结果只能代表本院的大致情况,缺少多中心的数据支持;二是研究主要针对于行单孔胸腔镜手术治疗的非小细胞肺癌患者,缺少与开胸手术、三孔胸腔镜手术的数据对比;三是本研究为回顾性分析,缺乏临床大规模的前瞻性的分析和研究。
综上所述,Im-rec标准预测行VATS术NSCLC患者的疗效更为准确,CTm-rec预测肺癌复发更为敏感。能谱CT成像有助于评估VATS术NSCLC患者的疗效和预后。其中新TNM分期标准、清除淋巴结总数、N1淋巴结转移率、第10组淋巴结转移与VATS术NSCLC患者的预后有关。
