稀土席夫碱金属配合物绿色合成及其性能研究
2022-06-23张贝贝乔兰情王小艳
张贝贝,乔兰情,王小艳
(皖西学院,安徽 六安 237000)
1 引言
由于席夫碱含有电负性强的原子,它可以形成多种配位方式,有利于与金属形成稳定的金属配合物。某些稀土席夫碱具有特殊的性质和应用[1,2],大量实验研究表明,通过设计合成的稀土配合物不仅提高了活性,而且降低了毒性[3]。此外,其结构也很新颖,有望在光学、电学、医疗、催化剂、储氢、传感器等诸多领域非常广泛地应用,备受关注[4]。
席夫碱的合成方法大多采用水热法、溶剂法等传统合成方法。据相关文献报道,陈子斌等采用水热法合成了一种稀土金属配合物,对其结构和荧光特性进行了研究;李灿辉等运用溶剂法合成了手性希夫碱稀土及过渡金属配合物[5,6]。低温固相法是一种典型的绿色合成方法,反应过程中不需要使用溶剂,兼具减少污染、节能、收率高、副产物少等特点[7]。反应温度接近室温,有着易于控制,便于操作的优点,绿色节能的理念随着社会的发展深入人心,低温固相法因其巨大的优点开始被纳入研究[8,9]。然而,低温固相法合成席夫碱稀土配合物的研究较少。因此,本文以组氨酸和稀土金属镧为原料,采用低温固相一步法合成了氨基酸席夫碱镧配合物,并对其荧光特性进行了研究。
2 实验部分
2.1 实验所用仪器
以水为溶剂,采用上海元析仪器有限公司生产的X-5紫外可见分光光度计测定样品的紫外吸收光谱;红外光谱用北京第二光学仪器厂生产的WQF-310傅里叶变换红外光谱仪,以空气为背景溴化钾压片的方法测定;XRD采用德国布鲁克公司生产的D8-AdvanceX射线衍射仪测定;SU8010扫描电子显微镜,日本日立公司;热重采用南京大展机电研究所生产的TGA105热重分析仪测定;FA-1604电子天平,梅特勒-托利多仪器有限公司;SFZ-D(II)真空泵,巩义市英峪仪器厂等。
2.2 实验所用试剂及纯度
水杨醛、组氨酸、硝酸镧、氢氧化钾、无水乙醇均为分析纯。
2.3 希夫碱镧配合物的合成
在玛瑙研钵中按照摩尔比1∶1∶1依次加入氨基酸,氢氧化钾和水杨醛,混合研磨,研磨起初就有刺鼻气味,玛瑙研钵中为潮湿状物质,继续研磨潮湿状变为糊状物质,约30 min后得到黄色得粉末状固体。将预先研磨充分的5 mol硝酸镧放入玛瑙研钵中与黄色粉末状固体混合后再次研磨,粉末状固体变成黏稠糊状,继续研磨约30 min,然后分别用蒸馏水和少量无水乙醇洗涤,抽滤,于 45 ℃真空干燥箱中干燥约24 h得产物。
3 结果与讨论
3.1 配合物的红外光谱
配体与配合物的红外光谱图相似,说明配合物在结构上相似(图1)。
用红外光谱仪采用KBr压片法,在400~4000 cm-1范围内依次测定了席夫碱配体(b)和席夫碱镧配合物(a)的红外光谱。由图1可看出,在3461 cm-1和3462 cm-1处有宽而强的吸收峰,为产物中配位水和结晶水的羟基伸缩振动吸收峰;1700 cm-1左右没有强吸收峰,也就是说C=O键裂解,表示有席夫碱配体生成。1346 cm-1和1385 cm-1范围内出现的中强吸收峰是C-N的伸缩振动,1610~1630 cm-1左右出现较窄的强吸收峰是亚胺基C=N上的伸缩振动吸收峰,是配体的特征峰,说明组氨酸席夫碱配体已经形成,并且形成组氨酸席夫碱镧配合物后,C=N键向低波数方向移动8~20 cm-1,说明亚胺中的氮原子参与配位[10,11]。
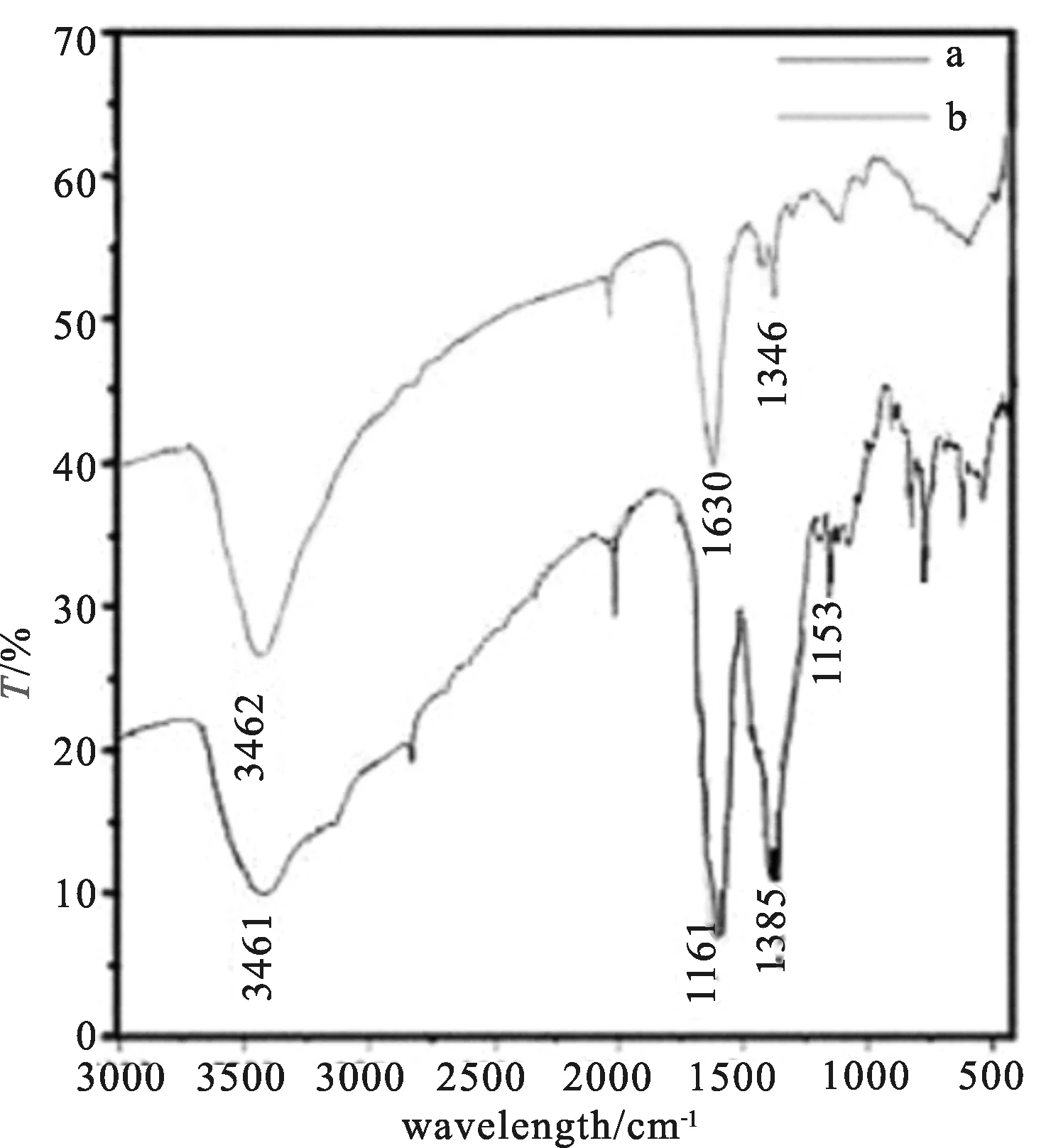
图1 席夫碱配体与席夫碱镧配合物的IR
3.2 配合物的紫外光谱
以水作为为溶剂,在室温的条件下,使用X-5型紫外可见分光光度计在190~600 nm的范围内分别测定组氨酸席夫碱(b)与组酸席夫碱镧配合物(a)的紫外吸收光谱,如图2所示。由图2可以得出,组氨酸席夫碱在与稀土金属镧配位后,生成的配合物的吸收光谱强度和波长均出现了一定的变化,组氨酸席夫碱有3个吸收峰分别在波长254 nm、283 nm、317 nm处。组氨酸席夫碱镧配合物在205 nm、256 nm、处有两个吸收峰,其中205 nm处的吸收峰推测为配体中C=N上的N原子与稀土金属离子La3+配位后,能量降低,使配合物的吸收峰出现一定程度的蓝移,256 nm处推测为配体中苯环上发生π→π*跃迁出现的B吸收带发生蓝移,该结果可认为是组氨酸席夫碱与La3+配位的证据之一。紫外吸收光谱的分析结果证明氨基酸席夫碱配体与稀土金属离子La3+发生了配合作用。
3.3 配合物的热重
在N2保护下,以10 ℃/min的升温速率测定了如图3所示的组氨酸席夫碱金属配合物的TGA曲线。由TGA曲线可见,该配合物在315 ℃以前,失重的百分率为12.7%,理论值为11.9%,这是配合物中结晶水失去的过程,经计算为失去3个结晶水,配合物主体结构没有坍塌,表明低温固相法一步制备得到的此配合物具有较好的热稳定性。配合物于315~394 ℃之间,出现较大的失重,失重的百分比为38.6%;394~466 ℃之间失重率为17.7%,理论值为19.5%,此过程为有机物分解产物为La2(CO3)3;配合物于466 ℃时,质量恒重,这是因为有机物已经完全失去,第三阶段所余下的La2(CO3)3也分解,最后的剩余物质为La2O3。经计算,组氨酸席夫碱金属配合物的分配比为La∶Schiff∶H2O=1∶1∶3[12]。
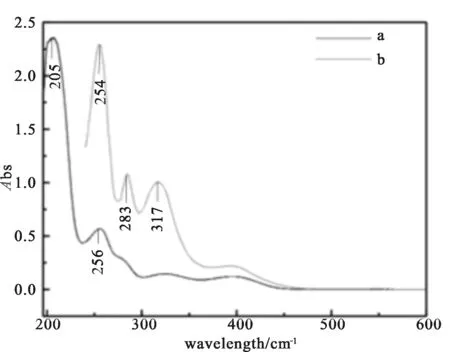
图2 席夫碱配体与席夫碱镧配合物的UV
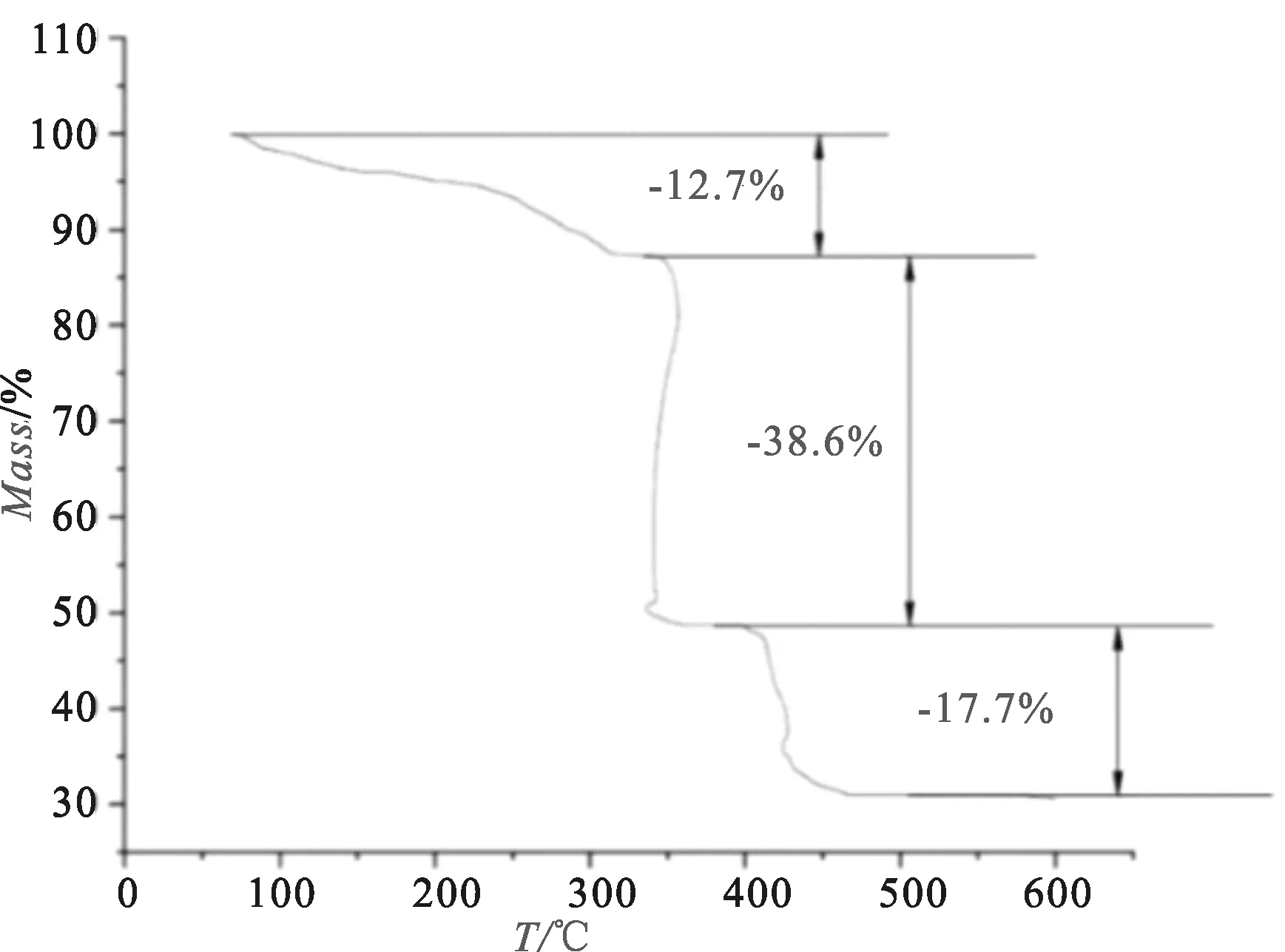
图3 组氨酸席夫碱镧配合物TGA
3.4 配合物的扫描电镜SEM
利用扫描电子显微镜对配合物的形貌进行检测分析,加速电压为5.0 kV。如图4所示,组氨酸席夫碱镧配合物外观为不规则颗粒固体,表面有多个孔状结构,且为层层堆叠的形态,也就意味着该配合物具有较大的比表面积,该结构有可能成为某些小分子载体进行反应催化的场所,或是作为载体参与反应。同时,该结构也为配合物在其他领域的应用提供了良好的保障。
3.5 配合物的元素分析
在室温条件下席夫碱镧配合物元素分析结果列于图5,从图中数据可以看出该配合物中含有La、O、C、K、N等元素,由热重分析得到的配合物的分配比计算得各元素的理论含量分别为La32.1%,O22.2%,C36%,N9.7%(元素H含量极少,忽略不计)。但因配合物中残留有钾盐,使各元素含量的实际值与理论值存在偏差,推测这种钾盐为碳酸钾,除去钾盐后计算得实际值分别为La39.7%,O24.4%,C28.4%,N7.4%,与理论值相近,近似符合热重分析计算结果。该配合物中La元素的含量最高,其他依次是O及其他元素,且该区域富含La元素,说明La已经掺杂入配合物中,不是单独的混合,即可确定镧已与席夫碱配位生成席夫碱镧配合物[13]。

图4 组氨酸席夫碱镧配合物的SEM
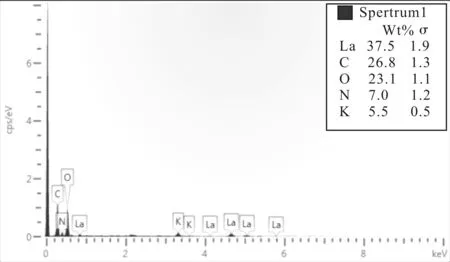
图5 席夫碱镧配合物元素分析数据
3.6 配合物的荧光光谱
在室温的条件下,以乙醇为溶剂用RF-5301PC型荧光光度计在500~700 nm范围内测定了组氨酸席夫碱镧配合物发射光谱,如图6所示。从图6中能够看出该配合物具备荧光性质,其在激发波长为328.0 nm的条件下,发射峰位置在605 nm处,据相关文献报道2016年贾蕊等人合成的Eu-La混合二元稀土配合物在激发波长λex=340 nm的测试条件下其荧光光谱覆盖了390~680 nm的波长范围[14]。本研究中所合成的配合物与其有着相似的激发波长和发射波长,可推测为配合物中La3+发光。
稀土La3+离子在组氨酸席夫碱配体中产生了较强荧光发射光谱,其荧光发射峰处于605 nm的D→F跃迁,跃迁强度约220a.u.产生该荧光的原因是稀土金属离子La3+有未充满的4f电子,其具有适中的最低激发态,组基酸席夫碱配体吸收光之后,由基态跃迁到最低激发单重态,通过转化和系间窜跃的方式达到其最低激发三重态,并将吸收的能量转移至La3+,La3+可直接被激发后跃迁回到基态发射出m→m*类型荧光[15]。由于配体平均三重态能级较高,并且能与稀土金属离子La3+很好的匹配,配体与金属离子之间的能量传递效率较高,所以表现出较强的荧光性能。
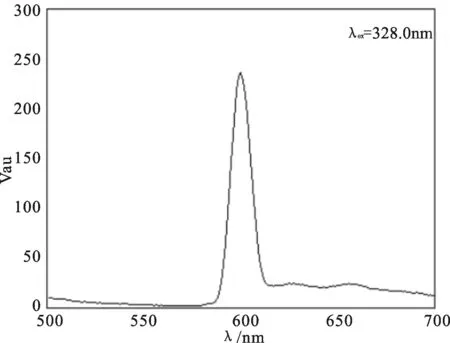
图6 组氨酸席夫碱镧配合物荧光
4 结论与讨论
创新性地通过低温固相法这种绿色合成方法成功合成了稀土席夫碱金属配合物,与传统的液相法相比较,低温固相法具有制备工艺简单、高选择性、高产率、污染小、成本低等特点。
通过热重差热分析、扫描电镜SEM等方法来分析稀土席夫碱金属配合物的结构,已知席夫碱镧配合物为不规则颗粒固体,有较大的比表面积,该结构有可能成为某些小分子载体用于其他材料制备的催化场所。再利用荧光谱图可以看出荧光强度较大,稳定性较高,这也说明了此化合物具有荧光性能,可以用作发光材料,也为今后探索席夫碱镧配合物的其他应用提供了非常重要的实验依据。
