长春瑞滨药动学及毒副作用研究进展
2022-06-23刘花陈延绅尤慧柠冯燕李敏寇建蓉魏俊松封卫毅
刘花 陈延绅 尤慧柠 冯燕 李敏 寇建蓉 魏俊松 封卫毅
关键词抗肿瘤药;长春瑞滨;药动学;疗效;毒副作用;药效学指标
多数化疗药的体内药动学过程受患者个体因素的影响,加之缺乏疗效监测的有效指标和药动学参数靶值,使得化疗药的疗效监测和最佳给药方案制订成为提高抗肿瘤疗效的难点。长春瑞滨(vinorelbine,NVB)是一种通过抑制微管蛋白发挥抗肿瘤作用的半合成长春花生物碱,主要用于治疗晚期非小细胞肺癌和晚期乳腺癌,现已被纳入多种肿瘤的治疗指南。NVB血药浓度与疗效和毒性密切相关,其较小的变化即有可能降低疗效甚至产生严重的毒副作用,但由于其临床数据有限,目前主要依赖临床经验给药,因此,在一定程度上存在着用药风险[1]。基于此,笔者对NVB的药动学特点及影响因素、毒副作用的影响因素、药动学在给药方案调整中的应用现状进行归纳总结,以期为NVB临床合理使用提供参考。
1 NVB的药动学特点
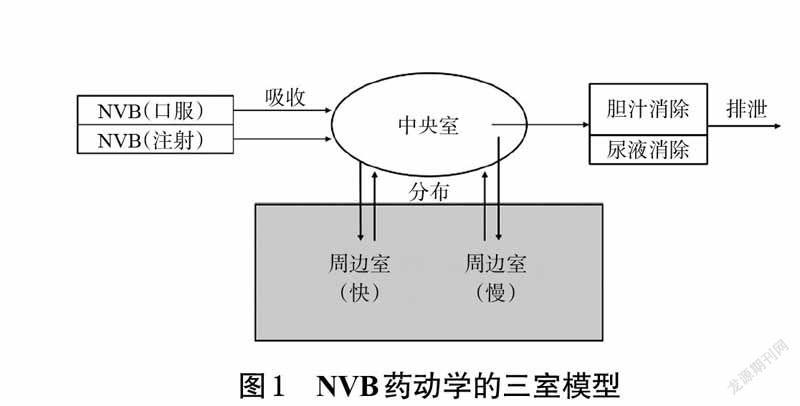
NVB 包括静脉注射和口服2 种剂型,静脉注射NVB 25 mg/m2与口服60 mg/m2具有生物等效性[2]。血小板是NVB的主要载体,两者结合率高达78%,而NVB的血浆蛋白结合率仅13.5%,因此全血比血浆更能准确地反映NVB的药动学特点[3]。NVB的药动学符合一级消除动力学的三室模型(见图1),其体内分布几乎不受药物剂量大小的影响,表观分布容积为23~75.6 L/kg[4]。NVB主要通过CYP3A4 酶代谢,约有10%通过羧酸酯酶代谢并产生唯一的活性代谢产物4-O-去乙酰基长春瑞滨(DVRL);两者主要通过胆汁排泄,仅有少部分通过尿液排泄[5]。研究表明,NVB静脉注射15~45 mg/m2和口服60~100 mg/m2时,血药浓度与给药剂量呈线性相关性[5-6]。常规化疗时,NVB静脉注射后全血cmax为852~1 024 ng/mL,口服后全血cmax为133~143 ng/mL[4]。
2 NVB药动学的影响因素
2.1 年龄
长春碱类抗肿瘤药对儿童肿瘤具有较好的临床疗效,是儿童肿瘤一线治疗方案使用较多的一类药物[7-8]。在一项临床研究中,研究者同时测定了儿童[(8.7±3.6)岁]和成人[(55.0±11.1)岁]静脉注射NVB 25 mg/m2的药动学参数,结果表明,NVB根据体表面积标准化的清除率和药物暴露量在儿童和成人之间是等效的,不具有统计学差异[9]。在另一项临床研究中,研究者对29 名未成年患者(2~17 岁)口服和静脉注射NVB的有效性和安全性进行了评估,结果表明,未成年患者口服和静脉注射NVB的清除率均比使用相同剂量的成人高,其中静脉注射NVB 的清除率比成人高40%[10]。然而,由于该项研究测定的是患者血浆中的NVB浓度,因此该结果的可靠性存疑。
老年患者由于生理因素或并发症的影响,使得化疗药物的药动学参数可能发生改变,因此,为了在保证药物疗效的同时降低其毒副作用,通常需调整其常规给药剂量。然而,与其他人群相比,老年患者(年龄>70 岁)口服NVB的生物利用度、药物暴露量、清除率以及消除半衰期等药动学参数均无显著性差异[2]。
虽然人体生长发育所引起的生理因素变化会直接影响药物的代谢过程,从而导致药物疗效和毒性的改变,但目前多数研究认为当NVB根据体表面积给药时,未成年人和老年人不需要降低药物剂量。
2.2 机体成分
机体成分受多种因素(比如年龄、性别和疾病等)影响,即使身高和体质量相同的个体之间,机体成分也可能存在较大差异[11]。脂肪组织对药物的清除几乎没有影响,但是瘦体重(lean body mass,LBM)和脂肪组织的相对比例可能会通过影响药物的结合、分布、代谢进而影响药物的疗效和毒性[12]。最近有研究指出,LBM与化疗药物的毒性之間具有显著相关性,低LBM患者发生药品不良反应的风险更高[13]。当NVB依据体表面积给药时,每千克LBM所含药物剂量差异很大,为1.4~3.6mg/kg[14]。目前,包括NVB在内的多数化疗药物通常以体表面积作为确定治疗剂量的唯一方法,因而不可避免地导致了药物毒副作用的发生。因此,美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)建议:针对肥胖肿瘤患者,应根据其实际体质量制订给药方案[15]。
2.3 肝功能
肝功能障碍会导致长春碱类抗肿瘤药(如长春新碱、长春碱)代谢受阻,机体药物暴露量增加。虽然目前有关NVB 在不同肝功能损伤患者中的药动学研究较少,但肝脏是NVB的主要代谢途径,由此笔者推测NVB的药动学过程可能会受到肝功能障碍的影响。一项临床研究以胆红素、谷草转氨酶/谷丙转氨酶水平作为患者肝功能损伤程度的评价指标,观察相同治疗方案下肝功能损伤程度对静脉注射NVB 药动学的影响。结果发现,与肝功能正常患者比较,轻中度肝功能损伤患者的清除率和稳态分布容积差异无统计学意义[16]。因此,笔者认为轻中度肝功能损伤患者无须调整NVB的给药剂量。另一项研究也指出,当NVB采用标准剂量30 mg/m2给药时,肝功能损伤程度与NVB的清除率未见明显相关性[17]。然而,这些研究均未测定游离型NVB和活性代谢物(DVRL)的浓度。由于这两者的浓度可能比结合型NVB更易受到肝功能损伤的影响,因此,为了避免毒副作用的发生,笔者建议应适当降低肝功能损伤患者NVB的给药剂量。目前对肝功能损伤患者使用NVB的药动学研究数据不足,且不同地区对不同程度肝功能损伤的评价标准不统一,笔者建议可按美国FDA推荐给药:当胆红素水平≤2 mg/dL 时,NVB的使用剂量为30 mg/m2;当胆红素水平为2.1~3.0 mg/dL 时,NVB的使用剂量为15mg/m2;当胆红素水平>3.0 mg/dL 时,NVB的使用剂量为7.5 mg/m2[18]。
2.4 药物相互作用
为了提高化疗疗效或改善化疗引起的毒副作用,肿瘤患者常同时使用多种药物,而这些药物有可能通过改变胃肠道pH、肝药酶活性等影响药动学参数,如甲硝唑和氟康唑可通过抑制细胞色素P45(0 CYP450)3A4(CYP3A4)酶活性导致NVB 的曲线下面积(area under the curve,AUC)增加[19]。在临床治疗中,虽然NVB常与其他化疗药物联合使用,但有关其联合化疗时的药动学研究相对较少。已有研究表明,当NVB联合顺铂、多西他赛、卡培他滨时,其药动学参数与单独使用时相似,因此认为顺铂、多西他赛、卡培他滨没有引起NVB药动学的改变[20-22]。由此推测,这些药物的主要代谢途径可能与NVB不同。
酪氨酸激酶抑制剂是一种抗肿瘤的小分子靶向药物,主要通过CYP450酶代谢,特别是CYP3A4/5 酶[23]。目前有关NVB与酪氨酸激酶抑制剂联用的药动学研究出现了不一致的结论:当与拉帕替尼、索拉非尼联用时,NVB清除率显著降低、cmax显著升高,这可能是因为拉帕替尼和索拉非尼均为CYP3A4 酶的抑制剂,可使CYP3A4 酶失活,进而导致NVB的体内蓄积[24-25];然而当与吉非替尼、来那替尼、阿法替尼联用时,则不会引起NVB药动学的改变,但具体原因尚不清楚[26-27];另一项有关NVB联合吉非替尼的体外研究指出,由于NVB和吉非替尼对CYP3A4 酶产生了竞争性抑制作用,从而导致两者联合用药时药动学不存在相互影响[28]。
2.5 其他因素
2.5.1 食物通常药物的口服生物利用度会因为食物的摄入而发生改变。Bugat 等[29]的研究显示,虽然NVB空腹服用比进食后服用的血药浓度达峰时间快,但其cmax和AUC并未发生显著性改变,同时NVB的有效性和安全性也没有发生变化;与正常饮食相比,高脂饮食会降低NVB的机体暴露量,但血药浓度达峰时间则没有发生改变。由此可知,食物对NVB药动学参数的影响较小,但是该研究指出食物会降低NVB引起的呕吐发生率,因此建议在饭后口服NVB。
2.5.2 人种人种差异也可能会引起药物生物利用度和代谢的改变,例如不同人种之间CYP3A5 酶的表达差异,可导致长春新碱神经毒性的不同[30]。由于NVB主要通过CYP3A4 酶和羧酸酯酶代谢,而这2 种酶在不同人种之间不存在高度的功能多态性,因此亚洲患者和欧洲患者使用NVB的生物利用度和清除率等药动学指标相似[31]。
3 NVB毒副作用的影响因素
口服或静脉注射NVB均可引起血液学毒性和胃肠道反应,其中血液学毒性是NVB的主要不良反应,如中性粒细胞减少、白细胞减少和贫血等。在临床用药中,多种因素会潜在地影响NVB毒副作用的产生,比如药物剂量、给药方案以及联合用药等。
3.1 药物剂量
便秘是NVB引起的胃肠道主要不良反应之一,其发生与NVB的机体暴露量有关,而与剂型无关,且发生便秘的患者体内药物AUC 值更高[32]。相关研究指出,NVB可耐受毒性血药浓度的上限为1.57 ng/mL,DVRL可耐受毒性血药浓度的上限为3.04 ng/mL,但两者可耐受毒副作用的药物剂量上限的确定是基于对具有临床疗效且无严重毒副作用患者的临床观察,因此,尚不足以作为肿瘤治疗有效剂量设定的依据[33]。
3.2 给药方案
NVB的毒副作用不仅受药物剂量的影响,还受给药方案的影响。节拍化疗是一种小剂量给药、短间隔期的持续给药方案。在临床治疗中,NVB节拍化疗方式为每周3 次、每次口服20~70 mg,其稳态血药浓度会随着剂量的增加而增加,但是不同给药剂量的平均稳态血药浓度差异无统计学意义,且在长期治疗(>5 个月)中保持稳定,不会引起药物蓄積[34]。有研究指出,治疗效果较好的患者NVB血药浓度比因疾病进展或恶化而终止治疗的患者低,同时疾病稳定期长(>6 个月)的患者血药浓度比疾病稳定期短(3~6 个月)的患者低,由此表明,NVB采用节拍化疗方案时,其较高的血药浓度可能会降低肿瘤患者的治疗效果[35]。在一项NVB节拍化疗的临床研究中,研究者将患者随机分为3 组,分别予以NVB30、40、50 mg口服,每周3 次。结果表明,这3 组患者的无进展生存期、总生存期和严重不良反应发生率差异无统计学意义,但患者口服NVB 30、40 mg后淋巴细胞减少发生率较高,口服40 mg 后胃肠道反应发生率较高[36]。由此推测,NVB较低的血药浓度也可能会对肿瘤患者的治疗产生不利的影响。
3.3 联合治疗
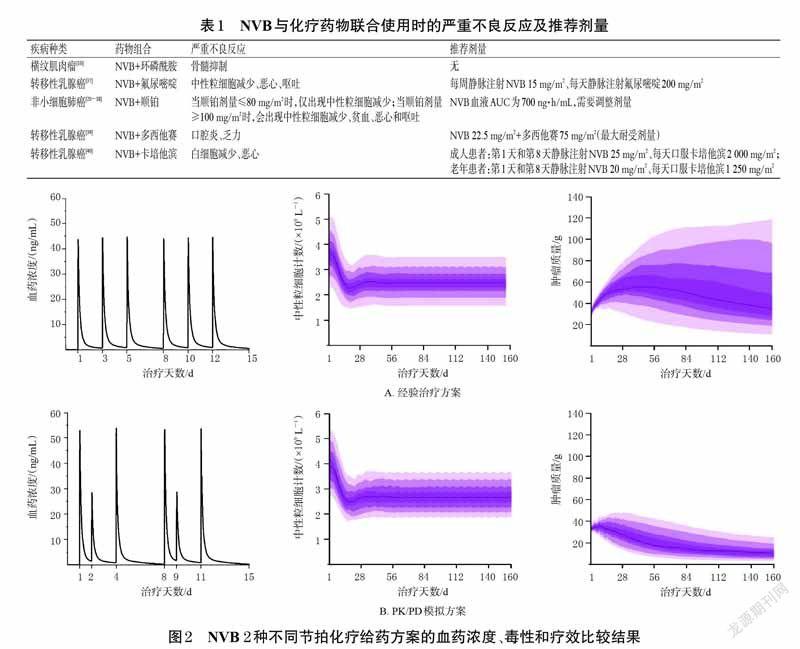
在晚期肿瘤的治疗中,NVB常与其他化疗药物联合使用,比如铂类、蒽环类等,可在提高抗肿瘤疗效的同时降低严重不良反应的发生率。NVB常见联合化疗方案的严重不良反应和推荐剂量见表1。此外,有研究指出NVB还能提高放疗的疗效,尤其是对处于G2期的肿瘤细胞效果最好[41]。然而,对于非小细胞肺癌老年患者,在使用标准剂量的NVB合并放疗时,严重放射性肺炎的发生率较高,且年龄是导致严重放射性肺炎的高风险因素,因此老年患者应慎重使用NVB联合放化疗方案[42]。
由于缺乏灵敏有效的药效学监测生物标志物,大多数化疗药物会根据毒副作用的严重程度作为剂量是否调整的依据。临床实践中,通常以血清学指标和肝功能指标来评价药物的毒副作用。胆红素是表征肝功能的重要指标,当中度肝功能损伤(胆红素1.5~3.0 mg/dL)患者静脉注射NVB 15 mg/m2和严重肝功能损伤(胆红素>3.0 mg/dL)患者静脉注射NVB 7.5 mg/m2 时,3~4级不良反应发生率较高[17]。因此,有研究者认为,胆红素>2 mg/dL 时,NVB常规使用剂量应减少50%;也有研究者认为,胆红素≤3 mg/dL时,不需要调整剂量[43]。
4 NVB药动学在给药方案调整中的应用
人體的多种因素,如年龄、性别、体表面积、肝肾功能等,共同决定了药物的吸收、分布、代谢和排泄,从而导致了个体之间的药动学差异,因此,不能通过给药剂量来简单地预测化疗药物的机体暴露水平[44]。最佳给药方案的确定是肿瘤治疗方案优化过程的关键问题。药动学/药效学(PK/PD)模型是利用药动学和药效学数据与数学模型结合,通过计算机模拟大量不同给药方案,并从中筛选出最佳方案。目前,这个模型已经在一些化疗方案的制订尤其是节拍化疗中尝试应用,如替莫唑胺治疗神经胶质瘤、NVB治疗肺癌以及吉西他滨治疗成神经细胞瘤等[45-47]。在一项NVB节拍化疗治疗非小细胞肺癌和恶性胸膜间皮瘤的临床试验中,研究者采用PK/PD 模型确定了最佳给药方案并在20 名患者中进行验证。结果表明,每周给药总量相同的条件下,模拟的理论方案(第1、2、4 天分别口服60、30、60 mg)比经验方案(隔天口服50 mg)具有更好的临床疗效和更小的毒副作用(具体结果见图2)[43]。值得注意的是,患者的个体差异以及不同给药方案之间的变异性是PK/PD 模型参数评估的主要影响因素,因此在应用PK/PD进行给药方案优化时,应尽可能地收集准确完整的药动学数据,提高PK/PD模型预测的临床实用性。
5 结语
NVB的药动学不受饮食、年龄、人种等因素的影响,长期治疗过程中能够保持稳定的吸收和排泄,且不会引起体内药物蓄积,在临床肿瘤治疗中具有较大的潜力。尤其是NVB口服制剂,不仅提高了患者的用药依从性,还降低了患者的就诊次数和经济负担,现已被应用于多种肿瘤的治疗。然而NVB作为细胞毒性化疗药物也具有治疗窗窄、血药浓度与疗效/毒性之间关系不明等缺点,从而使其最佳给药方案的制订面临巨大挑战。与此同时,缺乏灵敏可靠的药效学监测指标是进行NVB药动学监测的主要限制因素。事实上,NVB的药效学预测指标已经不仅仅局限于胆红素、谷丙转氨酶以及谷草转氨酶等传统的肝功能指标。有研究发现,白细胞和中性粒细胞的最低百分比与血液中的AUC和24 h 血药浓度显著相关,由此推测,白细胞和中性粒细胞的最低百分比有可能成为NVB疗效和毒性预测的指标[29]。也有研究发现,二甲苯胺、白蛋白、凝血酶原时间和肝消除标记99mTc-MIBI 可能是NVB药效学的潜在预测因子[48]。尽管一些指标与NVB的体内药动学存在统计学关系,但尚未确定一个足够可靠的指标作为NVB给药剂量的计算依据。因此,寻找灵敏有效的生物学监测指标,尤其是能够准确反映特殊人群(比如儿童、老年人、肝功能不全患者等)药动学特点的指标,建立行之有效的监测方法,对于及时调整NVB治疗方案、提高治疗效果、减轻毒副作用均具有重要的意义。
