文拉法辛联合长春西汀在大鼠体内的药代动力学研究
2022-06-23麦麦提艾力·色依提孙钰淑孙玲李文芳刘茜
麦麦提艾力·色依提 孙钰淑 孙玲 李文芳 刘茜
关键词文拉法辛;长春西汀;药代动力学;药物相互作用;代谢;大鼠
抑郁症是一种由生理、心理以及社会环境因素等导致的临床常见复杂疾病。抑郁症患者情绪低落、悲观,生理上表现为思维迟缓、失眠、躯体不适,当抑郁症发展到严重阶段,甚至会产生自残自杀行为[1]。抑郁症难以治愈,复发率高,29%~66%的抑郁症患者使用单一抗抑郁药物进行治疗时不能完全恢复[2-4]。
文拉法辛(venlafaxine,VEN)为第2 代非三环苯乙胺类抗抑郁药,通过阻滞突触前膜的5-羟色胺、去甲肾上腺素以及部分多巴胺重摄取从而治疗抑郁症[5]。VEN口服吸收速度快,不良反应小,是治疗抑郁症尤其是难治性抑郁症的首选药物之一[6-7]。VEN体内主要代谢产物是N-去甲文拉法辛(N-desmethylvenlafaxine,NDV)和O-去甲文拉法辛(O-desmethylvenlafaxine,ODV),其中ODV 由VEN 通过细胞色素P450(CYP450)酶CYP2D6(89%)、CYP2C19(10%)和CYP2C9(1%)代谢生成,具有抗抑郁活性,且作用效果与VEN类似[8]。欧洲精神病药理学会与神经精神药理学会发布的治疗药物监测指南中推荐对VEN及ODV的血药浓度进行监测[9]。
长春西汀(vinpocetine,VIN)可抑制钙离子依赖性磷酸二酯酶的活性,增加环磷酸腺苷的含量,松弛血管平滑肌,增加脑灌注量,常用于治疗心血管疾病及抑郁症[10]。VIN体内吸收快速,约75%被迅速水解为活性代谢物阿朴长春胺酸(apovincaminic acid,AVA),致使VIN在血浆中的浓度较低。VIN 和AVA药理活性具有显著的相关性,检测AVA 即可反映VIN 的药代动力学行为[11-12],因此本研究只测定AVA的血药浓度。
患者抑郁症发作时,进行VEN联合VIN 治疗,可明显降低其汉密尔顿焦虑量表评分,且疗效较单用VEN明显提高[13-14]。VEN代谢过程中涉及多种CYP450同工酶,而VIN对其中CYP3A4、CYP2D6 均有一定抑制作用,从而影响VEN 的代谢[15-16]。基于此,本研究采用液相色谱- 串联质谱(LC-MS/MS)法测定大鼠血浆中VEN、ODV、AVA 的浓度,进而研究VIN 联用VEN 的药代动力学,考察两者的相互作用,以期为两者合理用药提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有1100 型高效液相色谱仪(美国Agilent 公司)、API2000 型三重四极杆质谱仪(美国ABSciex 公司)、管式加热L-119A型氮吹仪[来亨科技(北京)有限公司]、DW-86W100 型卧式超低温保存箱(青岛海尔特种电器有限公司)、BS 124S 型电子天平[赛多利斯科学仪器(北京)有限公司]、KQ-50B型超声波清洗器(昆山市超声仪器有限公司)、LG10-2.4A型高速离心机(北京雷勃尔离心机有限公司)。
1.2 主要药品与试剂本研究所用主要药品与试剂有VIN对照品(广东健坤药业有限公司,含量100.2%,批号151221-41815003),VEN、ODV对照品(上海麦克林生化科技有限公司,含量均大于99.5%,批号分别为M00118009、C10034477),AVA对照品(国家标准物质资源平台,含量99.5%,批号101439-201901),多潘立酮对照品(信阳市中检计量生物科技有限公司,含量99.8%,批号100304-201103);甲酸、甲醇、乙腈为色谱纯,甲基叔丁基醚、无水碳酸钠为分析纯,其余试剂为实验室常用规格,水为纯净水。
1.3 动物本研究所用动物为SPF 级雄性SD 大鼠,体质量为180~200 g,购自沈阳药科大学实验动物中心,实验动物生产许可证号为SCXK(辽)2019-0058。
2 方法与结果
2.1 色谱与质谱条件
2.1.1 色谱条件(1)色谱条件一(检测VEN、ODV):
色谱柱为Agilent TC-C1(8 150 mm×4.6 mm,5 μm),保护柱为Agilent-C18(12.5 mm×4.6 mm,5 μm);流动相为甲醇-乙腈-0.5%甲酸溶液(50 ∶ 45 ∶ 5,V/V/V);流速为800μL/min;柱温为40 ℃。(2)色谱条件二(检测AVA):色谱柱为Agilent TC-C1(8 150 mm×4.6 mm,5 μm),保护柱为Agilent-C18(12.5 mm×4.6 mm,5 μm);流动相为甲醇-乙腈溶液(85 ∶15,V/V);流速为800 μL/min;柱温为40 ℃。
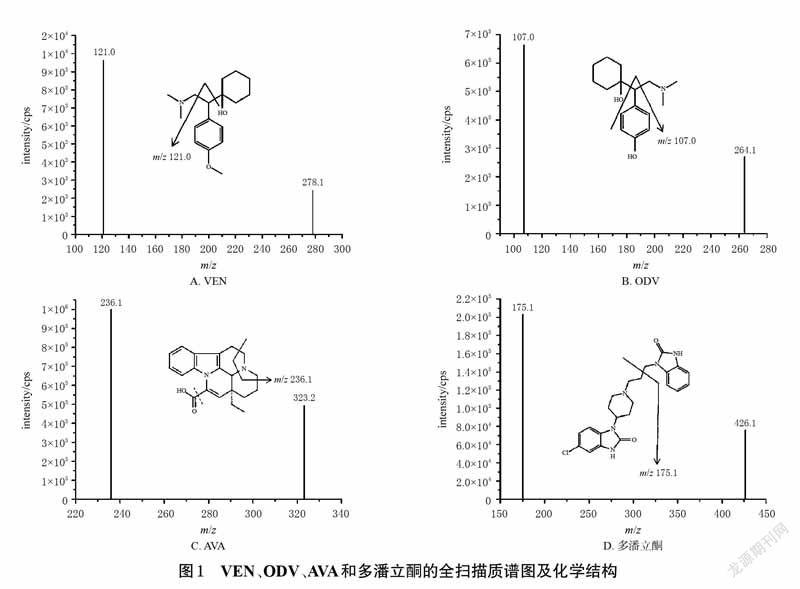
2.1.2 質谱条件采用电喷雾离子源,正离子检测,多反应监测扫描;离子源温度为450 ℃,离子源喷射电压为5.5 kV;气帘气压力为20 psi;喷雾气、辅助加热气压力均为70 psi;碰撞气体压力为7 psi;VEN、ODV、AVA及多潘立酮(内标)的去簇电压分别为22、23、100、55eV,碰撞能量分别为30、34、33、37.2 eV;定量分析离子对分别为m/z 278.1→m/z 121.0(VEN)、m/z 264.1→m/z107.0(ODV)、m/z 323.2→m/z 236.1(AVA)、m/z 426.1→m/z 175.1(内标)。VEN、ODV、AVA和多潘立酮的全扫描质谱图及化学结构见图1。
2.2 标准溶液的配制精密称定VEN、ODV、AVA对照品各10 mg,分别置于100 mL 量瓶中,以甲醇溶解定容,即得VEN、ODV、AVA质量浓度均为100 μg/mL的储备液。取上述各成分储备液适量,分别用甲醇稀释成质量浓度均为5、10、50、100、500、1 000、2 000、5 000 ng/mL的系列标准溶液。同法制备VEN、ODV、AVA质量浓度均分别为10、100、4 000ng/mL的质控(QC)工作溶液。
2.3 标准血浆样品与QC样品的配制取VEN、ODV、AVA相同质量浓度的系列标准溶液各50 μL 于同一5 mL离心管中,共8 份,加入500 μL 空白血浆,配制成VEN、ODV、AVA质量浓度均分别为0.5、1、5、10、50、100、200、500 ng/mL 的标准血浆样品,备用。另取VEN、ODV、AVA的QC工作溶液各50 μL,加入500 μL 空白血浆,涡旋1 min,制备VEN、ODV、AVA质量浓度均分别为1、10、400 ng/mL的QC样品,备用。
2.4 血浆样品的预处理方法2.4.1 VEN及ODV血浆样品的预处理取100 μL大鼠血浆,加入200 ng/mL 内标溶液10 μL,涡旋1 min;加入0.1 mol/L 碳酸钠溶液100 μL,涡旋1 min,再加入甲基叔丁基醚3 mL,渦旋震荡20 min;以12 000 r/min 离心10min,取上清液,置于另一离心管,以37 ℃氮气吹干,残渣加100 μL 甲醇-乙腈-0.5%甲酸溶液复溶,取20 μL 进行LC-MS/MS分析。
2.4.2 AVA血浆样品的预处理取100 μL大鼠血浆,加入200 ng/mL 内标溶液10 μL,涡旋30 s;加入1 mol/L 盐酸100 μL,涡旋30 s,再加入乙酸乙酯3 mL,涡旋1 min;以3 500 r/min 离心10 min,取上清液,置于另一离心管,以37 ℃氮气吹干,残渣加100 μL 甲醇-乙腈溶液复溶,取20 μL进行LC-MS/MS分析。
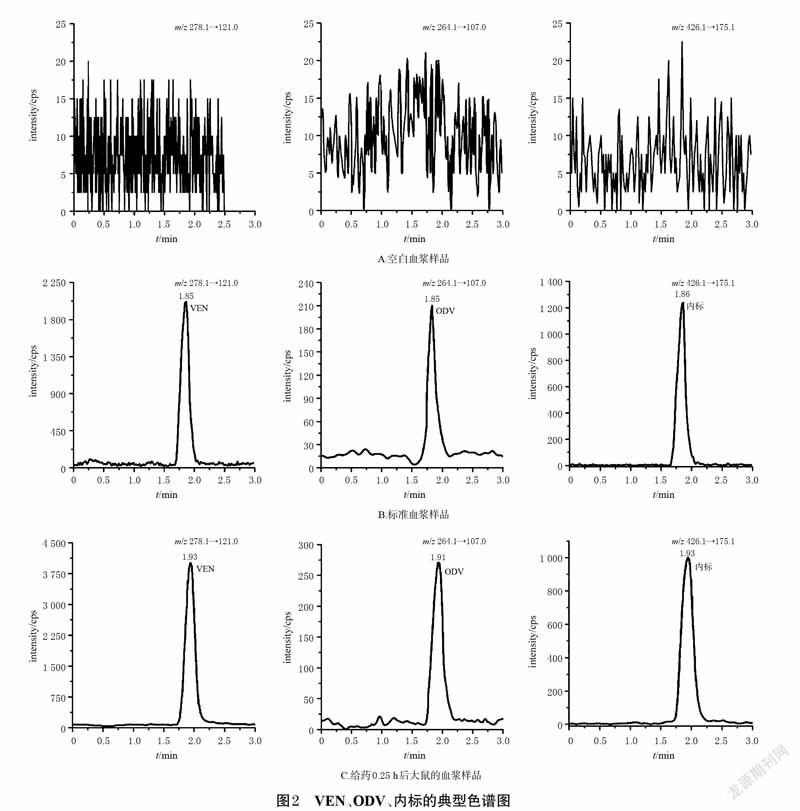
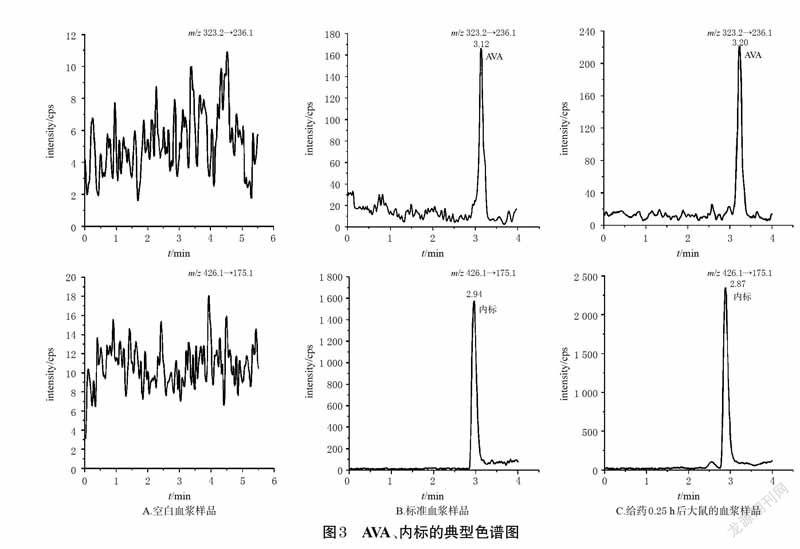
2.5 方法学考察2.5.1 专属性考察取大鼠空白血浆100 μL,除用10μL甲醇替代内标外,其余操作同“2.4”项下2 种血浆样品的预处理方法分别处理后,再按“2.1”项下条件进样分析。按“2.3”项下方法操作,配制VEN、ODV、AVA、内标质量浓度分别为0.5、0.5、0.5、200 ng/mL 的标准血浆样品,再按上述方法处理后进样分析。取“2.6”项下给药0.25 h 后单只大鼠血浆样品,再按上述方法处理后进样分析。结果显示,VEN、ODV、内标的保留时间分别为1.85、1.85、1.86 min,AVA、内标的保留时间分别为3.12、2.94 min(均以标准血浆样品计),表明该法血浆中内源性物质不干扰目标分析物。结果见图2、图3。
2.5.2 线性关系与定量下限考察取“2.3”项下配制的标准血浆样品,按“2.4”项下2 种血浆样品预处理方法操作,再按“2.1”项下条件进样分析,记录图谱。以VEN、ODV、AVA质量浓度为横坐标(X),VEN、ODV、AVA分别与内标的峰面积比值为纵坐标(Y),采用加权最小二乘法[17]进行线性回归。结果显示,VEN、ODV、AVA的回归方程分别为Y=9.98×10-2X-0.061 2×10-2 (r=0.999 8)、Y=9.86×10-2X+3.81×10-2(r=0.998 1)、Y=9.17×10-2X+3.27×10-3(r=0.995 7),线性范围均为0.5~500 ng/mL,定量下限均为0.5 ng/mL。
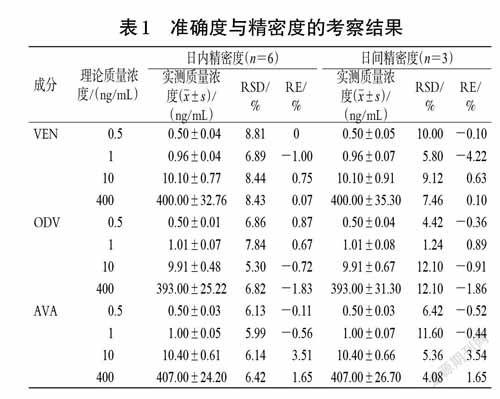
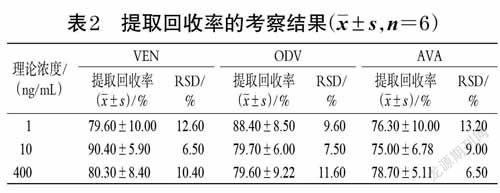
2.5.3 准确度与精密度考察按“2.3”项下操作,配制0.5 ng/mL 的VEN、ODV、AVA定量下限样品,取“2.3”项下质量浓度分别为1、10、400 ng/mL 的QC样品适量,按“2.4”项下方法操作,各质量浓度平行分析6 样本,连续3个分析批。根据所建标准曲线,得各样品的实测质量浓度,并考察日内、日间精密度[以相对标准偏差(RSD)表示]和准确度[以相对误差(RE)表示],结果见表1。
2.5.4 稳定性考察取VEN、ODV、AVA质量浓度均为1、400 ng/mL 的QC样品,按“2.4”项下方法操作,各质量浓度平行分析3 样本,分别考察血浆样品处理前室温放置2 h 和处理后室温放置0、4、8 h 的稳定性,自动进样器放置稳定性,3 次冷冻-解冻循环稳定性和长期稳定性(-70 ℃保存30 d)。结果显示,VEN、ODV、AVA的不同QC样品在上述条件下,实测质量浓度的RSD 均小于14%(n=3),稳定性良好。
2.5.5 提取回收率考察取“2.3”项下VEN、ODV、AVA质量浓度均为1、10、400 ng/mL 的QC样品,按“2.4”项下方法操作,各质量浓度平行分析6 样本,得峰面积均值A。取VEN、ODV、AVA 质量浓度均为10、100、4 000ng/mL的QC工作液各10 μL于不同离心管中,以氮气吹干;另取大鼠空白血浆100 μL,除用10 μL甲醇替代内标外,其余按“2.4”项下方法操作,然后将上清液移至上述氮气吹干的离心管中,涡旋使之充分溶解,再以氮气吹干,加100 μL 甲醇复溶后进样分析,各质量浓度平行分析6 样本,得峰面积均值B。内标同法操作。按公式计算提取回收率(提取回收率=A/B×100%),结果见表2。2.5.6 基质效应考察取VEN、ODV、AVA质量浓度分别为1、400 ng/mL 的QC样品各10 μL 和内标10 μL,以氮气吹干;取大鼠空白血浆100 μL,除不加内标外,其余按“2.4”项下方法操作至取上清液,转移上清液至上述氮气吹干的离心管中,涡旋使之充分溶解,再以氮气吹干,加流动相100 μL复溶,取20 μL进样分析,各质量浓度平行分析6 样本,得到峰面积均值A1。另外,除用水代替大鼠空白血浆外,其余处理同上,得到峰面积B1。以A1/B1计算得VEN、ODV、AVA和内标的基质因子,利用各成分和内标的基质因子计算经内标归一化的基质因子。
结果显示,VEN、ODV、AVA的1 ng/mL QC 样品的基质因子变异系数分别为0.93%、0.98%、1.00%,400 ng/mLQC 样品的基质因子变异系数分别为1.01%、0.96%、0.90%,符合生物样品测定要求。
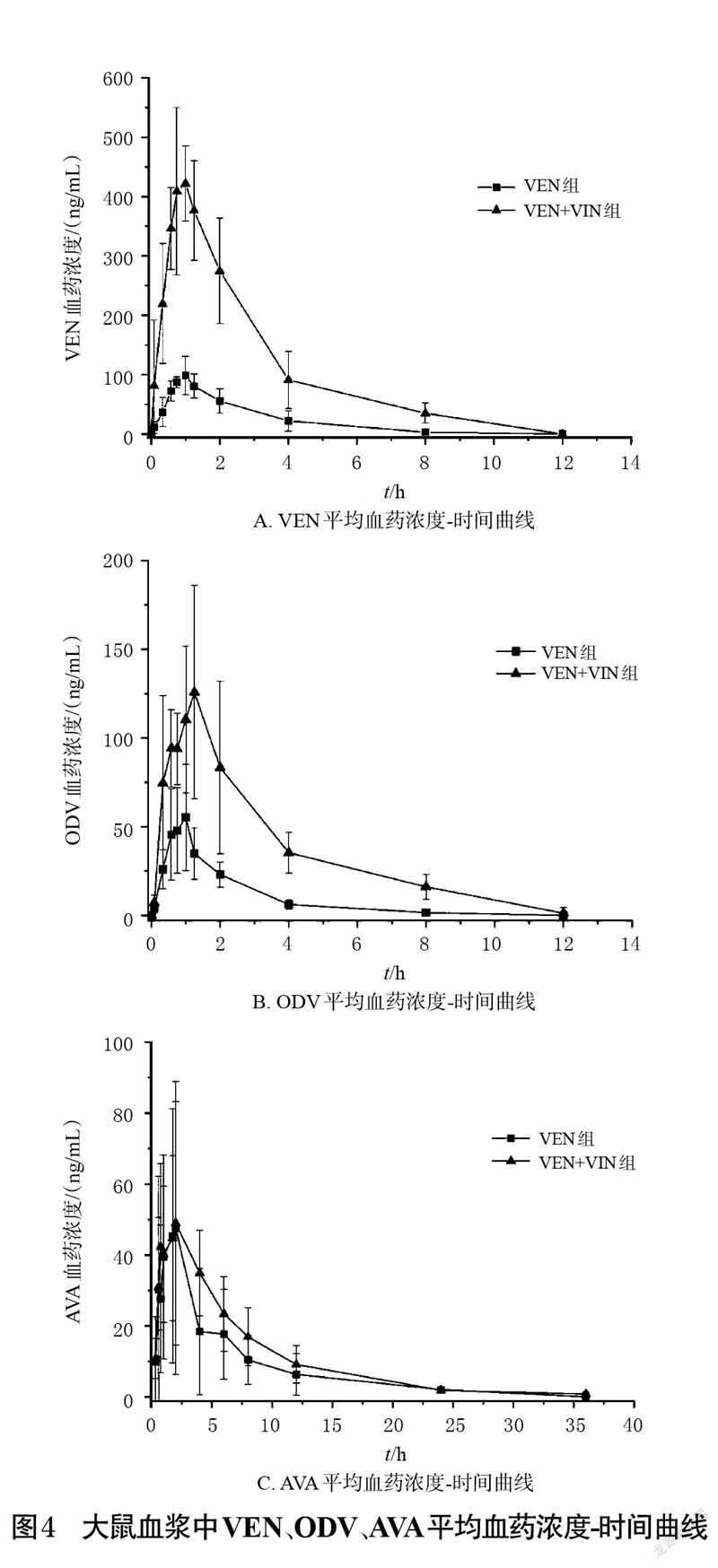
2.6 药代动力学实验将18 只健康雄性SD 大鼠,随机分为VEN 组(13.5mg/kg)、VIN 组(1.8 mg/kg)和VEN+VIN 组(13.5 mg/kgVEN+1.8 mg/kg VIN),每组6 只,给药剂量参考文献[14]设置。给药前,各组大鼠禁食不禁水12 h,一次性灌胃给予相应药物。VIN 组于给药前(0 h)和给药后0.333、0.583、0.75、1、1.25、2、4、6、8、12、24、36 h 采血;VEN组于给药前(0 h)和给药后0.083、0.333、0.583、0.75、1、1.25、2、4、8、12 h 采血;VIN+VEN组于给药前(0 h)和给药后0.083、0.333、0.583、0.75、1、1.25、2、4、6、8、12、24、36 h 采血。每只大鼠均從眼眶静脉丛采血约0.5 mL,并置于肝素处理过的离心管中。各组采集的血浆样品以4 000r/min 离心10 min,取上清液,按“2.4”项下方法处理,按“2.1”项下条件进样分析,记录峰面积,代入当日建立的标准曲线中计算各样品中VEN、ODV、AVA 的质量浓度,再用Origin 9.0 软件绘制大鼠单独灌胃给予VEN、VIN及联合灌胃给予VEN和VIN后血浆中VEN、ODV、AVA的平均血药浓度-时间曲线。结果见图4。
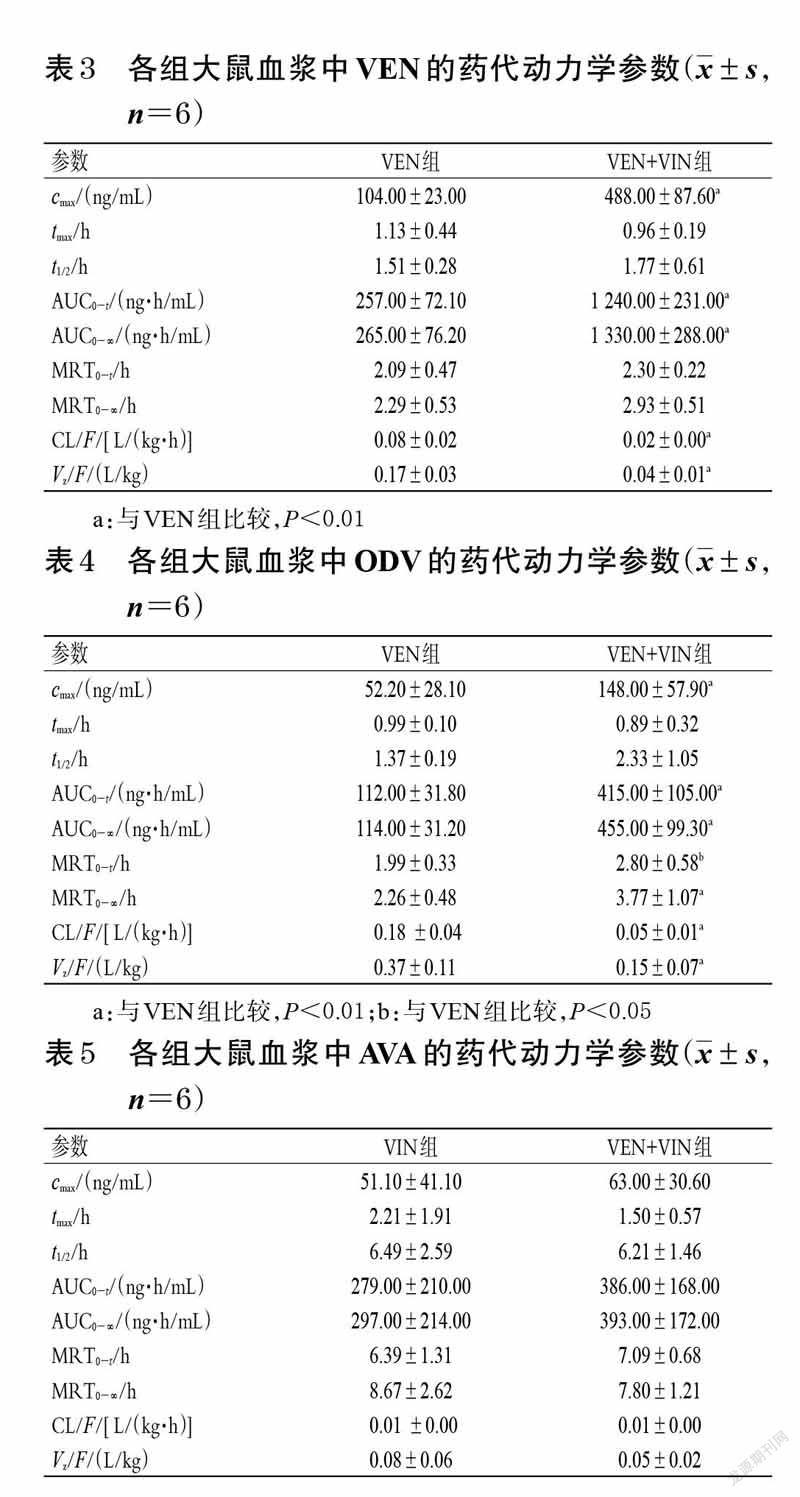
2.7 药代动力学评价将经过方法学验证的分析方法用于本研究后,采用DAS2.0 软件计算药代动力学参数,然后应用SPSS19.0软件对主要药代动力学参数即峰浓度(cmax)、消除半衰期(t1/2)、药时曲线下面积(AUC)、平均驻留时间(MRT)、清除速率(CL/F)、表观分布容积(Vz/F)进行独立样本t 检验分析,达峰时间(tmax)采用非参数秩和检验,检验水准α=0.05。结果见表3~表5。
由表3~表5 可见,与VEN组比较,VEN+VIN 组大鼠血浆中VEN、ODV 的药代动力学参数cmax、AUC0 - t、AUC0-∞、MRT0-(t VEN除外)、MRT0-∞(VEN除外)均显著增大,CL/F、Vz/F 均显著减小(P<0.05 或P<0.01)。与VIN 组比较,VEN+VIN 组大鼠血浆中AVA的各项药代动力学参数差异均无统计学意义(P>0.05)。
3 讨论
早期相关研究采用荧光法分析VEN及其代谢物[18],但存在血浆样品取样量大、灵敏度不足、分析时间长的问题。鉴于生物样品成分的复杂性,本研究建立的LC-MS/MS 法可减少干扰,具有专属、高效、灵敏的特点。为获得良好的峰形和较高的质谱响应,笔者考察了流动相甲醇、乙腈、水的组成比例,并在水相中加入甲酸来提高离子化程度。结果发现,当流动相为甲醇-乙腈-0.5%甲酸溶液(50 ∶45 ∶5,V/V/V)时,VEN、ODV、内标的响应较高、峰形良好,VEN、ODV的保留时间均在1.95 min 内,较文献[19]中的保留时间更短;当流动相为甲醇-乙腈溶液(85 ∶15,V/V)时,AVA的峰形良好、响应较高且保留时间适宜。
前期研究阶段,笔者考察了液液萃取法(萃取剂包括乙酸乙酯、甲基叔丁基醚)和蛋白沉淀法(沉淀剂包括甲醇、乙腈)对VEN、ODV血浆样品预处理的影响。结果发现,以乙酸乙酯萃取时,VEN、ODV的提取回收率较低;以甲醇和乙腈沉淀蛋白时,VEN、ODV的峰形变宽、柱效较低、重现性差,故采用甲基叔丁基醚作为萃取剂。另外,由于VEN、ODV偏碱性,故在样品处理时加入碳酸钠来提高两者的提取回收率。笔者同样也考察了液液萃取法(萃取剂包括乙酸乙酯、甲基叔丁基醚、乙酸乙酯-甲基叔丁基醚混合溶液)和蛋白沉淀法(沉淀剂包括甲醇、乙腈)对AVA血浆样品预处理的影响。结果发现,以甲基叔丁基醚、乙酸乙酯-甲基叔丁基醚混合溶液为萃取剂时,AVA的提取回收率较;以甲醇和乙腈沉淀蛋白时,AVA的峰形变宽、柱效较低、重现性差,故采用乙酸乙酯作为萃取剂。另外,由于AVA偏酸性,故在样品处理时加入盐酸来提高AVA的提取回收率
进一步的药代动力学实验结果显示,与VEN 组比较,VEN + VIN 组中VEN、ODV 的药代动力学参数AUC0-t、AUC0-∞、cmax、MRT0-(t VEN除外)、MRT0-∞(VEN除外)均显著增大,CL/F、Vz/F均显著减小,tmax、t1/2差异无统计学意义,提示VIN对VEN、ODV在大鼠体内的药代动力学行为有影响。与VIN 组比较,VEN+VIN 组中AVA的药代动力学参数cmax、AUC0-t、AUC0-∞、Vz/F、CL/F、tmax、t1/2、MRT0-t、MRT0-∞差异无统计学意义,提示VEN 对VIN 在大鼠体内的药代动力学行为并无明显影响。由此可知,VIN 可增大VEN、ODV的吸收程度,并使两者的消除减慢,但对两者的吸收速度无明显影响。究其原因可能是由于VEN和ODV是经CYP2D6 酶代谢的,而VIN 对CYP2D6 酶有一定的抑制作用,从而减慢VEN、ODV的代谢,造成两者在体内蓄积。由于VIN 的血管扩张作用可改善脑循环,并增强VEN在中枢神经系统的生物利用度[14],基于本研究结果笔者推测,VIN可能会导致VEN的中枢神经浓度过高,进而产生不良反应。因此建议在临床应用过程中,应适当调整VIN 和VEN 联合用药的剂量和给药间隔,并密切关注两者联用期间患者的不良反应,以增加治疗安全性。
综上所述,VEN 和VIN 联用后,VIN 可通过增大VEN、ODV在大鼠体内的吸收程度、减慢两者消除,影响VEN的代谢。
