山东荣成马山里海域大型藻类群落结构时空变化研究
2022-06-22李文涛仲崇凤张沛东
李文涛, 王 欢, 仲崇凤, 张沛东, 康 斌
(中国海洋大学 海水养殖教育部重点实验室, 山东 青岛 266003)
大型藻类在近岸生态系统中有重要的生态功能,一方面可缓解近岸海水富营养化、渔业资源衰退等问题, 另一方面在信息传递、物质循环和能量流动中也起着重要作用[1-2]。大型底栖藻类作为海洋生态系统中的初级生产者, 其提供的初级生产力约占海洋总初级生产力的10%[3-4]。大型藻类在海洋中分布广泛, 不同生态环境中大型藻类的生态效应也有所差异, 例如在枸杞海藻场, 其总初级生产力可达到每年11 604 t/km2[5],而在礁石生境中, 一些钙质底栖藻类如小珊瑚藻等具有固定碳酸盐的功效[6]。基于海洋复杂多样的生态环境,了解不同季节、不同生境中各重要组分的相互作用, 对于评价近岸海域的生态功能具有十分重要的作用。
从19世纪以来, 国外就陆续开展了潮间带、潮下带底栖藻类群落结构研究。Portugal等[7]对巴西的海洋保护区与人口稠密海岸的大型藻类群落结构进行对比分析, 发现人类的影响可能导致城市附近热带生态系统的群落差异和底栖生物多样性的降低。Josselyn等[8]对旧金山湾潮间带大型藻类调查结果显示, 藻类丰度的季节性增加与盐度、温度和底部光照的增加有关。然而, 我国对海洋潮间带和潮下带的大型底栖藻类的研究相对较少。唐衍力等[9]对山东青岛崂山湾3个人工鱼礁区底栖大型藻类群落的季节性差异进行了调查, 聂猛等[10]对山东半岛东端的几个海草床内分布的底栖大型藻类群落进行了分析。
山东荣成马山里海域以岩石底质为主, 其中有少部分区域的岩石底质上有一薄层泥沙沉积。这些海域均有多种大型底栖藻类生长, 其中岩石裸露的海底区域除了有大型底栖藻类生长外, 还有部分区域长有适宜在岩礁区域生长的海洋高等植物虾形草(Phyllospadix iwatensis)。因此, 本文将马山里海域的浅海区域分为3种典型生境, 分别为: 天然礁区(岩礁底质区域)、草床区(岩礁底质中的虾形草草床区)以及泥沙区(岩礁底质上有薄层泥沙沉积的区域(图1)。为研究马山里海域大型藻类群落结构特征及其季节变化, 对这3种生境中的大型藻类种类、数量进行了季节性调查, 并对藻类种类、生物量、生物多样性、优势种等指数及时空变化特征进行调查研究, 探究该海域大型藻类群落随生境及季节的变化, 以期为我国沿岸退化大型海藻场的修复与其生境适宜性研究提供本底资料。

图1 山东荣成马山里海域典型生境Fig. 1 Three typical habitats in the Mashanli coast of Rongcheng, Shandong Province
1 材料与方法
1.1 实验地点
实验地点位于山东半岛东部的荣成马山里海域(图2)。马山里海域位于我国黄海海域边缘, 潮汐为不正规半日混合潮, 年平均潮差约81.1 cm[11]。根据其生境特征及其分布范围设置了9个监测站位(除了泥沙区的3个采样点间距为10~20 m外, 其他各采样点之间的间距为100~300 m), 在天然礁区设置3个站位J1(37°19′37.40″N, 122°35′44.50″E), J2(37°19′32.21″N,122°35′33.64″E)和J3(37°19′28.50″N, 122°35′24.90″E);在泥沙区设置3个站位 S1(37°19′19.21″N,122°35′10.61″E), S2(37°19′19.62″N, 122°35′10.88″E)和S3(37°19′19.65″N, 122°35′10.29″E); 在草床区设置3个站位C1(37°19′35.4″N, 122°35′35.8″E), C2(37°19′25.5″N, 122°35′20.90″E)和 C3(37°19′07.5″N,122°35′09.0″E)。其中泥沙区范围较小, 3个站点距离约为10~20 m, 在图2中显示为一个点。

图2 山东荣成马山里海域采样站位Fig. 2 Sampling sites in Mashanli coast, Rongcheng, Shandong Province
1.2 样品采集与处理
分别于2018年11月(秋季)、2019年2月(冬季)、5月(春季)和8月(夏季)在实验海域草床区、泥沙区、天然礁区3种不同生境中的各个站位随机设置3个(25 cm×25 cm)的样方, 对样方内的所有大型藻类进行采集, 每个站位取3个重复样本。
将采集的藻类样本放入1 mm网眼的网袋中, 经小心冲洗后放入封口袋。样品使用冰鲜处理并带回实验室。在实验室内使用解剖镜对大型藻类进行种类鉴定, 按种类分组装到做好标记的信封袋中放入烘干箱内, 于60 ℃下烘干至恒重, 冷却后称重。
1.3 数据处理与分析
大型藻类群落生物多样性用 Shannon 多样性指数(H′)表示[12]:

式中,S为总物种数,Pi为种类i的生物量占总生物量的比例,Ni为种i的生物量,N为所有种类生物量之和,出现率fi是种i出现的样方数占总样方数的百分比。
使用 PRIMER 6.0对底栖大型藻类群落进行多元统计分析。为了降低大型藻类群落生物量对结果权重赋分的影响, 数据先进行方根转化。通过 Bray-Curtis处理, 对其进行聚类分析(CLUSTER)及非度量多维尺度分析(nMDS)排序。ANOSIM 对群落结构进行差异显著性检验[12-14]。排序(nMDS)坐标轴用应力(Stress)表示, 当应力值<0.2时, 表明矩阵表示了相对真实的结构。
采用Origin 2018、ArcGIS软件制图, 使用SPSS 25.0进行单因素方差分析(one-way ANOVA), 在方差分析结果显著性满足P<0.05时, 使用Tukey事后多重比较校验, 确定组间差异的显著性, 数值表示为平均值±标准误差。
2 结果与分析
2.1 种类组成及分布
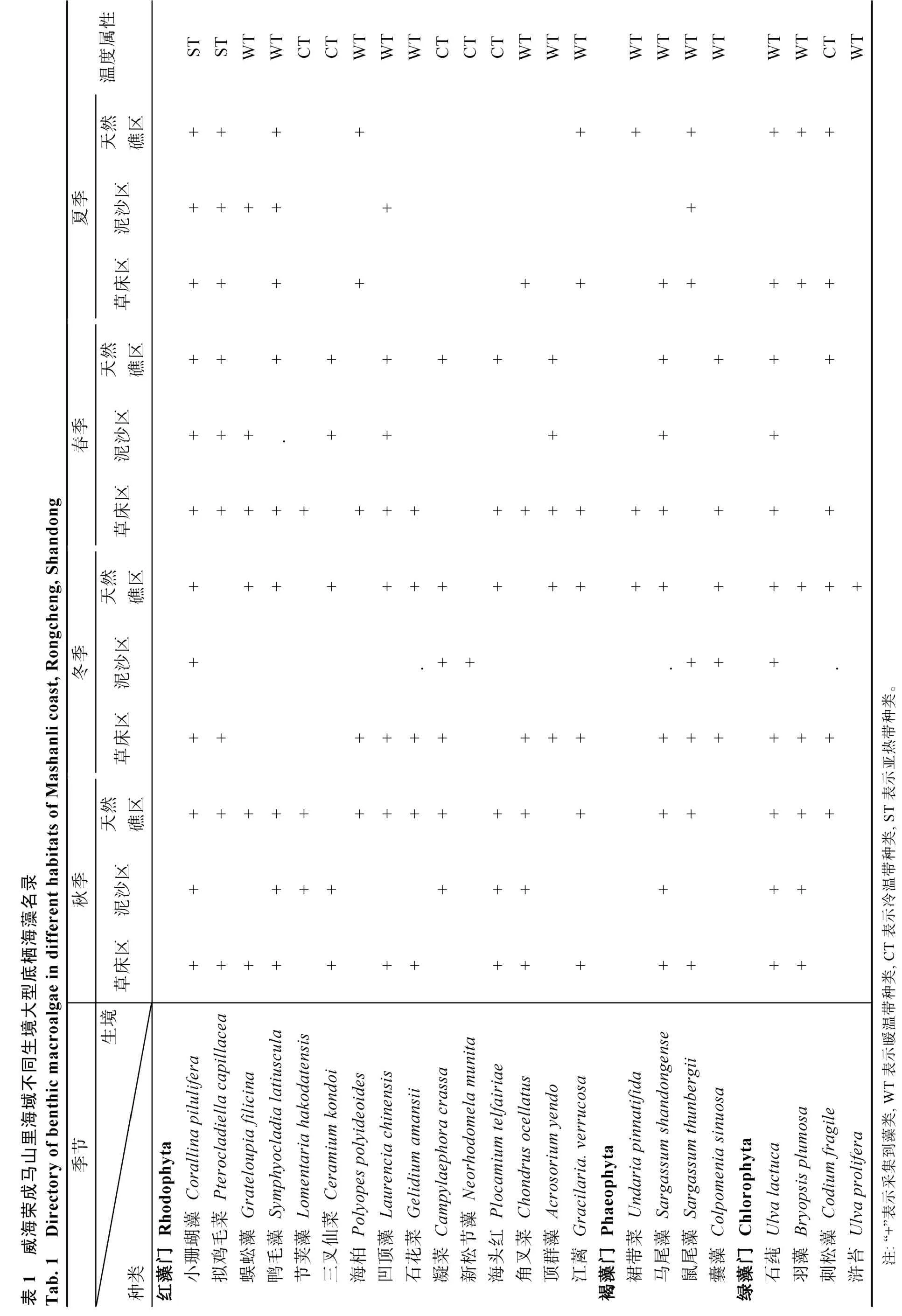
在3种生境的四季采样中共鉴定出大型藻类23种(表1), 隶属于3门21属, 其中红藻门(Rhodophyta)15属15种(占总物种数的65.22%), 褐藻门(Phaeophyta)3属4种(占17.39%), 绿藻门(Chlorophyta) 3属4种(占17.39%)。红藻门藻类是马山里海域大型藻类群落的主要构成成分, 其中包括暖温带、冷温带、亚热带种类。其中暖温带种类数最多, 代表种类为蜈蚣藻(Grateloupia filicina)、鸭毛藻(Symphyocladia latiuscula)、海柏(Polyopes polyideoides)、凹顶藻(Laurencia chinensis)、石花菜(Gelidium amansii)等。其次为冷温带种类, 代表种类为海头红(Plocamium telfairiae)、刺松藻(Codium fragile)等。亚热带种类数最少, 只有2种, 分别为小珊瑚藻(Corallina pilulifera)、拟鸡毛菜(Pterocladiella capillacea)。虽然亚热带种类数少, 但小珊瑚藻是草床与天然礁区2生境中的优势种(表2), 而且小珊瑚藻在2种生境中均存在。此外, 在各自生境中还发现其他生境中没有的种类: 天然礁区发现浒苔, 泥沙区为新松节藻, 草床区为角叉菜等。
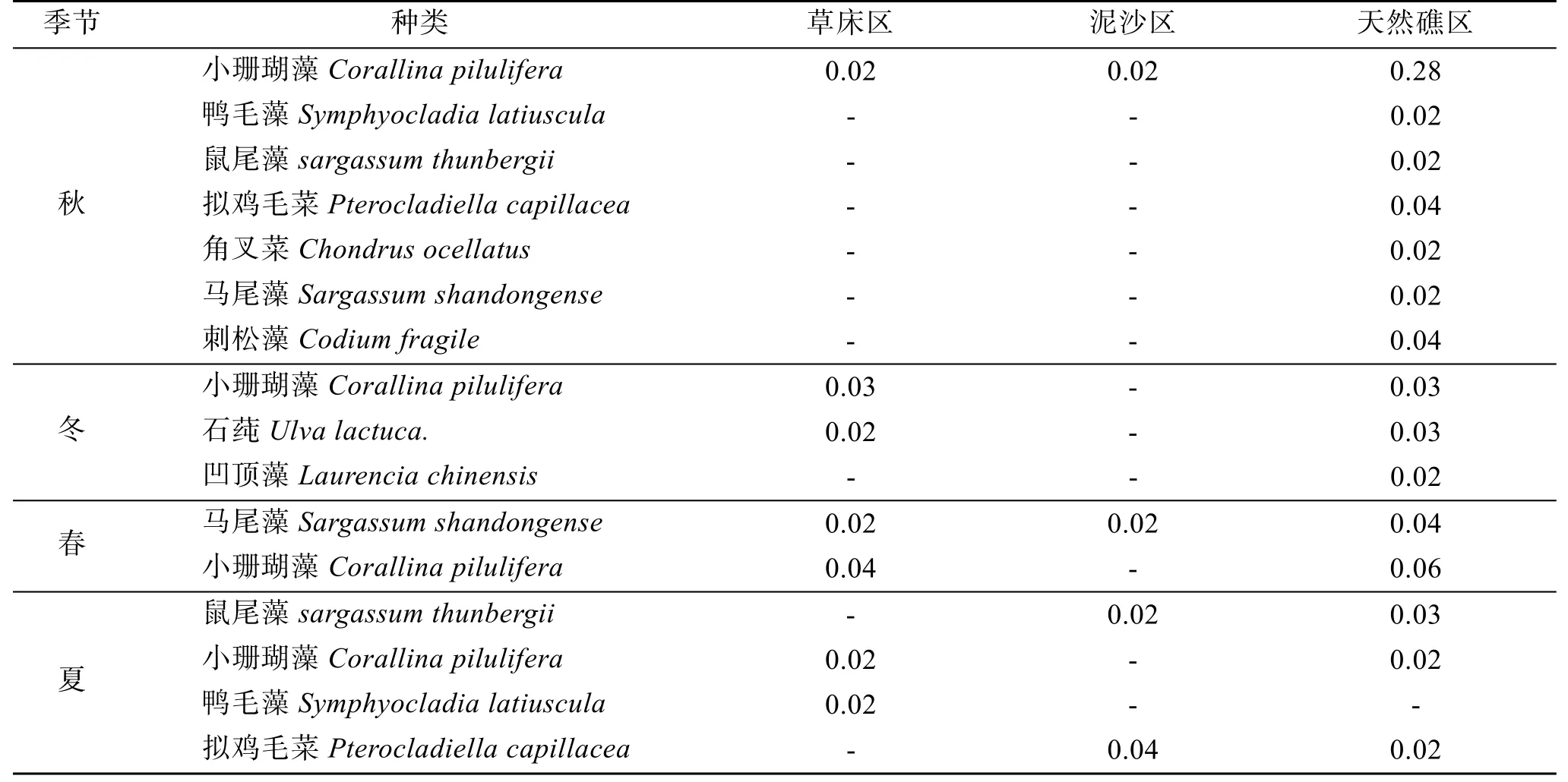
表2 大型藻类优势种的生境分布及优势度Tab. 2 Habitat distribution and dominance of dominant species of benthic macroalgae
各生境之间的底栖大型藻类种类数差异显著(P<0.05)(图3)。3种生境的藻类种数以天然礁区最多,为22种, 泥沙区最少, 为12种。不同季节藻类种数分布有所不同: 草床区在春季种类数最多(17种), 天然礁区在秋季和冬季最多(均为17种), 而泥沙区以秋季最多(10种), 而最低值都出现在夏季, 分别为草床区14种, 天然礁区11种, 泥沙区为4种。在泥沙区,四季中发现的种类都远远低于其他2种生境, 四季发现的种类总数为10种。
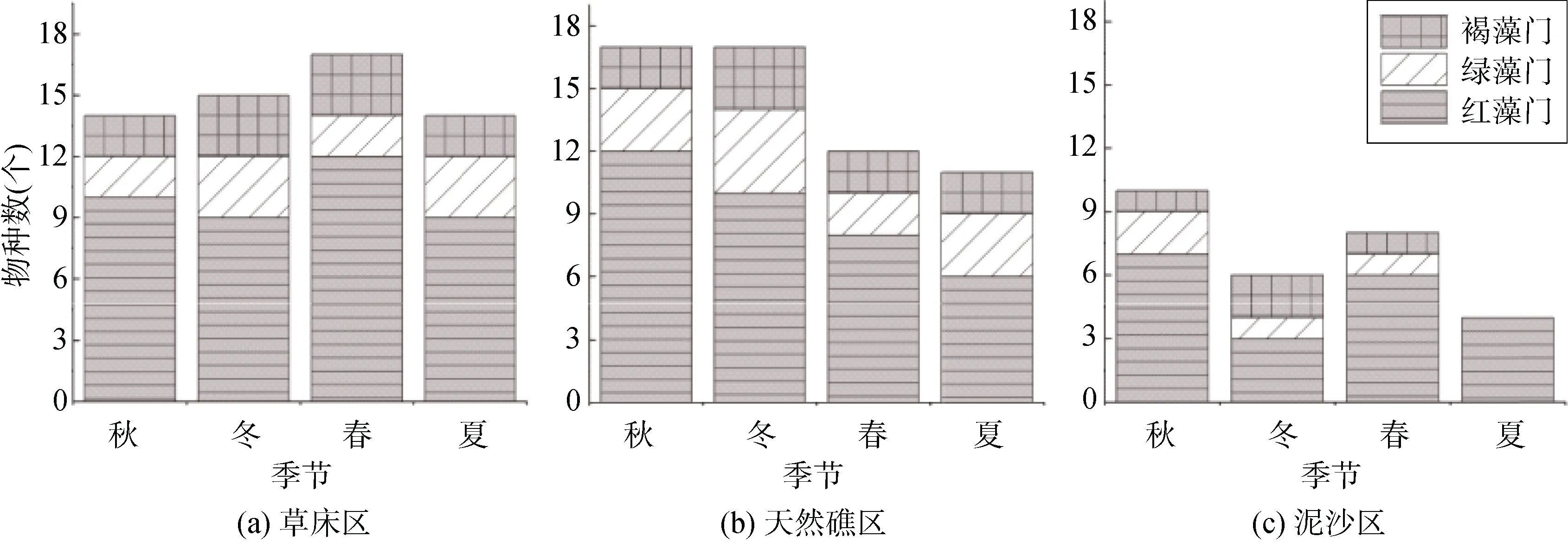
图3 大型藻类不同生境的季节分布Fig. 3 Seasonal distribution of benthic macroalgae in different habitats
?
大型藻类种类数随季节变化亦显著(P<0.05)(图3)。除夏季泥沙区有5个红藻门种类和1个褐藻门种类外, 其他2个生境中各门类大型海藻在四季中都有发现; 红藻门在四季中均占据绝对优势, 其中草床春季和天然礁区秋季最多(12种); 褐藻门种类数在天然礁区冬季最多(3种), 其中代表种类为马尾藻, 在四个季节均有发现。绿藻门种类数在草床区与天然礁区中的春季种类数最少(均为2种)。
2.2 生物量
大型藻类的生物量在各个生境间差异显著(P<0.05)(图4), 其四季平均生物量大小依次为: 草床区>天然礁区>泥沙区, 草床区的平均生物量高达(1 183.97±254.03) g·m–2,天然礁区平均生物量为(1 085.12±244.79) g·m–2, 而泥沙区的生物量最低, 仅为(709.55±270.77) g·m–2。
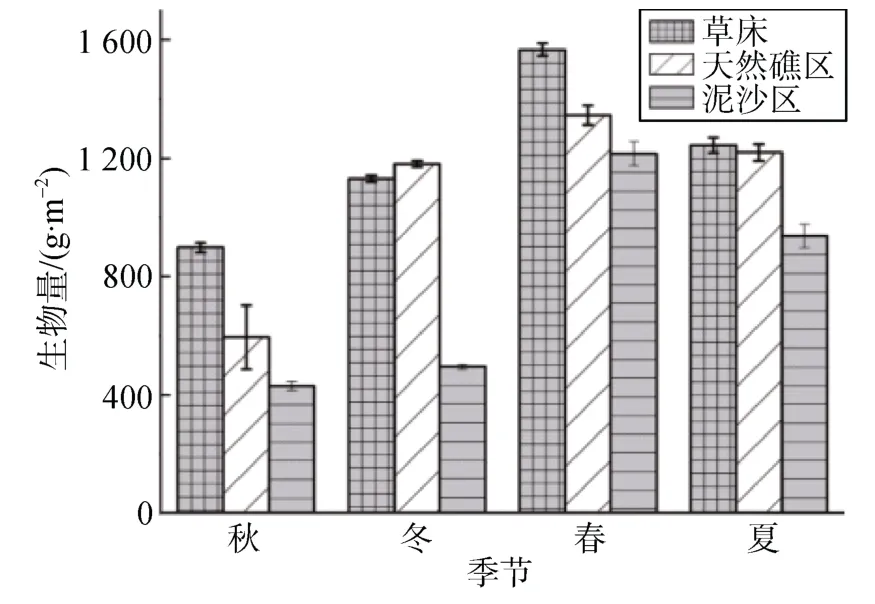
图4 大型藻类生物量的季节分布Fig. 4 Seasonal distribution of benthic macroalgal biomass
大型藻类的生物量在不同季节差异亦显著(P<0.05),其中春季平均生物量(1 455.88±128.53) g·m–2, 而秋、冬季分别为(621.55±148.15)和(794.20±149.89) g·m–2。3生境中生物量变化趋势一致, 总体呈现先上升后下降的趋势, 均在春季达到生物量最高值, 草床为(1 567.44±21.29) g·m–2、天然礁区为(1 215.55±40.07) g·m–2、泥沙区为(1 345.55±30.43)g·m–2。秋、冬季生物量相对其他两季较低, 最低值出现在秋季, 草床区、天然礁区、泥沙区生物量值分别为(897.97±17.20) g·m–2、(430.03±15.09) g·m–2、(594.45±107.06) g·m–2。
2.3 优势种的组成
优势种数随生境变化明显: 天然礁区>草床区>泥沙区(表2)。草床区的优势种主要由红藻门、褐藻门组成, 泥沙区主要由红藻门组成, 而天然礁区主要由绿藻门、褐藻门组成(表2)。不同生境中主要优势种类不同, 草床区的主要优势种为小珊瑚藻、马尾藻、鸭毛藻, 泥沙区的优势种为拟鸡毛菜、小珊瑚藻、马尾藻、鼠尾藻, 天然礁区的优势种则由小珊瑚藻、刺松藻、马尾藻、鸭毛藻、鼠尾藻、拟鸡毛菜、角叉菜、石莼、凹顶藻等组成。
各生境优势种也有着明显的季节变化。在秋季,草床区、泥沙区优势种比较单一, 只有小珊瑚藻1种,天然礁区优势种相对较丰富, 其中拟鸡毛菜、刺松藻占据绝对优势; 冬季, 草床区优势种仍为小珊瑚藻,泥沙区无优势种, 天然礁区优势种类数比秋季大大减少, 优势种类由秋季的7种变化为冬季的小珊瑚藻、石莼和凹顶藻3种; 春季, 草床的绝对优势种仍为小珊瑚藻, 泥沙生境重新出现优势藻类马尾藻,天然礁区优势种类由小珊瑚藻、马尾藻占据; 夏季,草床区中的小珊瑚藻仍处于优势地位, 泥沙区优势种变为拟鸡毛菜和鼠尾藻, 而天然礁区由小珊瑚藻变化为鼠尾藻占据第一优势地位(表2)。
2.4 生物多样性
Pielou 物种均匀度指数(J)在生境间差异不显著, 平均值最高为草床(0.95±0.02), 最低值为泥沙生境(0.92±0.03)(图5)。该指数呈现极显著的季节差异(P<0.01), 平均值最高为冬季(0.99±0.00), 最低值为秋季(0.88±0.02);各生境中最高值出现在冬季3生境中(均为0.99), 最低值为秋季泥沙区(0.91)。各生境随季节变化趋势一致,总体呈现由秋季到冬季上升, 春季后略微下降。
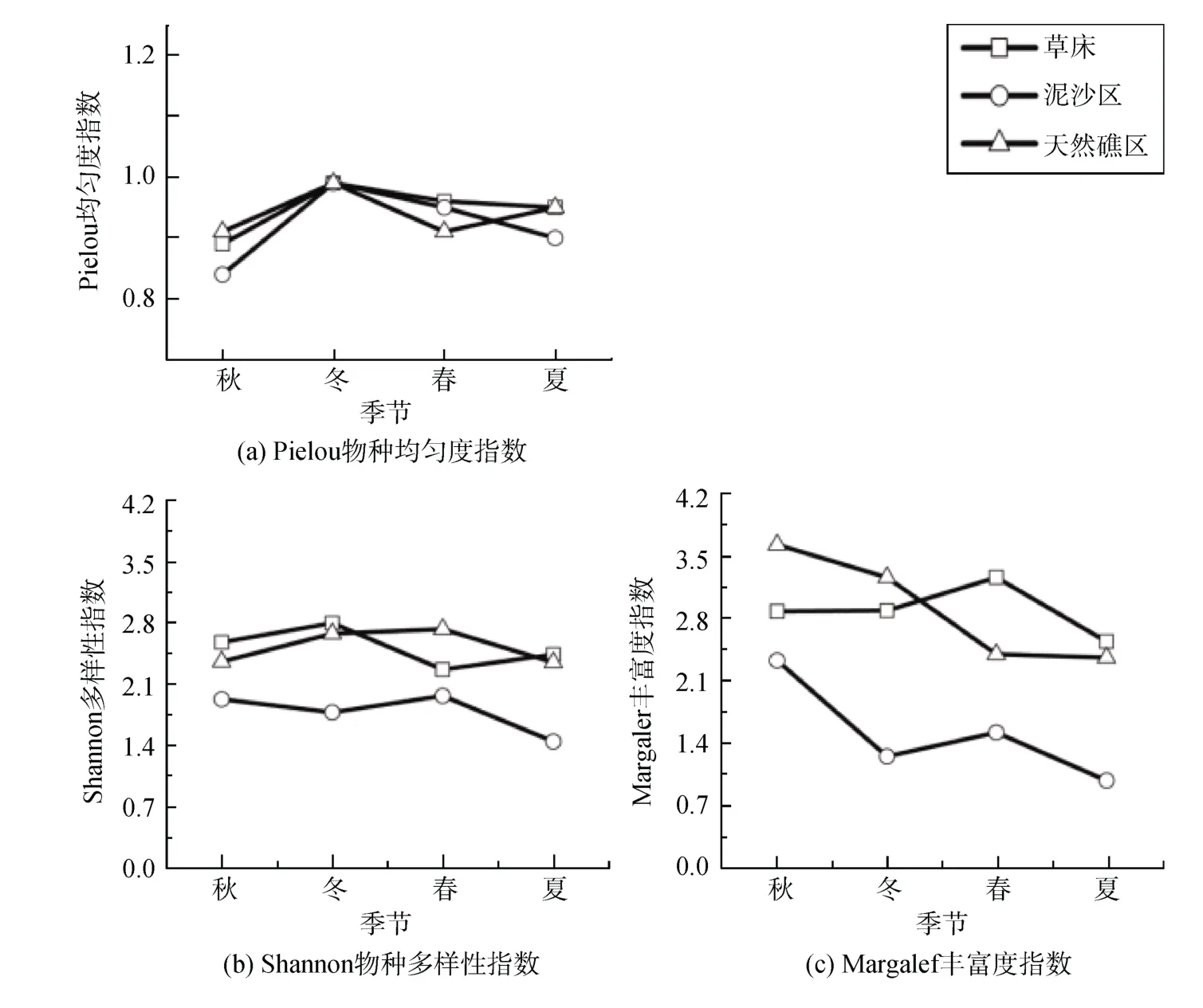
图5 大型藻类群落物种多样性指数季节变化Fig. 5 Seasonal variation of biodiversity index of benthic macroalgae
Shannon 物种多样性指数(H')随生境变化极显著(P<0.01)(图5), 3种生境中其平均值以天然礁区多样性最高(2.50±0.09), 泥沙区最低(1.78±0.12)。该多样性指数在季节间变化显著(P<0.05), 平均值冬季最高(2.42±0.09), 夏季最低(2.08±0.04), 其中最高值出现在春季天然礁区(2.73)。其在不同生境中随季节性变化规律不同: 在草床区呈现从秋季到冬季升高,冬季到春季下降, 春季到夏季又升高的趋势, 在泥沙区为先降低后升高再降低的趋势, 而在天然礁区呈现为先升高后下降趋势。
Margalef丰富度指数(D)在生境间呈极显著性差异(P<0.01)(图5), 与物种多样性相近, 平均值最高为天然礁区(2.91±0.15), 最低值为泥沙区(1.52±0.10)。Margalef丰富度指数在季节间差异显著(P<0.05), 平均值最高为秋季(2.94±0.07), 最低值为夏季(1.96±0.09); 该指数最高值出现在秋季天然礁区(3.63), 最低值为夏季泥沙区(0.98)。各生境随季节性变化趋势不同, 在草床区表现为秋季到春季升高, 春季到夏季又降低的趋势, 在泥沙区表现为先降低后升高再降低的趋势, 而在天然礁区则表现为一直下降的趋势。
2.5 群落结构特征
Cluster聚类结果分析如图6a所示: 在相似性40%的水平上, 3种生境(四季)的所有大型藻类聚为3支, 其中秋季聚类结果显示, 3种生境各自聚为一支, 其中J1、J2、J3 三个礁区相似度最高(58.9%); 其次为泥沙区相似度为(57.6%), 最后为草床区相似度为(52.5%); 冬季聚类结果显示, 泥沙区单独聚为一支, 其相似度为(51.2%),而草床区与天然礁区聚为一组; 春季草床区站位聚为一类, 相似度较高为(62.5%), 大部分泥沙区与天然礁区生境聚为一组; 而到了夏季, 草床区、泥沙区、天然礁区3种生境组又各自聚为一组, 相似度分别为(22.8%、77.1%、57.2%), 以泥沙生境相相似度最高(77.1%)。
非度量多维尺度分析(nMDS)结果显示: 其二维排序图的应力值均≤0.2(图6b), 对不同季节不同生境之间的底栖大型藻类群落结构的相似性具有较好的解释意义。按聚类结果可知: 在秋季, 3种生境的各个站位都自聚为一类, 其中泥沙区的聚类效果最好; 而在其他季节, 3种生境的聚类相互重叠, 聚类的分支中多生境点聚在一起, 表现的聚类效果为站位较近的生境聚为一组, 相似度较高, 排序结果与聚类分析结果一致。
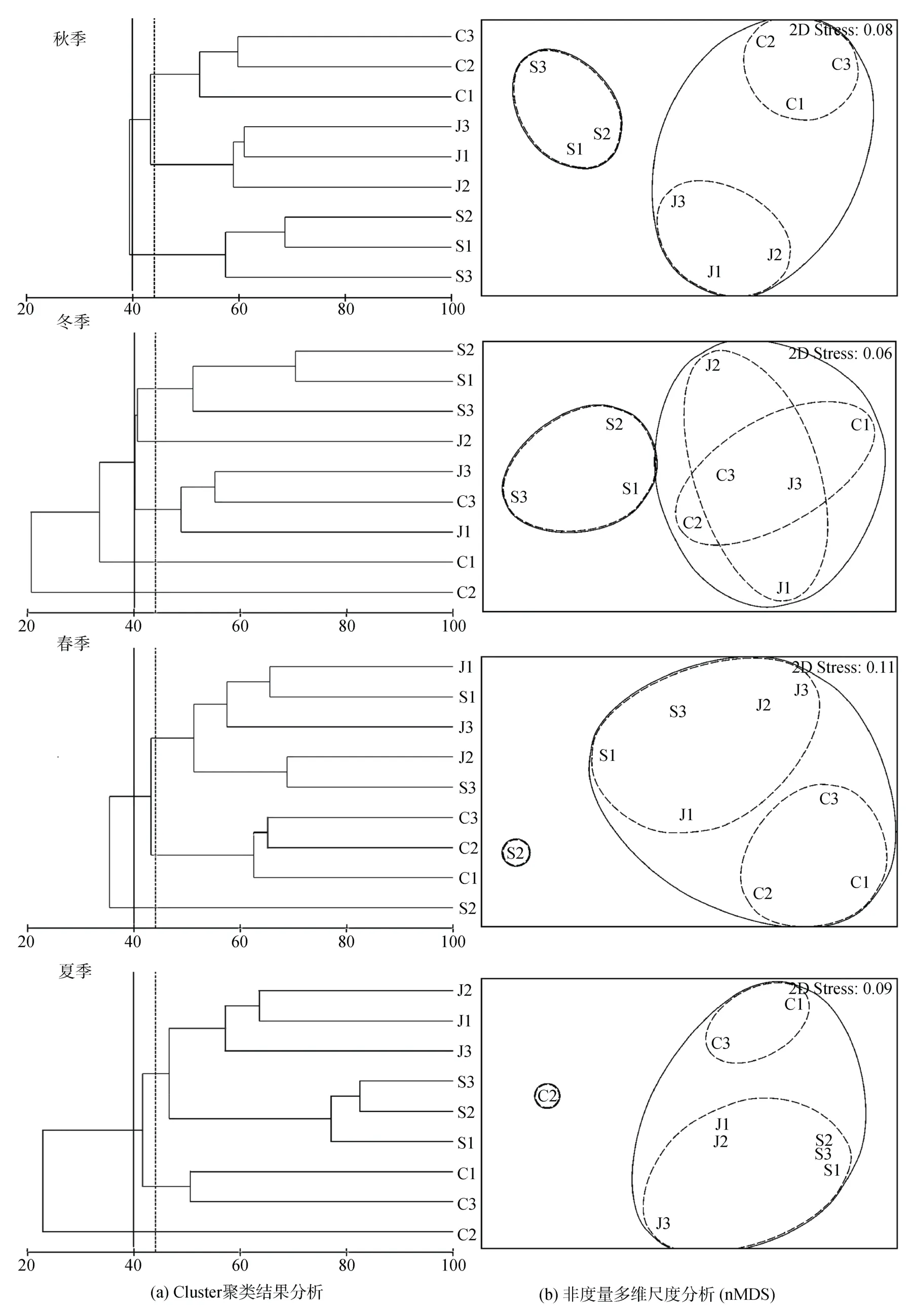
图6 大型藻类的聚类及 nMDS 分析Fig. 6 Cluster analysis and nonmetric multidimensional scale analysis (nMDS) on benthic macroalgae
ANOSIM分析表明, 3个生境中大型藻类群落结构在秋(P=0.001)、冬(P=0.002)、春(P=0.010)、夏(P=0.001)四季3生境间均有显著差异(表3)。秋季,R值在0.25~0.80之间, 表明3种生境中大型藻类群落两两之间有分离也有重叠, 3生境两两对比都存在显著差异; 冬季草床区与天然礁区基本不分离(R=0.26,P=0.02), 泥沙区与草床区、泥沙区与天然礁区群落基本分离(R=0.78,P=0.01;R=0.80,P=0.03); 春季草床与天然礁区基本不分离(R=0.26,P=0.02), 泥沙区与草床区、泥沙区与天然礁区群落基本分离(R=0.69,P=0.04;R=0.74,P=0.01), 各对比组间均存在显著差异; 夏季草床区与天然礁区稍有分离, 存在显著差异(R=0.35,P=0.01), 草床区与泥沙区分离(R=0.63,P=0.01), 泥沙区与天然礁区之间分离, 差异显著(R=0.67,P=0.05)。
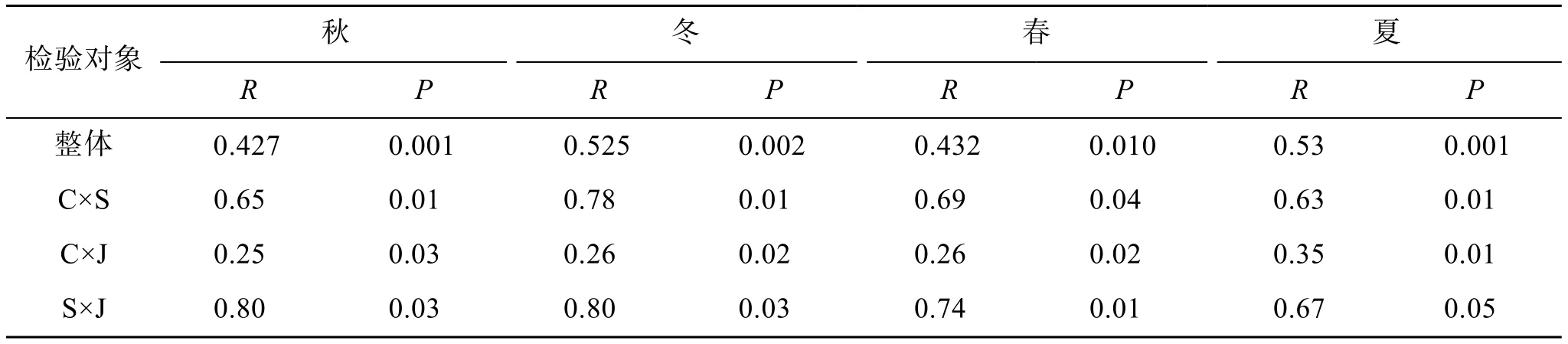
表3 以生物量为矩阵变量的大型藻类群落ANOSIM分析Tab. 3 ANOSIM test of the difference between benthic macroalgal communities with biomass as the matrix variable
3 讨论
3.1 种类与生物量
在本次调查中, 共发现大型藻类23种, 其中红藻门15属15种, 褐藻门3属4种, 绿藻门3属4种。大型藻类数量多于同为山东半岛东端的荣成月湖的13属16种, 表明该海域潮下带的藻类群落结构比较丰富[16]。总体上来看, 在该海域不同生境中, 红藻门的种类数占据绝对优势, 该结果与唐伟尧[17]的威海西港大型藻类群落结构、彭欣等[18]的浙南潮间带底栖大型藻类群落、庄树宏等[19]的烟台月亮湾沿岸大型藻类群落结构的调查研究相似。本次调查结果显示, 马山里海域藻类种类主要以暖温带种为主, 共鉴定出15种, 其次为冷温带种, 共鉴定种类为6种,最少的是亚热带种类2种, 其大型海藻区系分布情况与我国黄渤海区温度性质相一致[20-21]。
在不同生境条件下, 我们发现藻类的种类数的大小规律为天然礁区>草床>泥沙生境, 而生物量的规律为: 草床>天然礁区>泥沙区。曾宴平等[22]和张云岭等[23]研究发现不同地理环境也会造成藻类群落的差异,其原因可能为在天然礁区环境中, 大型藻类在礁石上附着能力较强, 而一些喜附着于藻体表面生长的藻类也得到了藻体附着基, 因此礁石生境藻类种类较多,但是礁石地貌结构相对简单, 藻类附着表面积与草床区相比较小, 不同种类间还存在一定的相互附着竞争关系, 所以礁石区相较于草床区, 种类数量多但是生物量低。而在泥沙生境中, 海底相对平坦, 结构简单,受海浪冲击较大, 藻类种类最少, 生物量也最低。除此之外, Bukaveckas等[24]和Danielsson等[25]的研究显示,营养盐等环境因子也可能是影响不同生境藻类的季节生长变化的重要原因。
3.2 优势种、多样性指数
3.3 群落结构与多样性格局
不同生境中大型藻类群落结构的优势种类不同,如草床区四季均以小珊瑚藻为主要优势种, 而天然礁区除了小珊瑚藻在四季均为优势种外, 其他优势种包括在马尾藻、拟鸡毛菜等种类。这种不同生境中优势种类的差异与刘国山[26]的威海双岛礁区大型藻类群落变化、盛化香[27]的崂山湾大型藻类群落结构季节性研究的结果一致。泥沙区优势种变化较大,例如冬季无优势种, 拟鸡毛菜是夏季主要优势种,马尾藻是春季优势种。在不同季节变化中, 例如在草床区, 四季度优势种类小珊瑚藻一直占据绝对优势,可能是因为草床区的海藻尤其是小珊瑚藻在基底形成一层密集的珊瑚藻植被, 周边被海草包围[28], 生境内的大型藻类不易受到海风[29-30]、海流冲击而流失, 并且海头红, 拟鸡毛菜等相对个体较小的藻类喜附着其上生长, 因此草床区的小珊瑚藻相较于礁区、泥沙区, 其群落结构更加稳定[31-32]。礁区藻类群落变化呈现一定的季节规律性, 优势种随季节变化明显[33], 并且在四季的优势种变化中, 呈现季度连续性的优势种变化现象[34-35]。由此可见, 优势种随季节的变化标志着海藻种类功能地位的变化, 同时也反映出海藻群落对变化的环境的一种适应策略[20]。
不同生境、不同季节间底栖大型藻类物种多样性指数(H')、丰富度指数(D)都存在较大差异。其中多样性指数、丰富度指数平均值在天然礁区要高于草床区、明显高于泥沙区。其原因可能为生境差异导致: 不同底质条件提供不同的附着基质, 另外相同地表面积条件下, 礁石区附着生物种类要高于草床区。而泥沙区, 周边环境较为简单, 无遮挡物抵挡海水的冲击拍打, 附着基底为泥沙, 大型藻类不易附着生存, 因此在四季中多样性变化较大, 种类数较少。
3种生境中四个季节的大型藻类群落结构差异显著, 不同季节和不同生境间差异都显著。杨震等[36]研究结果也发现, 不论生境如何, 海藻群落结构季节变化是显著的, 该结果与本实验结果一致。同时本实验还得出, 在同一海域不同生境中, 藻类群落结构也呈现显著性差异。草床区与天然礁区的相异性原因可能为礁石区受海风、海水冲击较大, 如由于该海域面向东南方向, 易受夏季盛行的南风的影响, 更适合个体粗大且喜风浪的褐藻(刺松藻、鼠尾藻)生长, 但是由于底质中礁石块的不稳定性, 受风浪的影响, 礁上海藻流失的可能性增大, 所以在夏季时, 礁石上形成了耐强风抗海浪的小珊瑚藻、拟鸡毛菜等小型藻类群落。另外周岩岩等[37]学者研究结果显示, 一些浮游食藻类动物能够破坏海藻群落,也可能是导致草床区与天然礁区相异性高的原因之一。
本研究中的泥沙区是岩石海底上沉积了一薄层泥沙, 该泥沙对岩石的覆盖妨碍了一些大型藻类的附着, 因此泥沙区的大型藻类种类比较单一, 种类数少, 群落结构简单。泥沙区藻类群落结构与其他生境群落结构在生物量ANOSIM显著性检验结果显示,群落结构间基本分离甚至完全分离。该研究结果表明: 同一海域的生境差异与季节变化都影响藻类群落结构动态变化。
本研究表明, 马山里海域底栖大型藻类种类丰富, 且有较高的单位面积生物量; 其群落结构与所处生境、季节变化都有密切关系。该海域不同生境之间底质类型的差异, 导致不同生境内底栖大型藻类的生物量和优势种呈现明显差异, 且其群落结构呈现不同的季节变化规律, 而小珊瑚藻是3种生境中一年四季均有发现的大型海藻物种。
4 结论
本次研究在马山里海域的天然礁区、草床区和泥沙区3种生境中共鉴定出大型藻类23种, 包括红藻门15属15种, 褐藻门3属4种, 绿藻门3属4种。天然礁区物种数最多共22种, 泥沙区最少共12种。春季草床区生物量最高, 达到(1 567.44±21.29) g·m–2,秋季的泥沙区最低是(594.45±107.06) g·m–2。优势种在不同生境、不同季节不同: 草床生境中的小珊瑚藻(Corallina pilulifera)在4个季节中均占绝对优势; 礁区为绿藻向红藻、褐藻变化; 泥沙区为从红藻到褐藻变化。群落物种多样性指数在不同生境不同季节间均有所差异。聚类与排序结果显示, 大型藻类群落结构在不同生境间、不同季节间差异均有显著差异。研究结果表明, 生境特征和季节性变化是影响大型海藻群落结构的主要因素。
