Na2SO4-(NH4)2SO4-H2O三元体系相图及其应用
2022-06-22毕晓旭宋继田苏杭石冬琦
毕晓旭 ,宋继田,2,苏杭,石冬琦
(1.天津科技大学 机械工程学院 天津市轻工与食品工程机械装备集成设计与在线监控重点实验室,天津 300222;2.低碳绿色过程装备国际联合研究中心,天津 300222)
硫酸钠和硫酸铵的混合废水存在于多种工业过程中[1-4],通常此类工业废水的处理方式是将其蒸干,产生的杂盐堆场堆放或者焚烧,造成环境二次污染[5]。
分质结晶是从混合溶液中分离和提取单质盐的有效方法[6-7],通过相图可以分析盐类溶解或析出的先后顺序和溶液组成的变化规律,因此,(NH4)2SO4和Na2SO4的溶解度数据是必不可少的[8-11]。有部分文献报道了(NH4)2SO4和Na2SO4体系的多元水盐溶解度数据[12-16],但应用于单质盐的实际结晶过程需要提供更高温度下的溶解度数据,所以本文研究了三元体系Na2SO4-(NH4)2SO4-H2O在353.15 K的相平衡,并以此为基础,以沉钒废水为例,研究单质盐的结晶分离。
1 实验部分
1.1 试剂与仪器
无水硫酸钠、硫酸铵、甲醛溶液、氯化钡、酚酞指示剂、甲基红指示剂、氢氧化钠、硫酸氧化钒、铬酸钠均为分析纯;去离子水,自制(常温pH≈6.6,电导率<1×10-5S/m);模拟废液组分见表1。

表1 废水离子含量指标Table 1 Simulated wastewater composition and mass fraction
AX224ZH/E分析天平;HXC-500-8A多点磁力搅拌低温恒温槽;EL-3KJ电子天平;MNZF-100真空远红外干燥箱;XRD-6100X射线衍射仪;ICS-1100高效离子色谱仪;BHS-1电热数显恒温水浴;SF212-1夹套玻璃反应釜。
1.2 实验方法
1.2.1 相平衡实验 使用等温溶解平衡法测定固液相平衡数据[17-19]。把一系列不同质量比例的硫酸钠、硫酸铵和去离子水加入平衡瓶中,将平衡瓶密封之后置于多点磁力搅拌恒温槽(353.15±0.1) K中,以350 r/min的转速连续搅拌,大约60 h后系统达到固液相平衡后停止搅拌,自然静置6 h。待悬浮料液澄清后,使用预热的取液管取少量上层清液,称重后定容于容量瓶中,然后使用预热后的药匙迅速从平衡瓶中取少量湿固相,称重后定容容量瓶中,分别测定液相和湿固相的离子组成。过滤平衡瓶中的剩余料液,固体干燥后研磨,通过X射线粉末衍射结合湿固相法鉴定固相。
1.2.2 结晶分离实验 结晶分离装置图见图1。由搅拌、控温、蒸发、抽滤4个系统组成。
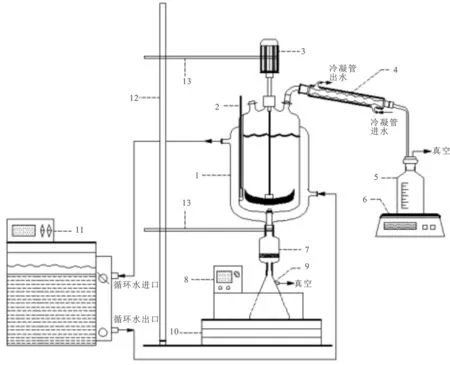
图1 结晶实验装置流程图Fig.1 Experimental apparatus for crystallization 1.夹套玻璃结晶釜;2.温度计;3.机械搅拌;4.冷凝管;5.收集瓶;6.电子天平;7.砂芯漏斗;8.恒温水浴;9.抽滤瓶;10.升降台;11.高温循环器;12.铁架台;13.支架
搅拌系统:使用电机带动搅拌桨在结晶釜内搅拌,搅拌桨为双叶锚式搅拌桨(聚四氟乙烯材质)。
控温系统:高温循环器以水为介质,提供热量或冷量,通过夹套与结晶反应釜中的料液传热以提供结晶推动力,控温精度±0.1 K。
蒸发系统:结晶釜连接循环水真空泵抽真空,等温蒸发结晶时通过调节循环水真空泵的开度,控制蒸发系统的蒸发和结晶速率,二次蒸汽被冷凝后储存于收集瓶中,收集瓶放置于电子天平上,电子天平实时称量收集瓶中冷凝水重量。
抽滤系统:蒸发或冷却结晶结束后的固液混合物于抽滤系统中过滤,结晶物被截留在砂芯漏斗中,母液储存于抽滤瓶中,抽滤瓶放置在恒温水浴中保温,并将水浴温度与结晶温度一致(±0.1 K)。
1.3 离子分析方法
2 结果与讨论
2.1 353.15 K条件下Na2SO4-(NH4)2SO4-H2O三
元体系的溶解度数据及相图
表2为353.15 K时Na2SO4-(NH4)2SO4-H2O三元体系的溶解度数据。由表2中的数据绘制的353.15 K时的Na2SO4-(NH4)2SO4-H2O三元体系相图见图2。
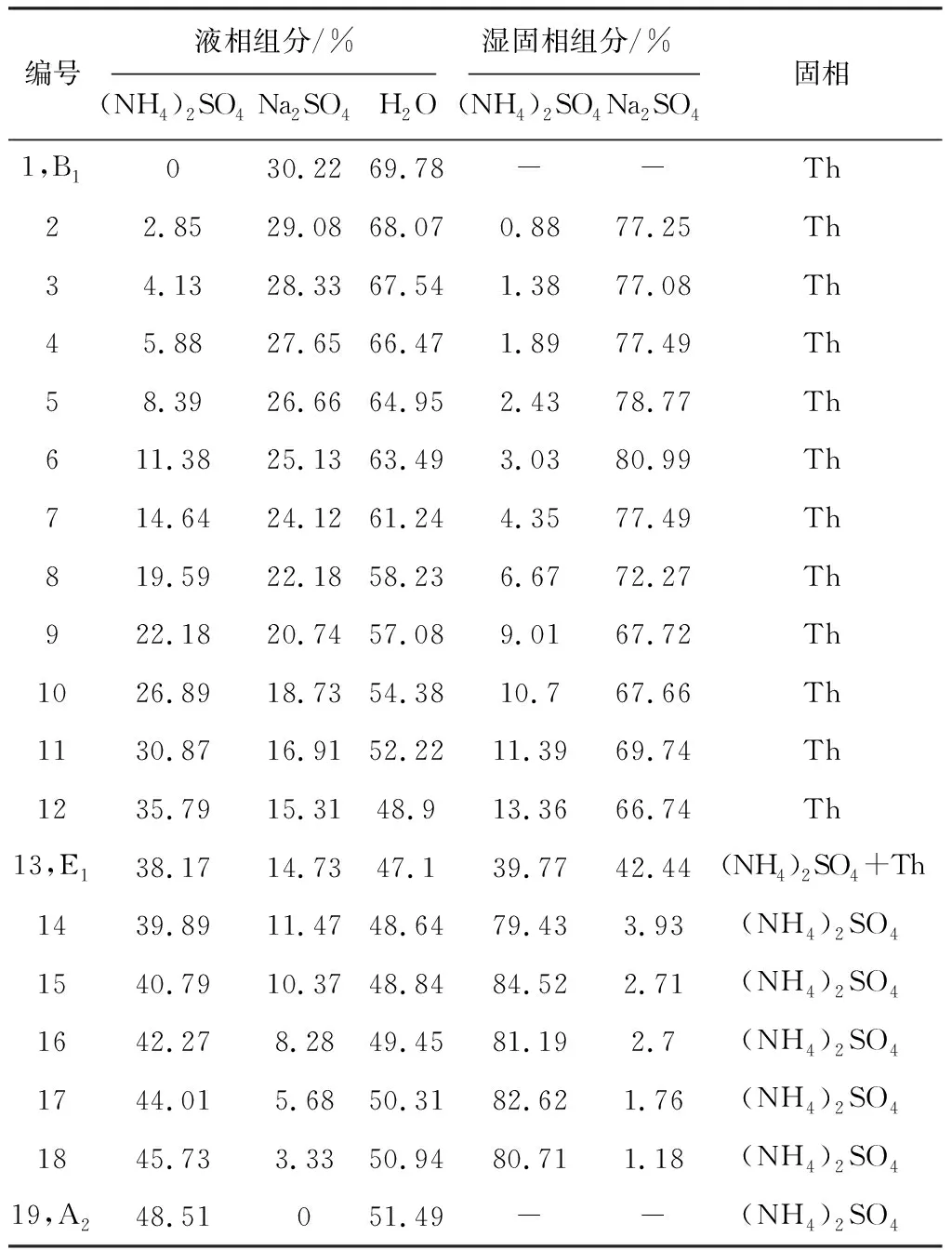
表2 353.15 K(NH4)2SO4-Na2SO4-H2O 三元体系溶解度数据Table 2 Solubility data of (NH4)2SO4-Na2SO4-H2O ternary system at 353.15 K
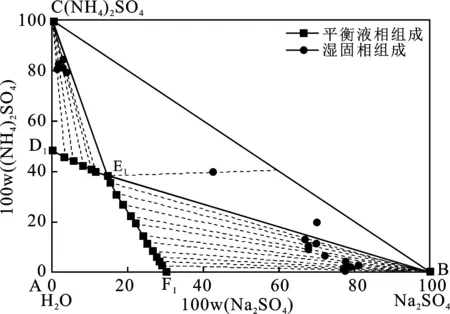
图2 353.15 K (NH4)2SO4-Na2SO4-H2O 三元体系相图Fig.2 Equilibrium phase diagram of the ternary system
由表2和图2可知,353.15 K条件下,三元体系Na2SO4-(NH4)2SO4-H2O为简单共饱和型,有一个共饱点,其组成为:W(Na2SO4)=14.73%、W((NH4)2SO4)=38.17%、W(H2O)=47.10%,图2中点A、B、C分别代表H2O、Na2SO4、(NH4)2SO4,两条单变量曲线F1E1和D1E1分别对应单盐Na2SO4和(NH4)2SO4在353.15 K下的溶解度曲线。相图分为4个区域,A D1E1F1为不饱和区,BF1E1为Na2SO4单质结晶区,CD1E1为(NH4)2SO4单质结晶区,CE1B为Na2SO4和(NH4)2SO4的共结晶区,353.15 K Na2SO4的单质结晶区明显大于(NH4)2SO4的单质结晶区面积。
对353.15 K相图中共饱点E1的固相进行XRD测定,结果见图3。
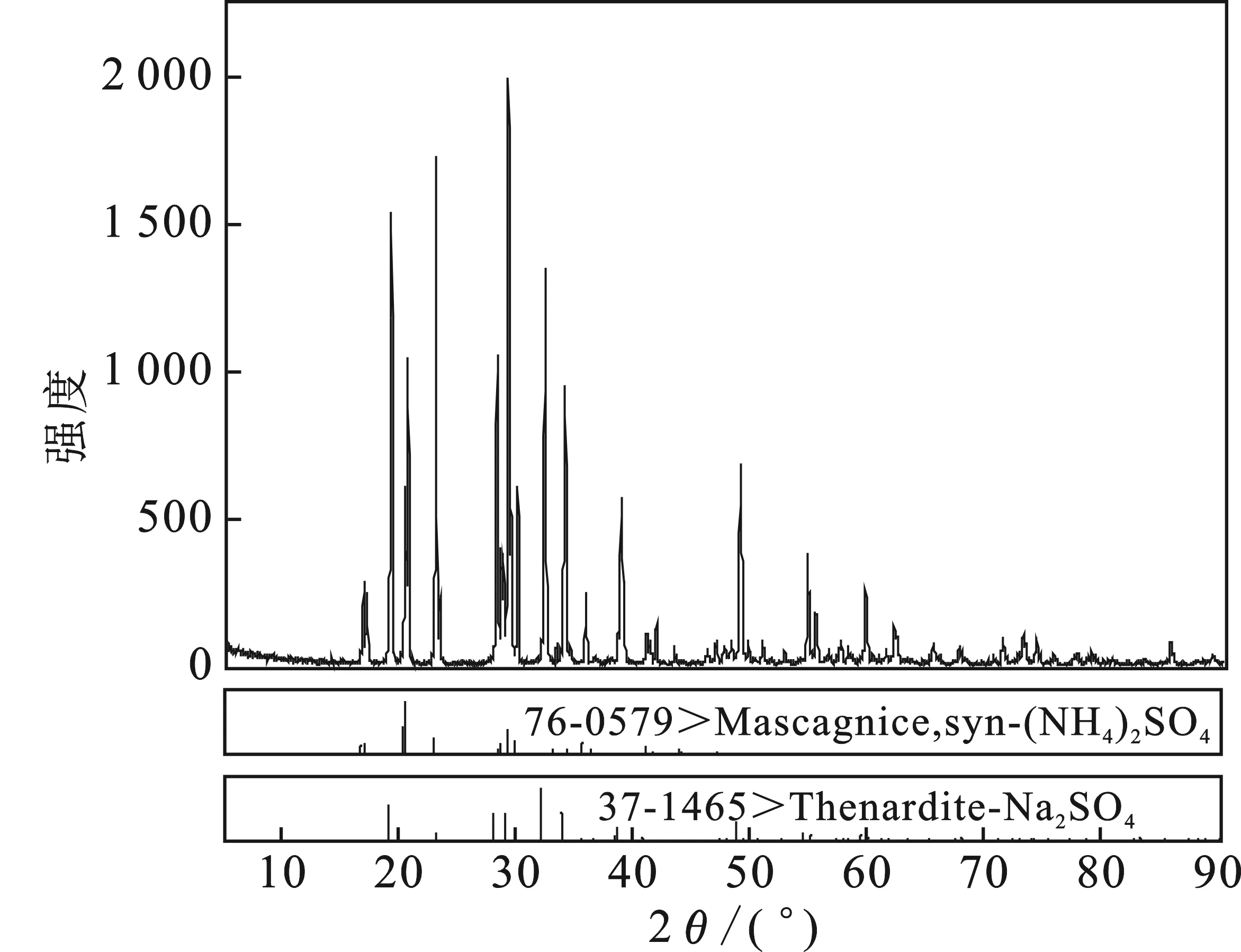
图3 共饱点E1 XRD图谱Fig.3 X-ray diffraction pattern of the eutectic point E1
由图3可知,当Na2SO4-(NH4)2SO4-H2O体系达到共饱和时,平衡固相为Na2SO4和(NH4)2SO4的混合盐,证明353.15 K该体系无固溶体和其他复盐形成。
2.2 相图分析
353.15 K体系相图和333.15 K体系相图共饱点组成分别为W(Na2SO4)=14.73%,W((NH4)2SO4)=38.17%、W(Na2SO4)=16.17%,W((NH4)2SO4)=36.54%,353.15 K条件下硫酸钠结晶区略大,硫酸铵结晶区则较小。基于此,硫酸钠和硫酸铵分别在353.15,333.15 K分离可获得最大收率。沉钒废液理论结晶分离过程见图4中(a)、(b)、(c)三个阶段。(a)353.15 K等温蒸发结晶分离Na2SO4单质盐;(b)288.15 K冷却结晶分离复盐NaNH4SO4·2H2O;(c)333.15 K等温蒸发结晶分离(NH4)2SO4单质盐。每个阶段分离过程见表3,表4中(a)、(b)、(c)三个分离阶段与图4(a)、(b)、(c)相对应。
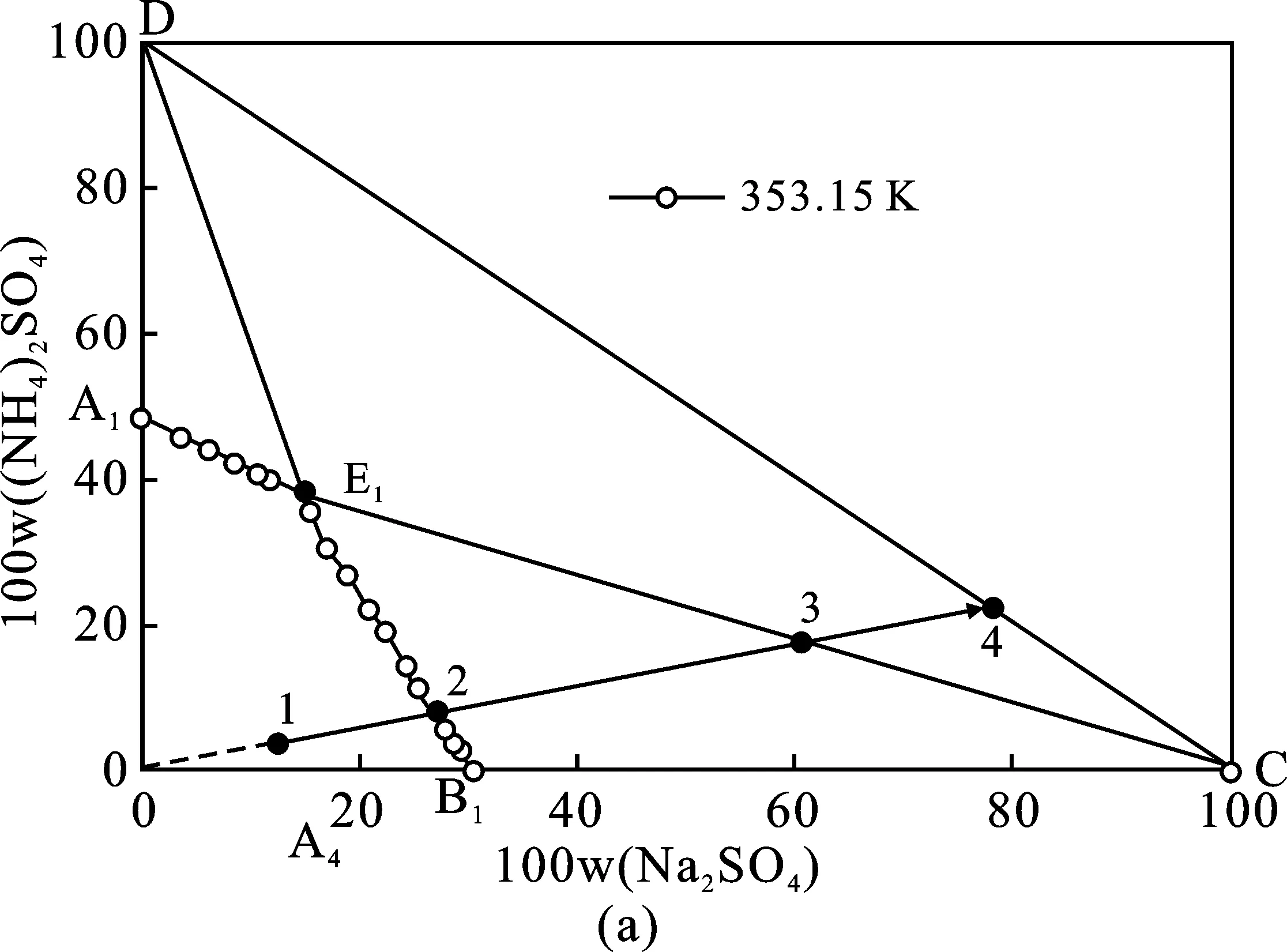
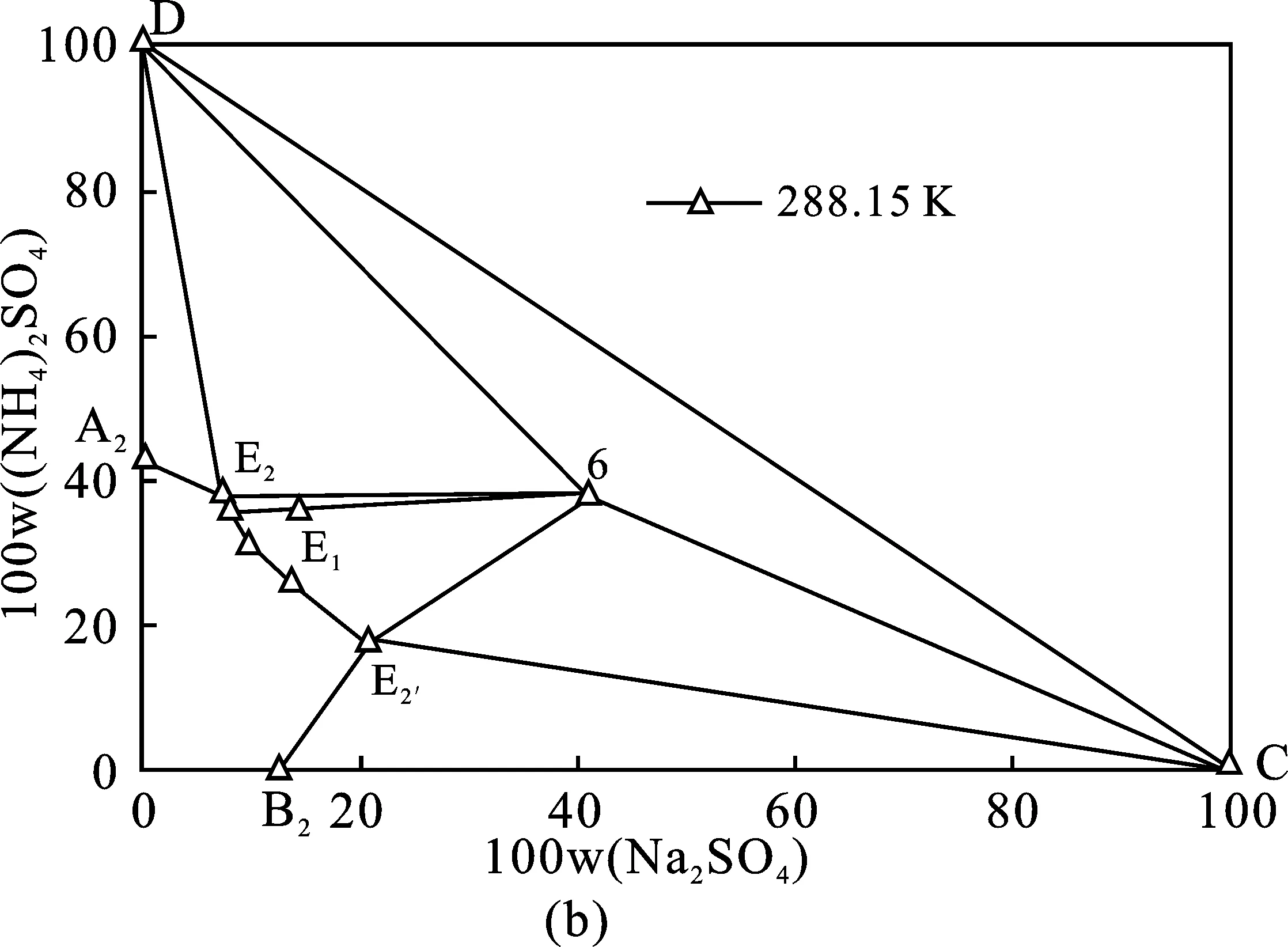
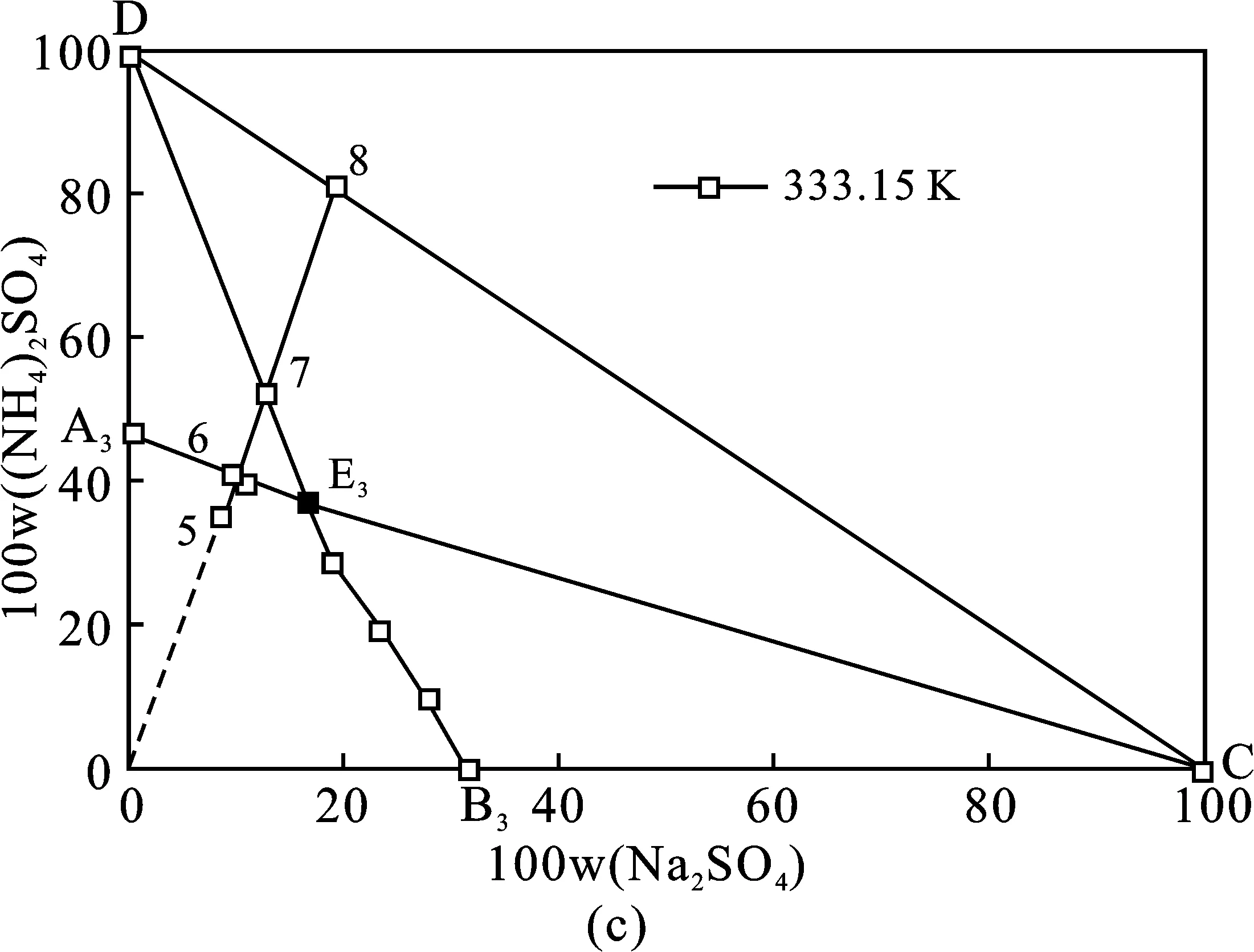
图4 (NH4)2SO4和Na2SO4 混合物在相图中表示的分离方法Fig.4 Sketch of the method for separation of the Na2SO4+(NH4)2SO4mixture shown in the equilibrium phase diagrams at T=353.15,288.15,333.15 K
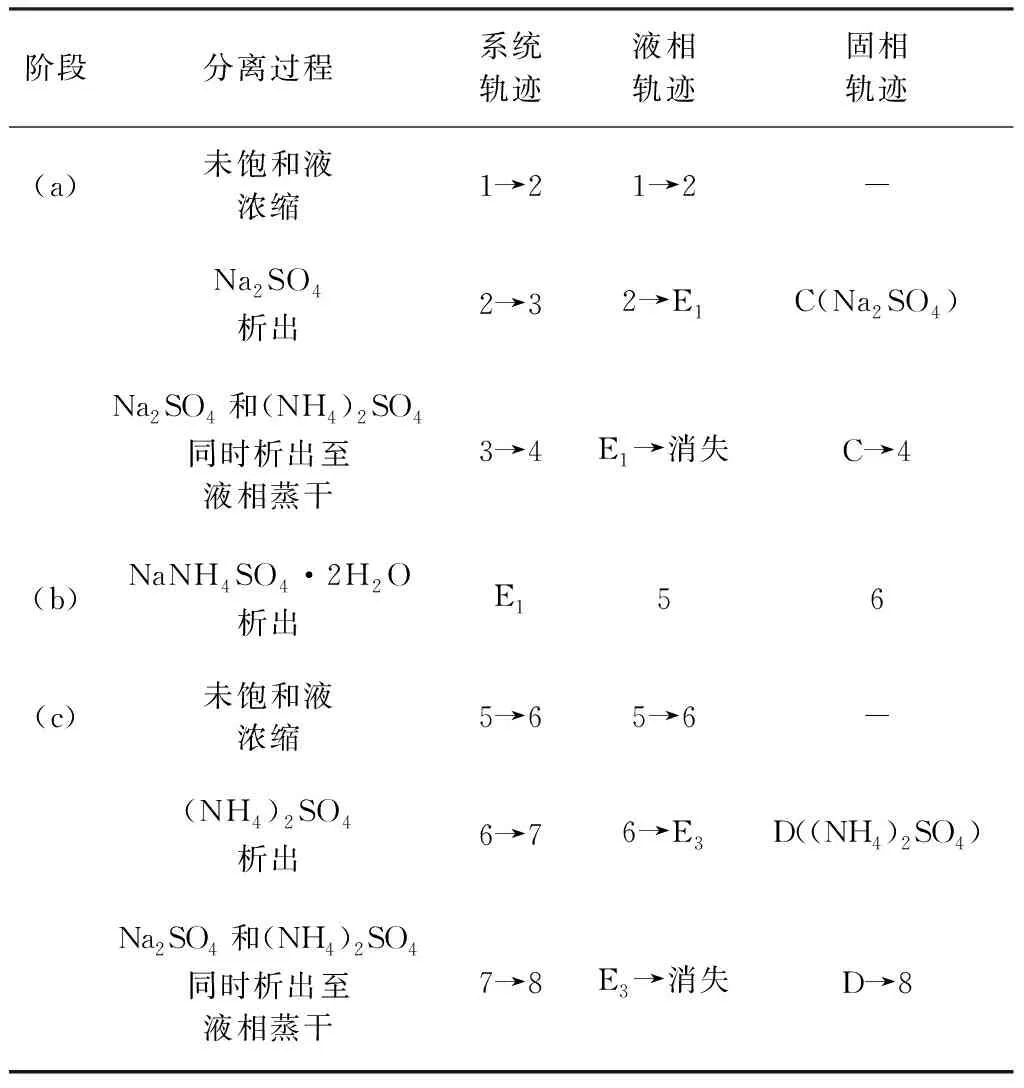
表3 沉钒废水的蒸发与冷却结晶过程Table 3 The evaporation and cooling crystallization process of vanadium precipitation solution
2.3 单质盐结晶分离研究
2.3.1 353.15 K条件下Na2SO4蒸发结晶分离研究 在(a)阶段中,废液蒸发过程中液相离子浓度、溶质析出率、产品纯度与收率的变化规律见表4。根据表4绘制出蒸发率与产品纯度、收率的关系,见图5。
由表4和图5可知,当蒸发率达到94.64%时,产品纯度开始大幅度下降,这是因为系统达到了共饱点,液相中的(NH4)2SO4也开始大量析出,此时液相中(NH4)2SO4与Na2SO4质量比W约为2.53,而353.15 K Na2SO4-(NH4)2SO4-H2O三元体系共饱点处(NH4)2SO4与Na2SO4质量比W为2.59,结果非常相近,也进一步说明了353.15 K条件下Na2SO4-(NH4)2SO4-H2O相图的准确性。另外,当蒸发率达到92.86%时,继续蒸发,收率增加的趋势缓慢,甚至会逐渐的下降。这主要是因为蒸发率过高,导致系统粘度大,过滤时分离困难,有部分晶体残留在反应釜壁面。因此,在实际分离过程中,应保持较小的蒸发率,降低系统粘度,但由于Na2SO4-(NH4)2SO4-H2O三元水盐体系的特殊性,蒸发率的降低会导致液相中(NH4)2SO4与Na2SO4比例减小,并最终导致在后续阶段分离(NH4)2SO4变得十分困难。综上考虑,选择编号6作为最佳实验条件,此时蒸发率为93.97%,液相W=2.39,Na2SO4纯度为98.95%,收率为83.17%。
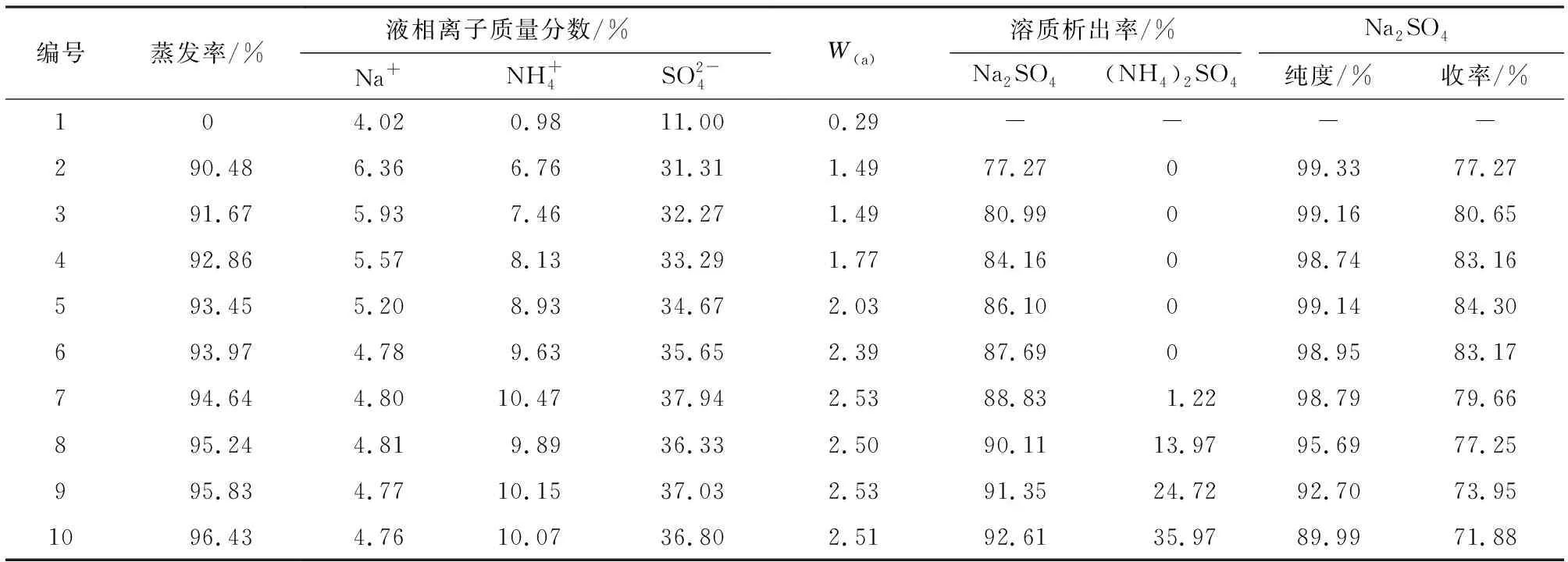
表4 蒸发过程中离子浓度、溶质析出率、产品纯度与收率的变化规律Table 4 Variation of ion concentration,solute precipitation rate,product purity and yield during evaporation

图5 Na2SO4收率与纯度随蒸发率的变化规律Fig.5 Variation law of Na2SO4 purity and yield with increasing evaporation ratio
2.3.2 288.15 K条件下复盐NaNH4SO4·2H2O冷却结晶分离研究 阶段(a)母液在288.15 K冷却结晶分离后,液相离子质量分数和所得复盐质量见表5。

表5 冷却结晶后液相离子质量分数和复盐质量Table 5 Mass fraction of liquid ions and mass of double salt after cooling and crystallization
由表5可知,二次母液中,(NH4)2SO4与Na2SO4比例由2.39增大至3.67,析出的复盐质量占母液质量的16.71%。由于阶段(b)冷却结晶得到的为复盐,不作为最终产品,故冷却方式不作讨论,只要求冷却析出复盐后改变饱和溶液组成。
2.3.3 333.15 K条件下(NH4)2SO4蒸发结晶分离研究 在(c)阶段中,二次母液蒸发过程中液相离子浓度、溶质析出率、产品纯度与收率的变化规律见表6。根据表6绘制出蒸发率与产品纯度、收率的关系,见图6。

表6 蒸发过程中离子浓度、溶质析出率、产品纯度与收率的变化规律Table 6 Variation of ion concentration,solute precipitation rate,product purity and yield during evaporation
由表6和图6可知,当蒸发率达到52.04%时,产品纯度开始大幅度下降。这是因为系统达到了共饱点,液相中的Na2SO4也开始大量析出,此时液相中(NH4)2SO4与Na2SO4质量比W约为2.11,而333.15 K条件下,Na2SO4-(NH4)2SO4-H2O三元体系共饱点处(NH4)2SO4与Na2SO4质量比W为2.26,结果有一定差距,其原因可能是随着蒸发率的增大,液相中其他杂质离子的浓度也逐渐增大,此时整个体系已经不能被看做三元水盐体系,其他一种或多种杂质离子浓度的增大导致体系析出更多(NH4)2SO4,说明杂质离子对(NH4)2SO4有显著的盐析作用,从而进一步导致共饱点液相中的(NH4)2SO4与Na2SO4质量比减小,低于理论值。由于(c)阶段蒸发率较小,没有出现由于体系粘度过大而导致的收率下降的问题,因此,在实验范围内,(NH4)2SO4收率随蒸发率增大而增大。综上考虑,选择编号6作为最佳实验条件,此时蒸发率为50.25%,液相W=2.15,(NH4)2SO4纯度为99.30%,收率为33.57%。
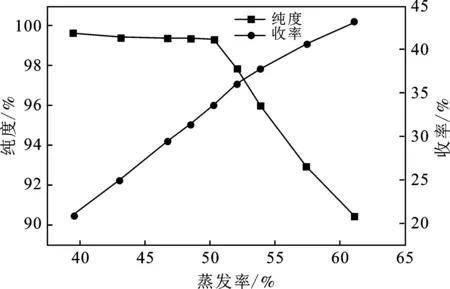
图6 (NH4)2SO4收率与纯度随蒸发率的变化规律Fig.6 Variation law of(NH4)2SO4 quality with increasing evaporation ratio
3 结论
(1)运用等温溶解平衡法测定了353.15 K条件下三元体系Na2SO4-(NH4)2SO4-H2O 的等温溶解度数据,并绘制了相应相图,含有一个共饱点,两条溶解度曲线,三个结晶区,为简单共饱和体系,无固溶体和复盐形成。353.15 K体系的共饱点液相组成为W(Na2SO4)=14.73%、W[(NH4)2SO4]=38.17%、W(H2O)=47.10%。
(2)运用353.15,288.15,333.15 K的Na2SO4-(NH4)2SO4-H2O的相图,对沉钒液中Na2SO4和(NH4)2SO4进行分离,Na2SO4纯度和收率分别为98.95%,83.17%,(NH4)2SO4纯度和收率分别为99.30%,33.57%。
