乌头内生细菌组成分析△
2022-06-22涂然黄文峰a冯正平王娜赵阳崔浪军
涂然,黄文峰a,冯正平,王娜,赵阳,崔浪军*
1.荆门市第二人民医院,湖北 荆门 448000;2.西北濒危药材资源开发国家工程实验室/药用资源与天然药物化学教育部重点实验室/陕西师范大学生命科学学院,陕西 西安 710062;3.西安交通大学第二附属医院 药物临床研究机构办公室,陕西 西安 710004
毛茛科(Ranunculaceae)乌头属(Aconitum)植物在我国分布广泛,约200 种,分为牛扁亚属(Subgen.Paraconitum)、乌头亚属(S.Aconitum)和露蕊乌头亚属(S.Gymnaconitum)3 个亚属[1],其中乌头属药用植物主要来源于乌头亚属[2]。附子(乌头侧根)具有祛风除湿、温经止痛的功效,可用于风寒温痹、关节疼痛、心腹冷痛、寒疝作痛、麻醉止痛等,生物碱是其主要活性物质[3]。附子是我国大宗药材,被历版《中华人民共和国药典》收录,在陕西、四川和云南等地大量种植。而乌头的3 个变种黄山乌头、展毛乌头和毛叶乌头虽然尚未规模化种植,但由于都含有与附子相同种类的生物碱,一些地方也作为附子的替代品广泛入药使用[4]。
植物内生菌是指生长于植物活体组织内部,但不引起明显负面影响的细菌或真菌[5],普遍存在于各种植物中,受环境、宿主种属等多种因素影响。植物内生菌在与宿主植物相互作用的过程中,可能获得合成宿主植物活性物质的能力,或能帮助宿主合成次级代谢产物[5-6]。因此,发掘能产生活性物质的内生菌,揭示内生菌与宿主合成次生代谢物质的关系具有重要的理论和现实意义。已有的研究表明,在北乌头、川乌和草乌中分离的黄曲霉等内生真菌能生产乌头碱[7]。但乌头的内生细菌是否有助于乌头合成生物碱等有效成分尚未明确。
本研究以野生乌头及其变种为材料,对乌头的生物碱含量及内生细菌进行研究,探讨乌头内生细菌与乌头生物碱含量的关系,以期为乌头生物碱合成机制的研究提供一定参考。
1 材料
1.1 样本
2013 年7 月,从中国乌头主要产区陕西汉中、陕西户县、安徽黄山、浙江临安、甘肃兰州等地采集野生健康乌头(附子)Aconitum carmichaeliiDebx.、黄山乌头A.carmichaeliivar.hwangshanicum、展毛乌头A.carmichaeliivar.truppelianum和毛叶乌头A.carmichaeliivar.pubescens样品,每个产区采集样品1 批,共5 批样品。所有样品经西北濒危药材资源开发国家工程实验室/药用资源与天然药物化学教育部重点实验室/陕西师范大学生命科学学院崔浪军副教授鉴定。
1.2 试药
次氯酸钠(美国Alfa Aesar公司);十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)、无水乙醇、氨水、异丙醇、醋酸乙酯均为分析纯,购自国药集团化学试剂有限公司;β-巯基乙醇(美国Gibco 公司);甲醇、乙腈(色谱纯、德国Merck公司);二乙胺(美国Sigma 公司);对照品苯甲酰新乌头原碱(benzoylmesaconine,BMA,批号:ZF0228BE14)、苯甲酰乌头原碱(benzoylaconitine,BAC,批号:ZF0228BB14)、苯甲酰次乌头原碱(benzoylhypacoitine,BHA,批 号:ZF0228BC14)、新乌头碱(mesaconitine,MA,批号:ZF0228BD14)、乌头碱(aconitine,AC,批号:ZF0228BA14)、次乌头碱(hypaconitine,HA,批号:ZF0228BF14)均购自上海源叶生物科技有限公司,纯度≥98%;脱氧核糖核苷三磷酸(dNTP)、FastPfu 缓冲液、TransStart®FastPfu DNA 聚合酶均购自北京全式金生物技术股份有限公司;AxyPrepDNA gel extraction kit(美国Axygen公司)。
1.3 仪器
5810R 型台式高速冷冻离心机(德国Eppendorf公司);L-80 XP 型超高速低温离心机(美国Beckman Coulter 公司);DYY-8C 型电泳仪(北京六一仪器厂);HHS21-6型水浴锅(上海博迅医疗生物仪器股份有限公司);ZF-206 型凝胶成像分析系统(郑州万博仪器设备有限公司);BK-600D 型超声波清洗机(山东迈福科学仪器股份有限公司);RE-5205 型旋转蒸发仪(上海亚荣生化仪器厂);GeneAmp 9700 型聚合酶链反应(polymerase chain reaction,PCR)核酸扩增仪(美国ABI 公司);QuantiFluor™-ST 微型荧光定量系统(美国Promega公司);1260 Infinity LC 型高效液相色谱(high performance liquid chromatography,HPLC)、EZChrom Elite 处理软件(美国Agilent 公司);Luna ODS C18色谱柱(250 mm×4.6 mm,5 μm,美国Phenomenex公司)。
2 方法
2.1 样本的采集与处理
在每个采样地点,选取3个子地点(20 m×20 m)采集样本,每个子地点之间的距离至少为2 km。从每个子地点随机采集10 株健康植株。植物样本尽快送回实验室,分成两组:一组先用流动的自来水冲洗除去附着的土壤,再用蒸馏水冲洗3 遍,将乌头分成叶、茎和根3 个部分,每部分依次用70%乙醇浸泡1 min、2%次氯酸钠洗涤3 min、70%乙醇冲洗3 次(每次持续30 s)、无菌蒸馏水洗涤3 次、灭菌滤纸进行表面干燥后,–80 ℃保存,用于宏基因组DNA 提取;另一组用流动自来水冲洗除去附着的土壤,将叶、茎和根分开,40 ℃干燥至恒重,粉碎后过100目筛,–20 ℃储存,用于有效成分测定。
2.2 高通量测序及数据处理
经表面消毒处理的乌头叶、茎和根组织,通过CTAB 法提取总DNA,并于–80℃保存。细菌16S rDNA V4 区的扩增引物为:515F 5′-GTGCCAGCMGCCGCGG-3′;907R 5′-CCGTCAATTCMTTTRAGTTT-3′。PCR反应体系为20 μL,含模板DNA 10 ng、1×缓冲液10 μL、4 U DNA 聚合酶、正反向引物各2 pmol、dNTP各250 μmol,加去离子水补足至20 μL。扩增程序如下:95 ℃,2 min;95 ℃,30 s;55 ℃,30 s;72 ℃,30 s;循环25 次;72 ℃,5 min。每个样本平行扩增3 管,平行扩增的PCR 产物混合成1管,2%琼脂糖凝胶电泳回收纯化。纯化回收的PCR产物用荧光定量系统定量并归一化处理。将上述扩增产物等摩尔混合,并根据标准规程在Illumina MiSeq测序平台(Shanghai Majorbio Bio-pharm Technology Co.,Ltd.)上进行测序(paired-end sequenced,2×250 bp)。基于16S 细菌核糖体数据库Silva(http://www.arb-silva.de),使用软件Trimmomatic 0.40、FLASH 1.2.11、Usearch 7.1、Mothur 1.30.1 和UniFrac 1.0 对数据去杂和分析,绘图由R语言工具(R-forge Vegan 2.0 package)完成。
2.3 乌头碱含量测定
2.3.1 供试品制备 精确称取样品粉末2 g,用25%的氨水3 mL 浸泡30 min,然后加入混合溶剂(异丙醇,醋酸乙酯-1∶1)50 mL,加塞并称定质量,超声(功率300 W,频率40 kHz,水温低于25 ℃)萃取30 min。冷却并再次称质量,混合溶剂补足减少的质量,摇匀并用滤纸滤过。准确量取滤液25 mL,40 ℃以下减压浓缩干燥,残余物溶于2 mL 甲醇,过0.22 μm滤膜,滤液用于生物碱含量测定。
2.3.2 对照品溶液的制备 分别精密称取BMA、BAC、BHA、MA、AC、HA 对照品0.51、0.20、0.91、1.09、0.26、1.06 mg 置同一1 mL 量瓶内,用甲醇溶解并定容至刻度,摇匀,得质量浓度分别为0.51、0.20、0.91、1.09、0.26、1.06 mg·mL–1的生物碱对照品溶液。
2.3.3 色谱条件 参照刘敏等[8]HPLC 测定乌头各组织提取物中3个双酯型和3个单酯型乌头碱成分的含量。流动相为乙腈(A)-0.1%二乙胺水溶液(B),梯度洗脱(0~8 min,28%A;8~12 min,28%~33%A;12~45 min,33%~50%A;45~55 min,50%A);柱温为25 ℃;检测波长为230 nm;流速为1 mL·min–1;进样量为20 μL;进样器温度保持在10 ℃。
2.3.4 方法学考察 精密度试验:将适宜浓度的生物碱对照品溶液,按上述2.3.3 项下色谱条件分别连续进样测定5 次,记录各自的峰面积,计算其RSD。BMA、BAC、BHA、MA、AC、HA 的RSD分别为1.63%、1.27%、1.45%、1.06%、1.51%、1.68%。
重复性试验:精密称取汉中产乌头根细粉约2 g共5 份,按2.3.1 项下方法制备供试品溶液,按2.3.3 项下色谱条件进行分析。根据所得6 种生物碱的峰面积计算其在样品中的量,结果BMA、BAC、BHA、MA、AC、HA 质量分数的RSD 分别为1.90%、1.73%、1.56%、1.46%、1.82%、1.62%。
加样回收率试验:精密称取汉中产乌头根细粉约1 g 共18 份,每3 份用于一种生物碱的回收率测定,共6 组。每组样品分别加入对应的对照品溶液适量,按2.3.1 项下方法制备供试品溶液,按2.3.3项下色谱条件进行分析。根据测得量和加入量计算其加样回收率(RSD)分别为101.78%(1.44%)、98.09%(2.15%)、100.48%(2.20%)、99.27%(2.03%)、98.61%(1.80%)、101.46%(1.71%)。
2.4 数据处理
采用SPSS 18.0 软件对乌头及其变种各组织生物碱含量进行主成分分析(principal components analysis,PCA),选取第一主成分(PC1)和第二主成分(PC2)作图。15 种乌头组织样本的内生细菌组成基于UniFrac分析算法呈现物种多样性矩阵,由R语言中的主坐标分析(principle coordination analysis,PCoA)统计和分析函数进行数据运算,并选择排在第一位和第二位的特征值做图。
采用SPSS 18.0 软件进行数据统计学分析,计量资料以()表示,数据对比使用独立样本t检验;均以P<0.05为差异有统计学意义。
3 结果
3.1 乌头生物碱含量
HPLC 测量乌头叶、茎和根中BMA、BAC、BHA、MA、AC、HA 含量。整体来说,除BHA 的含量在根、茎、叶3 个部位没有明显的规律外,几种乌头叶片BAC 含量显著高于茎部和根部,根系BMA、MA、AC 和HA 含量整体高于地上部分。乌头及其不同变种的生物碱含量差异较大。不同乌头及其变种在同一个部位的几种生物碱含量相差较大,如BMA在黄山乌头茎中质量分数高达35.60 mg·kg–1,但在毛叶乌头茎中未被检出。MA 在黄山乌头茎中质量分数为275.60 mg·kg–1,而在陕西户县产的乌头中未被检出。AC 除了在黄山乌头的茎和叶、汉中产的乌头茎中检测出外,在其他乌头和变种中的茎和叶均未被检出(表1)。即使是同为乌头,产自户县和汉中的样品,其根茎叶中的6 种的生物碱含量差异也较大。以乌头及其变种各组织生物碱含量进行PCA,结果(图1)显示,乌头各组织样本分为3 群:黄山乌头根和毛叶乌头根、展毛乌头根和户县产乌头根及其他茎叶组织。叶和茎生物碱组成较为相似,而根与叶、茎在生物碱组成上表现出明显差异。
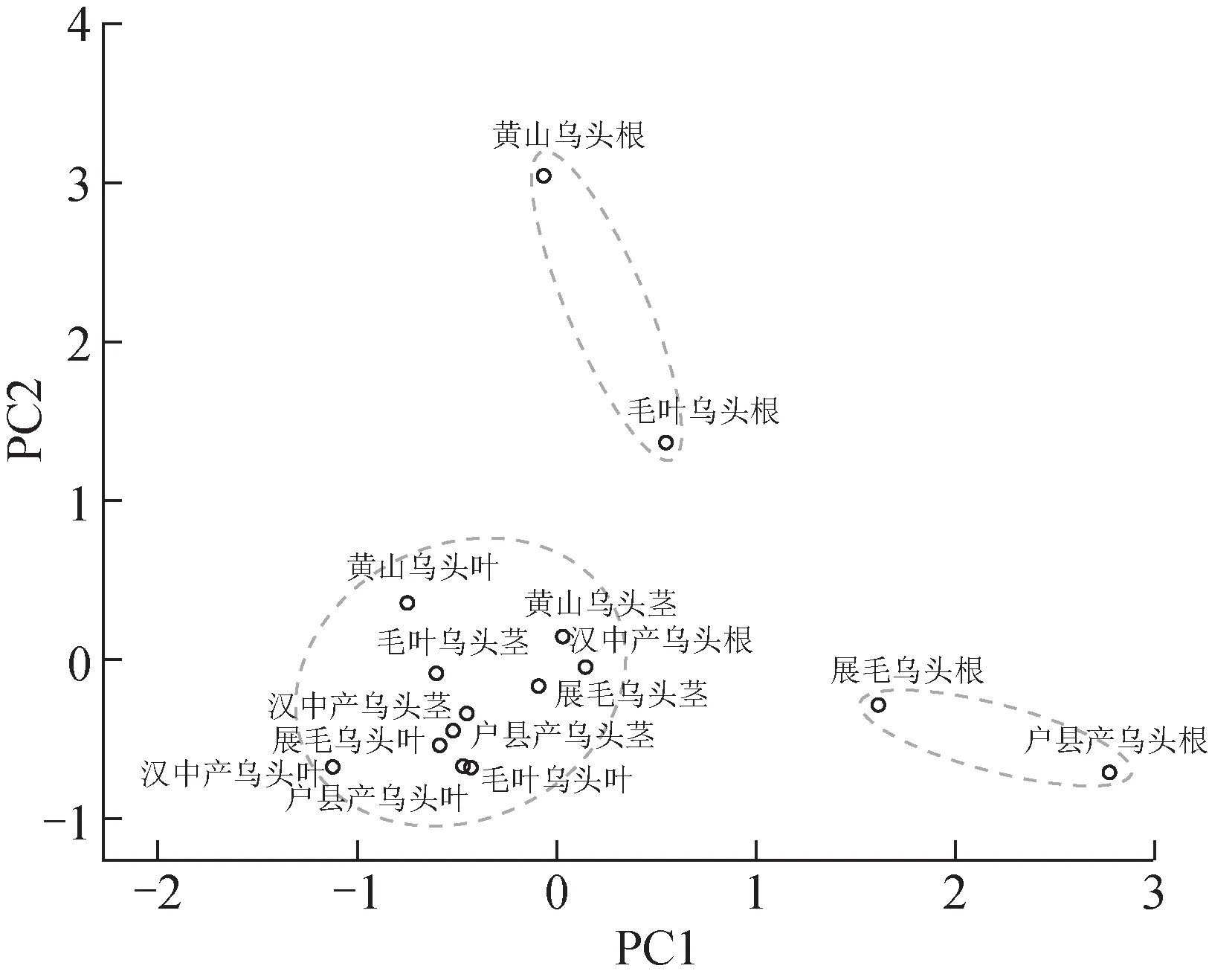
图1 乌头及其变种组织样本生物碱含量的PCA
表1 乌头及其变种各组织生物碱质量分数(,n=3)
注:同列不同字母表示P<0.05;nd表示未检出。
3.2 乌头内生细菌组成
乌头及其变种叶、茎和根的内生细菌16S rDNA V4 区进行高通量测序,得到121 362 254 bp 数据,拼接得到305 817 条序列,有效序列占比99.99%,在97%的置信区间进行操作分类单元(OTU)分类,共得到90个OTU。汉中产乌头、黄山乌头、展毛乌头、毛叶乌头和户县产乌头的内生细菌的OTU数量分别为28、78、66、61、38 个,其中20 个OTU 为乌头共有。整体来说,乌头内生细菌主要由4 门,9 纲,16 目,36 属组成(无法分类的除外),其中变形菌门(Proteobacteria)相对丰度最高,拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)和疣微菌门(Verrucomicrobia)相对丰度较高(图2)。PCoA 结果见图3,展毛乌头茎、毛叶乌头茎、户县产乌头茎、黄山乌头茎、户县产乌头叶聚集;汉中产乌头叶、展毛乌头叶、汉中产乌头根和汉中产乌头茎、黄山乌头叶、毛叶乌头叶聚集;户县产乌头根、展毛乌头根和黄山乌头根、毛叶乌头根聚集。总体而言,相同组织的内生细菌组成更相似,叶和茎内生细菌组成差异明显,黄山乌头根和毛叶乌头根,展毛乌头根和户县产乌头根内生细菌组成更为相似。热图分析结果见图4,展毛乌头茎、汉中产乌头茎、黄山乌头茎总体的菌群组成更相似,鞘氨醇单胞菌属(Sphingomonas)、不动杆菌属(Acinetobacter)、甲基杆菌属(Methylobacterium)这3 个属的细菌丰度接近;毛叶乌头叶、汉中产乌头叶、黄山乌头叶菌群组成相似,鞘氨醇单胞菌属细菌丰度接近;展毛乌头根、户县产乌头根聚为一支,纤发菌属(Leptothrix)、假单胞菌属(Pseudomonas)、黄杆菌属(Flavobacterium)、丰佑菌属(Opitutus)、池塘杆菌属(Piscinibacter)、不动杆菌属细菌丰度接近;黄山乌头根和毛叶乌头根距离较近,假单胞菌属、黄杆菌属、独岛氏菌属(Dokdonella)、黏液杆菌属(Mucilaginibacter)、水小杆菌属(Aquabacterium)细菌丰度接近。

图2 15种乌头组织样本内生细菌的组成

图3 15种乌头组织样本内生细菌的PCoA
3.3 乌头内生细菌与生物碱含量的相关性
结合乌头及其变种各组织生物碱含量和内生细菌组成的相似性,以乌头及其变种的根(除汉中产乌头根外)共有的内生细菌OTU 丰度与乌头根组织生物碱含量做皮尔逊(Pearson)相关性分析。结果见表2,有6种内生细菌丰度与乌头根组织生物碱含量正相关,分别是与AC 含量正相关的黄杆菌属、假单胞菌属、丛毛单胞菌科(Comamonadaceae)及与HA 含量正相关的丰佑菌属、池塘杆菌属及非培养的假单胞菌目细菌(g_norank;s_uncultured_Pseudomonadales_bacterium)。
4 讨论
植物内生细菌组成受到宿主植物种属和环境因素等多方面的影响[9]。宿主植物种属差异意味着其内环境pH、离子浓度及活性物质的差异,即内生细菌生存环境的巨大差异,对内生细菌群落组成有重大影响。Ding 等[10]关于美国俄克拉荷马州北部草原保护区5 个植物物种中内生细菌的多样性及群落结构的研究也表明,内生细菌群落的生物分类组成及变化,可能主要取决于植物宿主物种的性质。同时,某些内生细菌通过种子垂直传播到下一代植物,这也是植物种属差异造成内生细菌不同的原因之一[11]。环境因素包括土壤、海拔、地理位置等,如土壤总碳、总氮、有效磷和pH是导致细菌群落总体组成差异的主要因素[12]。对祁连山不同海拔2种豆科植物结节内生细菌的多样性研究表明,海拔对植物内生细菌的影响力可能大于其他生态因素[13]。而地理位置的差异导致内生细菌的一些OTU 可以充当宿主植物的地理标志,在某些情况下甚至可以充当品种指纹[14]。虽然相同种或亚种的植物生长在不同的环境导致其内生细菌的群落结构不同,但依然有一些与宿主关系密切的细菌在这些不同环境的种或亚种中存在(丰度有所不同)。Mezzasalma 等[14]关于3 个葡萄品种(Cabernet Sauvignon、Syrah 和Sauvignon Blanc)分布于不同地理及气候条件特征(意大利北部、意大利阿尔卑斯山和西班牙北部)的内生细菌研究显示所有的葡萄样品均具有一些共有细菌类群,而与采样地点无关。例如,芽胞杆菌属(Bacillus)、甲基杆菌属、鞘氨醇单胞菌属和其他属属于α-变形菌纲(Alphaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)和放线菌门。
本研究结果显示,黄山乌头OTU 最多,但黄山乌头、展毛乌头、毛叶乌头相差不大,内生细菌均较陕西汉中产的乌头和陕西户县产的乌头更为丰富。多样性指数表明,黄山乌头、展毛乌头和毛叶乌头内生细菌较陕西汉中产的乌头和陕西户县产的乌头组成更多样。但乌头及其变种内生细菌菌群组成存在相似之处。首先,内生细菌主要由变形菌门、拟杆菌门、放线菌门和疣微菌门组成,其中变形菌门占主导。这与药用植物白及内生细菌的组成变形菌门(83.87%)占主导相一致[15]。其次,有20个OTU为乌头及其变种所共有,而这20个OTU中所对应的薄层菌属(Hymenobacter)、鞘氨醇单胞菌属、不动杆菌属、甲基杆菌属、池塘杆菌属基本属于乌头的优势内生细菌,这说明乌头及其变种内生细菌菌群组成的核心部分较相似。最后,乌头及其变种内生细菌的丰度和多样性就不同组织而言,基本表现为根>叶>茎,相同组织的内生细菌菌群组成更相似。
虽然环境因素在一定程度上影响了乌头不同变种内生细菌的丰度和多样性,但遗传特性接近的乌头及其变种的主要内生细菌组成特征相似,而且根组织特定种属的内生细菌丰度与该组织生物碱的含量存在相关性。乌头根组织生物碱含量与内生细菌黄杆菌属、假单胞菌属、丛毛单胞菌科及丰佑菌属、池塘杆菌属、非培养的假单胞菌目细菌丰度成正相关。黄杆菌属、假单胞菌属、丛毛单胞菌科、丰佑菌属作为植物内生菌在植物的根部很常见[16-18]。尽管在过去的研究中黄杆菌属的菌株与宿主植物的生长促进没有表现出直接关系,但仍有研究表明根中的黄杆菌属丰度与宿主植物生物量呈现正相关[19]。现有研究也表明某些黄杆菌属菌株可以合成生长素、赤霉素和细胞分裂素等植物激素刺激宿主植物生长[20]。同时,根中黄杆菌属的细菌丰度与宿主植物对病原体的抗性也呈现正相关[21]。假单胞菌属和丛毛单胞菌科的细菌都具有植物促生长活性,是根组织内生菌群的主要组成[22],Rojas-Solís 等[17]的研究中分离到植物内生细菌斯氏假单胞菌(Pseudomonas stutzeri)E25 菌株不仅表现出根组织促生长效果,而且产生抗真菌挥发性有机化合物。共生细菌可以刺激或激活植物的免疫反应[23-24],迄今为止研究的所有植物物种均产生防御化合物,尤其药用植物的次级代谢产物一般也作为防御化合物产生[25]。内生菌在定殖的过程中直接或间接刺激宿主分泌活性物质。例如,假单胞菌属细菌感染拟南芥叶,可以进一步推动抗菌香豆素化合物的根分泌,进而形成对宿主植物的稳定保护[26-27]。
综上所述,乌头及其变种的内生细菌在丰度和多样性上存在差异,但核心菌群组成相似。且乌头根组织特定种属的内生细菌丰度与生物碱含量存在相关性。
