长链非编码RNA DBH-AS1通过下调AKT1表达抑制胰腺癌进展
2022-06-22李慧芬程文英陶元平欧阳柳李小玲汪珍光曹晶珠
李慧芬,程文英,陶元平,杨 乐,欧阳柳,李小玲,汪珍光,曹晶珠
1. 海军军医大学第三附属医院肝外三科,上海 200433 2. 中国人民解放军92493部队医院内三科,葫芦岛 125003 3. 海军军医大学第一附属医院普外三科,上海 200433 4. 海军军医大学第一附属医院内分泌科,上海 200433
中国人群中胰腺癌发病率正逐年上升,2019年新发病例约占全世界总病例数的20%[1-2]。目前,手术切除和化疗是胰腺癌的主要治疗策略[3]。在过去的几十年中,胰腺癌患者的总体生存时间未得到明显改善,患者5年生存率仍低于5%[4-5]。因此,深入了解胰腺癌发生与进展的详细分子机制至关重要。
近年来,越来越多的研究证明,长链非编码RNAs(lncRNAs)是细胞正常生理和病理过程中的重要调控因子[6]。多种lncRNAs已被证实在多种肿瘤组织中异常表达,进而促进或抑制肿瘤细胞的增殖、侵袭和转移能力[7-9]。本研究旨在检测lncRNA DBH-AS1在胰腺癌中的表达情况,探讨DBH-AS1在胰腺癌进展中潜在的分子作用机制。
1 材料与方法
1.1 研究样本 选择2015年7月至2017年12月海军军医大学第一附属医院普外三科收治的原发胰腺癌患者45例,收集患者经手术切除的胰腺癌组织和对应癌旁组织(距离肿瘤组织边缘至少大于2 cm)。所有样本离体后于液氮保存,以备后续实验。所有组织样本均经病理证实为胰腺癌。本研究经海军军医大学第一附属医院伦理委员会批准(2017-148-06),所有患者均知情并签署知情同意书。
1.2 主要材料及试剂 本研究所用细胞均购自中科院上海细胞库。LncRNA DBH-AS1干扰慢病毒和空白(阴性)对照均购自上海吉玛基因。CCK-8试剂盒购自上海碧云天。Transwell小室购自美国Corning公司。AKT1、p-mTOR、mTOR以及β-actin抗体均购自英国Abcam公司。
1.3 细胞培养和病毒转染 正常永生化人胰腺上皮细胞株(HPDE6C7)和4株人胰腺癌细胞株(CFPAC-1、Mia-capa2、L3.6pl和PANC1)均用添加10%胎牛血清和1%青霉素-链霉素的DMEM高糖培养基,在37℃、5%CO2的恒温培养箱中培养。依照病毒试剂转染说明,构建敲低DBH-AS1的胰腺癌细胞株。
1.4 实时荧光定量PCR(qRT-PCR) TRIzol法提取组织和细胞的总RNA,用Nanodrop 2000测定RNA浓度并反转录为cDNA。采用ViiATM 7实时qRT-PCR系统(美国Applied Biosystems公司)进行qRT-PCR,反应体系为10 μL,包括2×SYBR Premix ExTaqTM试 剂5 μL、ROX校 正 染 料Ⅱ 0.2 μL、上游和下游引物各0.4 μL、cDNA模板 2 μL、双蒸水2 μL。以GAPDH基因为内参基因,应用2-ΔΔCT法计算DBH-AS1和AKT1基因相对表达量。引物序列见表1。

表1 qRT-PCR引物序列
1.5 细胞增殖 将细胞接种于96孔板,加入CCK-8溶液采用酶标仪分别在0 h、24 h、48 h和72 h测定450 nm波长的光密度值。
1.6 克隆形成 将各组处理细胞消化计数并分别接种在6孔板中,于37℃、5%CO2的恒温培养箱中培养10 d,出现肉眼可见的克隆时,终止培养,弃去上清,PBS清洗后用4%多聚甲醛固定,随后结晶紫染色,采用Image J软件进行克隆计数。
1.7 侵袭和迁移 将细胞密度调整至1.5×104个/mL,取100 μL细胞悬液加入铺有稀释的基质胶的transwell小室的上室,将加有10%FBS的DMEM培养基加入下室,孵育24 h,底部细胞用4%多聚甲醛固定,0.1%结晶紫染色后,显微镜下随机选择5个视野计数。细胞迁移实验在上室中不添加基质胶,其余同前。
1.8 Western印迹 用RIPA缓冲液进行细胞和组织裂解提取蛋白质,提取过程保持低温,用碧云天BCA蛋白浓度测定试剂盒检测蛋白浓度,用5×loading buffer和PBS调整蛋白浓度并加热变性。用10% SDS-PAGE凝胶电泳分离,然后将分离的蛋白质转移到PVDF膜上。室温下用5%脱脂奶粉封闭2 h,洗膜,在4℃条件下一抗孵育过夜(AKT1、p-mTOR、mTOR以 及Actin),洗 膜 后室温下二抗孵育2 h,洗涤,显影。
1.9 统计学处理 采用GraphPad Prism 6.0软件进行统计分析及作图。符合正态分布的计量资料均以±s表示,所有实验均至少完成3次以上生物学重复实验。2组组间比较采用独立样本t检验,多组间比较采用方差分析。计数资料以n(%)表示,组间比较采用χ2检验。采用Kaplan-Meier生存曲线比较DBH-AS1表达量与胰腺癌患者预后的关系。采用Pearson相关分析检测两变量之间的相关性。检验水准(α)为0.05。
2 结果
2.1 DBH-AS1在胰腺癌组织中的表达情况 在线数据库GEPIA(Gene Expression Profiling Interactive Analysis,http://gepia.cancer-pku.cn/)结果显示(图1A),lncRNA DBH-AS1在胰腺癌肿瘤组织的表达明显低于癌旁组织,差异倍数>2(P<0.05)。应用qRT-PCR检测lncRNA DBH-AS1在45例胰腺癌患者肿瘤组织和对应癌旁组织中的表达情况,结果(图1B)显示:DBH-AS1在胰腺癌组织中的表达水平低于对应的癌旁组织(0.0372±0.0032vs0.0792±0.0070),差异倍数>2(P<0.01)。结果(图1C)显示:与正常胰腺细胞系(HPDE6C7)相比,DBH-AS1在胰腺癌细胞系(Mia-capa2、CFPAC-1、L3.6pl和PANC1)中的表达水平也下调,差异倍数>2(P<0.001)。

图1 DBH-AS1在胰腺癌肿瘤组织和胰腺癌细胞系中表达下调A:GEPIA数据库中胰腺癌组织和正常胰腺组织中DBH-AS1的表达水平;B:qRT-PCR分析胰腺癌肿瘤组织和胰腺癌旁组织中DBH-AS1的表达水平(n=451);C:qRT-PCR分析正常胰腺细胞系(HPDE6C7)和胰腺癌细胞(CFPAC-1、Mia-capa2、L3.6pl和PANC1)中DBH-AS1的表达水平。每组3个重复孔,*P<0.05,***P<0.001。
2.2 DBH-AS1在胰腺癌肿瘤组织中的表达水平与患者恶性临床特征的相关性 根据lncRNA DBH-AS1在胰腺癌患者肿瘤组织中的中位表达量(0.0380),将45例患者分为DBH-AS1低表达组 (n=23)和DBH-AS1高表达组(n=22)。结果(表2)显示,DBH-AS1在胰腺癌组织中的低表达与肿瘤分化(P=0.038)、TNM分期(P=0.029)和淋巴结转移(P=0.006)相关。

表2 lncRNA DBH-AS1表达水平与胰腺癌患者临床特征的关系n(%)
2.3 DBH-AS1在胰腺癌患者肿瘤组织中表达水平与患者预后的相关性 以DBH-AS1在胰腺癌组织中表达水平的中位数为分界线,将176例胰腺癌患者分为DBH-AS1高表达组(n=88)和DBH-AS1低表达组(n=88)。结果(图2)显示,与胰腺癌肿瘤组织DBH-AS1高表达组患者相比,DBH-AS1低表达组患者的无瘤生存率(P=0.013)和总体生存率(P=0.009)较低,差异有统计学意义。
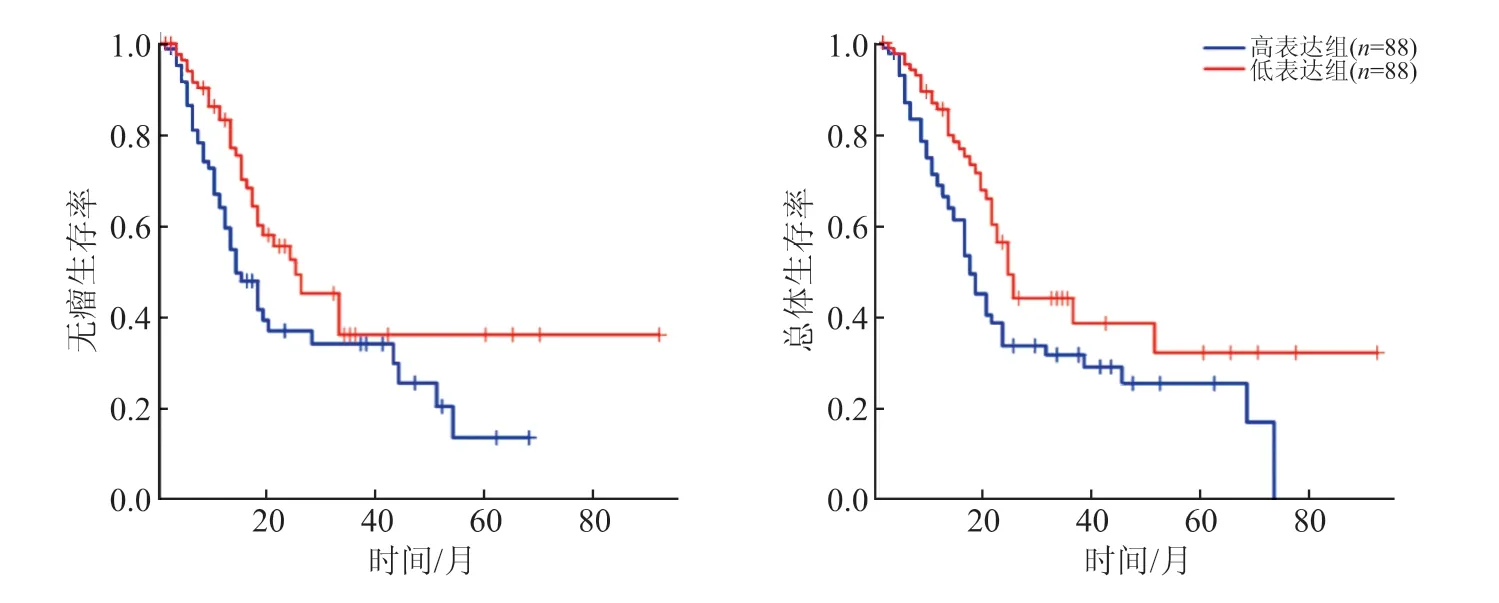
图2 数据库中DBH-AS1在胰腺癌肿瘤组织中表达下调与患者预后较差相关
2.4 敲低DBH-AS1对胰腺癌细胞增殖能力和克隆形成能力的影响 构建敲低DBH-AS1慢病毒,转染至DBH-AS1表达相对较高的2株胰腺癌细胞系(Mia-capa2和PANC1)中。结果(图3A)显示,转染敲低DBH-AS1慢病毒后,Mia-capa2细胞中DBH-AS1的表达水平比对照组下降约6倍 (P<0.001),PANC1细 胞 中DBH-AS1的 表 达水平较对照组下降约8倍(P<0.001)。CCK-8检测结果(图3B、3C)显示,与对照组相比,转染敲低DBH-AS1慢病毒后,Mia-capa2和PANC1细胞的增殖能力分别在48 h和72 h后提高(P< 0.05)。细胞克隆形成实验结果(图3D~3E)显示,干扰DBH-AS1表达后Mia-capa2和PANC1细胞的克隆形成能力较对照组显著增强(Mia-capa2:207±11.55vs86.0±2.309,P<0.001;PANC1:228.7±14.53vs84.0±2.887,P<0.001)。

图3 敲低DBH-AS1表达可增强胰腺癌细胞增殖和克隆形成能力A:qRT-PCR检测慢病毒转染前后DBH-AS1的表达水平;B,C:CCK-8法检测转染si-NC或si-DBH-AS1后PANC1 (B)和Mia-capa2 (C)细胞增殖情况;D:集落形成法检测转染si-NC或si-DBH-AS1对Mia-capa2和PANC1细胞克隆形成能力的影响。每组3个重复孔,*P<0.05,***P<0.001。
2.5 迁移和侵袭 Transwell实验结果(图4A)显 示,干 扰DBH-AS1表 达 后,Mia-capa2和PANC1细胞的迁移能力较对照组增强(Miacapa2:222.7±2.603vs131.3±3.528,P<0.001;PANC1:113.7±0.882vs88.3±0.333,P<0.001)。侵袭实验结果(图4B)显示,Mia-capa2和PANC1细胞的侵袭能力较对照组显著增强(Mia-capa2:241.7±2.333vs111.3±1.202,P<0.01;PANC1: 73.3±1.333vs60.0±1.732,P<0.001)。

图4 敲低DBH-AS1表达可增强胰腺癌细胞迁移(A)和侵袭能力(B)Original magnification:×100; 每组3个重复孔,**P<0.01,***P<0.001。
2.6 DBH-AS1调 控AKT1/mTOR信 号 通 路 在 线 数 据 库GEPIA结果(图5A)显 示,lncRNA DBH-AS1在胰腺癌肿瘤组织中的表达水平与AKT1 mRNA的表达水平负相关(r=-0.18,P= 0.016)。qRT-PCR结果(图5B)显 示,干 扰DBH-AS1表 达 后,Mia-capa2细 胞 和PANC1细胞的AKT1 mRNA表达水平较对照组显著提高(Mia-capa2:4.057±0.180vs1.000±0.505,P<0.001;PANC1:5.425±0.896vs1.000±0.706,P<0.001)。Western印迹结果(图5C、5D)表明,干扰DBH-AS1表达后Mia-capa2和PANC1细胞的AKT1蛋白(Mia-capa2:2.541±0.182vs1.000±0.121,P<0.001;PANC1:2.392±0.252vs1.000±0.243,P<0.001)和p-mTOR/mTOR蛋白(Mia-capa2:2.023±0.102vs1.000±0.289;PANC1:2.171±0.153vs1.000±0.228,P<0.001)表达水平较对照组显著提高。
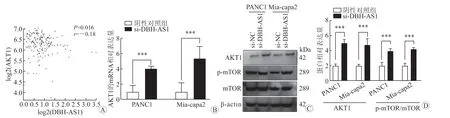
图5 LncRNA DBH-AS1通过调控AKT1表达抑制mTOR信号通路A:利用在线数据库GEPIA数据分析lncRNA DBH-AS1在胰腺癌肿瘤组织中的表达水平与AKT1 mRNA的表达水平的相关性;B:qRT-PCR检测转染si-NC或si-DBH-AS1后Mia-capa2和PANC1细胞中AKT1 mRNA的表达水平;C,D:Western 印迹检测转染si-NC或si-DBH-AS1后,Mia-capa2和PANC1细胞AKT1/mTOR通路分子的蛋白表达水平。***P<0.001。
3 讨论
目前,已有大量lncRNAs被证实参与胰腺癌的发生与进展。例如,胰腺导管腺癌中lncRNA PANDAR表达异常上调,并且与胰腺癌肿瘤血管侵犯密切相关[10]。另有研究[11]发现,lncRNA LOXL1-AS1在胰腺癌肿瘤组织和胰腺癌细胞系中表达上调,且LOXL1-AS1通过吸附miR-28-5p上调SEMA7A表达,促进胰腺癌进展。
此外,最新研究[12]表明,lncRNA XLOC通过与c-Myc结合并增强其蛋白稳定性,从而促进胰腺癌的发生和谷氨酸代谢。LncRNA DBH-AS1从染色体9q34转录而来,既往研究发现DBH-AS1在多种恶性肿瘤组织中表达上调并发挥重要的癌基因作用,例如肝癌[13]、非小细胞肺癌[14]、骨肉瘤[15]及弥 漫 大B细胞淋巴瘤[16]等。但是,lncRNA DBH-AS1在胰腺癌发病中的作用机制仍然尚未完全清楚。
本研究结合在线数据库GEPIA以及qRT-PCR结果发现,lncRNA DBH-AS1在胰腺癌肿瘤组织中表达下调,同时qRT-PCR结果也表明DBH-AS1在胰腺癌细胞系中均表达下调。利用队列样本发现,lncRNA DBH-AS1在胰腺癌中的低表达与肿瘤分化程度、TNM分期和淋巴结转移相关,而生存分析结果提示胰腺癌肿瘤组织中DBH-AS1低表达的患者预后较差。通过慢病毒转染,进一步研究敲低DBH-AS1对胰腺癌细胞功能的影响,结果显示,敲低DBH-AS1可显著促进胰腺癌细胞的增殖、克隆形成和迁移侵袭能力。上述结果提示,lncRNA DBH-AS1在胰腺癌中具有抑癌作用。
为了进一步探究相关机制,首先利用在线GEPIA数据库分析,发现DBH-AS1与AKT1在胰腺癌肿瘤组织中的表达负相关,提示在胰腺癌中DBH-AS1可能下调AKT1表达;进一步通过qRTPCR和Western印迹实验,验证了敲低DBH-AS1的表达可上调AKT1 mRNA和蛋白水平,同时,敲低DBH-AS1表达可上调mTOR蛋白表达。以上结果提示,lncRNA DBH-AS1在胰腺癌中可抑制AKT1/mTOR信号通路。
本研究存在一定的局限性:(1)DBH-AS1的表达与胰腺癌患者的预后以及病理特征之间的关系需要进一步扩大样本量研究,以进一步证实DBH-AS1在胰腺癌中作为预后标志物的潜力;(2)本研究仅探究了敲低DBH-AS1对胰腺癌细胞恶性表型的影响,而缺乏对过表达DBH-AS1后胰腺癌细胞恶性表型变化的研究;(3)需要进一步通过补充体内试验,验证DBH-AS1对胰腺癌细胞增殖和转移能力的影响;(4)DBH-AS1调控AKT1表达的作用机制有待进一步研究,其是否通过作为内源竞争RNA(competing endogenous RNA,ceRNA)来调控AKT1有待进一步验证。
综上所述,本研究发现DBH-AS1在胰腺癌组织中表达下调与患者不良预后相关,敲低DBH-AS1可显著促进胰腺癌细胞增殖、克隆形成和迁移侵袭能力。机制研究结果提示,DBH-AS1/AKT1/mTOR轴可能是胰腺癌进展的关键信号通路。
利益冲突:所有作者声明不存在利益冲突。
