Stanford A 型主动脉夹层患者术后延迟拔管的危险因素分析及护理
2022-06-21王毅贞裴海燕
王毅贞,裴海燕
厦门大学附属第一医院心脏外科,福建厦门 361001
主动脉夹层(AD)病即为主动脉夹层动脉瘤,是指主动脉内膜因多种原因撕裂后, 腔内血液通过内膜破口进入动脉壁中层后,形成了夹层血肿[1]。该“血肿”会沿着血管的长轴方向扩展,逐渐形成真、假腔病理改变[2-3]。 主动脉夹层最常见的分型为Stanford 分型和 Debakey 分型[4-5]。 其中,Stanford A 分型一般被认为与DebakeyⅠ、Ⅱ相当,包含主动脉夹层动脉瘤起源于升主动脉, 扩展超过主动脉弓到降主动脉及腹主动脉(DebakeyⅠ)、主动脉夹层动脉瘤起源并局限于升主动脉(DebakeyⅡ)[6]。有研究表明,部分患者术后短期内无法拔除气管插管,会严重影响预后。该研究将分析对象限定在Stanford A 分型的主动脉夹层手术患者,对术后延迟拔管的危险因素进行梳理,回顾性随机选择该院 2017 年1 月—2020 年 10 月收治的80 例患者为例,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析该院心脏外科80 例Stanford A 分型主动脉夹层手术患者。该院伦理委员会批准该研究。
根据术后是否延迟拔管, 将80 例患者分为两组,具体情况如下:
①延迟拔管组 42 例,男 38 例、女 4 例;Stanford A 分型对应Debakey 分型分布情况为:DebakeyⅠ型23 例、DebakeyⅡ型 19 例。
②未延迟拔管组38 例,男 33 例、女 5 例;Stanford A 分型对应Debakey 分型分布情况为:DebakeyⅠ型 19 例、DebakeyⅡ型 19 例。
两组患者一般资料对比差异无统计学意义 (P>0.05)。 具有可比性。
纳入标准:①骤然出现剧烈胸痛、面色苍白、肩胛区疼痛、 晕厥等症状, 经计算机断层扫描血管造影、磁共振及数字减影血管造影检测,确诊为Stanford A 分型主动脉夹层的患者; ②基于病情的严重程度,决定行手术治疗的患者[7]。
排除标准:①送抵该院时已经病发较长时间,错过治疗黄金期,经抢救无效而死亡的患者;②确诊为Stanford B 分型(即Debakey Ⅲ型)主动脉夹层的患者;③合并其他严重心脑血管疾病、肝肾等脏器功能严重受损的患者; ④机体耐受力无法达到主动脉夹层手术要求的患者; ⑤因多种原因导致病历资料完善程度不足的患者(如在该院确诊,但转至其他医院接受手术治疗等);⑥患者或家属明确不得将自身信息用于临床研究的患者[8]。
1.2 方法
①对两组患者的临床资料进行回顾性分析,首先筛选出导致Stanford A 分型主动脉夹层患者术后延迟拔管的影响因素, 之后将影响因素设置为自变量,行多因素Logistic 回归分析,确定导致Stanford A分型主动脉夹层患者术后延迟拔管的独立危险因素。
②根据风险因素评估结果,总结针对Stanford A分型主动脉夹层术后延迟拔管患者的临床优质护理干预方案。
1.3 统计方法
采用SPSS 23.0 统计学软件进行数据分析,符合正态分布的计量资料用()表示,组间比较采用独立样本t 检验;计数资料采用[n(%)]表示,组间比较采用χ2检验,将影响因素设置成自变量后的回归分析方式选择Logistic 回归分析法,P<0.05 为差异有统计学意义。
2 结果
2.1 导致Stanford A 型主动脉夹层患者术后延迟拔管的影响因素初筛结果
延迟拔管组患者的平均插管时间为 (71.83±33.29)h,明显高于未延迟拔管组的(18.47±5.67)h,差异有统计学意义(P<0.05)。患者的 BMI 指数、是否合并高血压、是否合并心包积液、是否合并胸腔积液均非导致延迟拔管的影响因素(P>0.05);延迟拔管组患者的年龄、发病时长、阻断时间、术中输血量、术前镇痛5 项因素均为导致延迟拔管的影响因素 (P<0.05)。 见表 1、表 2。
表1 导致Stanford A 型主动脉夹层患者术后延迟拔管的影响因素初筛结果()Table 1 Preliminary screening results of influence factor leading to delayed extubation in patients with Stanford type A aortic dissection()

表1 导致Stanford A 型主动脉夹层患者术后延迟拔管的影响因素初筛结果()Table 1 Preliminary screening results of influence factor leading to delayed extubation in patients with Stanford type A aortic dissection()
注:发病时长是指从发病开始直至接受手术治疗时的时间间隔;阻断时间是指阻断主动脉血液流动的持续时间
项目 延迟拔管组(n=42)未延迟拔管组(n=38) t 值 P 值年龄(岁)发病时长(h)BMI 指数(kg/m2)阻断时间(min)术中输血量(mL)气管插管时间(h)53.81±11.55 30.16±21.22 25.48±3.66 116.48±23.19 2 285.24±822.85 71.83±33.29 46.58±9.70 15.45±5.02 23.97±4.37 90.58±11.09 1 483.68±538.50 18.47±5.67 3.015 4.167 1.679 6.263 5.097 9.747 0.003<0.001 0.097<0.001<0.001<0.001
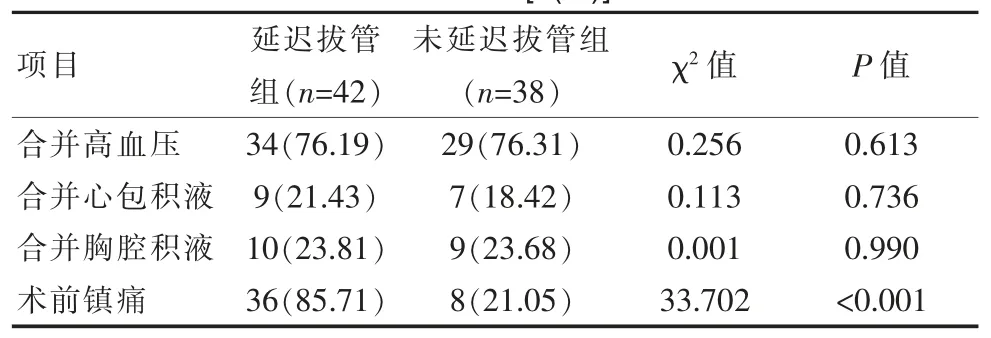
表2 导致Stanford A 型主动脉夹层患者术后延迟拔管的影响因素初筛结果[n(%)]Table 2 Preliminary screening results of influence factor leading to delayed extubation in patients with Stanford type A aortic dissection[n(%)]
2.2 基于影响因素自变量的Logistic 独立危险因素回归分析
年龄、发病时长、阻断时间、术中输血量、术前镇痛5 项因素均为导致Stanford A 型主动脉夹层患者术后延迟拔管的独立危险因素(P<0.05)。 见表3。

表3 基于影响因素自变量的Logistic 独立危险因素回归分析Table 3 Logistic independent influence factor regression analysis based on single risk factor independent variables
3 讨论
患有Standford A 型主动脉夹层疾病,且需接受手术治疗的患者,若术后插管拔管时间延后,表明患者可能出现如下情况: ①患者的思维意识清晰程度不足,生命体征稳定度不足,未恢复呛咳反应、咳痰无力、肌张力较差[10]。 ②无法自主排空口腔分泌物,气管内存在痰液堵塞情况[11]。 ③患者呼吸浅且急促、嘴唇发绀、心率加快、有缺氧及呼吸困难的表现[12]。④有喉头水肿的趋势。出现上述任意一种症状,均说明患者当前不适合拔管[13]。 为探明因何原因导致延迟拔管情况,该研究通过回顾性分析法,基于80 例患者的资料进行比对。最终结果显示:①年龄偏大[延迟拔管组(53.81±11.55)岁,未延迟拔管组(46.58±9.70)岁)]、发病时间更长[延迟拔管组(30.16±21.22)h,未延迟拔管组(15.45±5.02)h]、阻断时间更长[(延迟拔管组(116.48±23.19)min,未延迟拔管组(90.58±11.09)min]、 术中输血剂量更大 [(延迟拔管组(2 285.24±822.85)mL, 未 延 迟 拔 管 组 (1 483.68±538.50)mL]4 项因素均为导致延迟拔管的影响因素,(P<0.05)。 ②将初步筛选出的影响因素设置成自变量,行Logistic 回归分析的结果显示,上述4 项影响因素均为导致延迟拔管的独立危险因素 (P<0.05)。在王爽等[22]的研究中,双方同样设置为延迟拔管组(50 例)与未延迟拔管组(36 例),患者平均年龄、平均阻断时间、 平均术中出血量分别为: 延迟组:(53.64±2.79) 岁 、(183.65±48.79)min、(2 113.65±52.95)mL; 未延迟组:(51.46±2.65) 岁、(152.27±49.65)min、(1 852.27±32.65)mL。 上述 3 项因素均为影响因素,且Logistic 回归分析结果显示,均为独立危险因素。 与该研究结果较一致。 使患者(特别是起病急骤的患者)及早接受治疗,符合现代医学的发展方向[13-14]。
明确导致Stanford A 型主动脉夹层患者术后延迟拔管的独立危险因素之后, 研究组成员经过系统性分析, 最终制订出针对所有Stanford A 型主动脉夹层患者的临床优质护理干预模式,具体如下。
(1)术前护理。 一方面,由医护人员结合入院记录,并参考夹层诊断与治疗指南,总结患者的实际情况,并将之告知医师,作为制订手术方案的依据。另一方面,应根据医师的指导,给予患者对应的药物[15]。
(2)术中护理。护士在手术期间必须严格遵照医师的指导,严丝合缝地完成每一项工作,尽量减少血液制品的使用剂量, 避免患者机体自身免疫功能受到抑制,降低感染发生率[16-17]。此外,术中护理还应包含:①低温麻醉。 通过降低体温的方式,使患者各组织代谢活动频率降低,减少耗氧量,增强对缺氧的耐受性,从而满足阻断凝血循环的需要[18-19]。 ②体外循环,可根据医师指导,选择全身体外循环或左心转流两种方式[20]。③环境设置。 手术室温度应控制在20~25℃,湿度控制在70%。 ④生命体征检测。 自手术开始直至手术完成后的一段时间内, 护士需全程密切监测患者的心率、心律、血压、血氧饱和度,及时识别及预防心律失常。如将心率控制在60~80 次/min。⑤实施循环压力监护,主要为动脉血压监护,连续观察患者的收缩压、舒张压的平均数值。 ⑥呼吸情况。 使用呼吸机时,应检测呼吸频率、潮气量、氧浓度、气道压力、呼吸比、血氧饱和度、呼吸末二氧化碳分压等,记录 1 次/h[21]。 ⑦Stanford A 型主动脉夹层患者易发肺水肿、肺部感染等并发症[22]。
综上所述, 针对Stanford A 型主动脉夹层患者进行围术期护理时,应综合考虑患者的年龄、疾病严重程度, 在尽可能短的时间内完成术前必要的检查及准备工作。 术中阶段,应仔细配合医师,控制输血量、降低数学对肺功能造成的损伤,尽量降低术后出现延迟拔管的概率。
