结直肠癌患者血清5'-核苷酸酶、氧化三甲胺与肿瘤恶性进展和预后的关系
2022-06-21何丽彩苗金鱼刘媛张建锋王春艳王敬然丁秋蕾
何丽彩 苗金鱼 刘媛 张建锋 王春艳 王敬然 丁秋蕾
结直肠癌(colorectal cancer,CRC)是临床上常见的恶性肿瘤之一,其发病率和死亡率分别占恶性肿瘤的第三位和第四位,且呈上升趋势[1-2],严重威胁人类的健康和生命安全。尽管近年来CRC的手术治疗、放化疗及靶向治疗均取得了较大的进展,但患者预后依然欠佳[3-4]。因而探索影响CRC患者预后的相关因素及临床标志物仍是目前研究的热点,已有研究表明在CRC的病理生理改变过程中,相应的标志物在血清中的表达水平会发生异常改变[5]。5'-核苷酸酶(5'-nucleotidase,NT5E)是由哺乳动物的肝细胞、内皮细胞、肠上皮细胞等多种细胞表达的一种糖蛋白,可催化核苷酸去磷酸化,是核苷酸分解代谢的关键酶之一[6]。有研究发现,circNT5E靶向调控miR-506-3p,miR-506-3p表达水平降低逆转沉默circNT5E表达,对CRC细胞的迁移、侵袭和凋亡发挥作用[7]。氧化三甲胺(trimethylamine oxide,TMAO)是一种肠源性菌群的代谢产物,有研究表明肠道菌群的改变通过影响上皮细胞增殖、上皮细胞慢性炎症及免疫系统等参与CRC的病理过程[8-9]。笔者通过测定CRC患者的血清NT5E、TMAO水平,探讨两项单独及联合检测与CRC恶性进展和预后的关系,以期为CRC的临床治疗和预后评估提供参考依据。
1 对象和方法
1.1 对象 选择2014年6月至2016年7月石家庄市人民医院收治的CRC患者150例(CRC组)和良性大肠息肉患者93例(良性息肉组)。CRC组男79例,女 71 例,年龄 27~65(46.36±4.32)岁;结肠癌 61 例,直肠癌89例;肿瘤直径≥5 cm 38例,<5 cm 112例;TNM分期Ⅰ期20例,Ⅱ期61例,Ⅲ期56例,Ⅳ期13例;低分化81例,中分化48例,高分化21例。良性息肉组男 48 例,女 45 例,年龄 25~61(45.93±6.28)岁。纳入标准:(1)CRC组、良性息肉组经病理学检查明确诊断;(2)CRC组、良性息肉组均为初诊病例。排除标准:(1)合并严重心脑血管疾病及肝肾疾病者;(2)有传染病、免疫系统疾病者;(3)近期使用抗菌药物或免疫抑制剂者。选择同期在本院健康体检者93例作为健康对照组,男 47 例,女 46 例,年龄 22~60(45.27±6.49)岁。3组对象性别、年龄比较差异均无统计学意义(均P>0.05)。本研究经石家庄市人民医院医学伦理委员会批准(伦理批准号:201403-21),所有对象均知情同意。
1.2 方法 CRC组、良性息肉组于入院后第2天、健康对照组于体检当天早晨空腹抽取外周静脉血5 ml,于0.5 h内在3 000 r/min下离心10 min,离心半径10 cm,分离并留取血清置于EP管,保存于-80℃恒温冰箱待测。
1.3 血清NT5E水平检测 采用夹心法酶联免疫吸附试验检测血清NT5E水平。采用NT5E试剂盒(上海瑞番生物科技有限公司,规格:96T,批号:20140612),严格按照试剂盒说明书操作。将试剂盒从冷藏环境中取出在室温下平衡15~30 min,计算检测样本所需酶标条;用标准洗涤缓冲液300 μl洗涤酶标板(上海晶安生物科技有限公司,96孔全白板)3次并拍干,加入标准品和样本,100 μl/孔,15 min内完成点样,室温下孵育2 h;去除孔中液体后加入标准洗涤缓冲液300 μl洗板3次并拍干酶标板;加入预先配制好的检测抗体加入酶标板,100 μl/孔,混匀后再室温下孵育 1 h;去除孔中液体后加入标准洗涤缓冲液300 μl洗板3次并拍干酶标板;将预先配制好的显色液加入酶标板,200 μl/孔,混匀后室温避光孵育 20 min,加入 50 μl/孔终止液,轻轻晃动至酶标板显色均匀,20 min内读取450 nm处的吸光度值,绘制标准曲线计算样本血清NT5E水平。
1.4 血清TMAO水平检测 采用稳定同位素稀释液相色谱质谱联用技术(ID-LC-MS)检测血清TMAO水平。采用Agilent6410型质谱仪(美国安捷伦科技公司)和Agilent1260型快速高分离液相色谱(美国安捷伦科技公司)。溶液配制:(1)混合血清:将分离出来EP管内的血清取2 ml,混匀后保存备用。(2)标准应用液:用超纯净水将0.003 8 g的TMAO配制成10 mmol/L的标准储备液,保存于-20℃冰箱备用;检测前用PBS 10倍稀释的混合血清配制成不同浓度的标准应用液。(3)除蛋白液:将超纯净水加入5 mg的d9-TMAO试剂(仪器的配套试剂)中配制成100 mmol/L的内标储备液,保存于-20℃冰箱备用;使用时用乙腈将储备液稀释为10 μmol/L的内标应用液。(4)流动相:精确称取适量甲酸铵,用超纯净水配制成10 mmol/L的甲酸铵溶液,采用甲酸将pH值调至3.0,超声脱气处理。取30 μl血清或标准应用液,加入3倍体积的除蛋白液,混匀后在4℃下以13 200 r/min离心15 min,取上清液转移至密封的进样瓶后上机检测。色谱质谱条件:固定相为Ultimate SiO2column;流动相为:乙腈∶甲酸铵=70%∶30%(v/v),等度洗脱;流速:0.4 ml/min;进样量:5 μl;柱温:30 ℃;离子源:电喷雾离子源;母离子:76.1 emu;定性离子对:42.0 emu;定量离子对:58.1 emu;去簇电压:40 V;干燥气温度:300℃;扫描方式:多反应监测模式;雾化气流速:8 L/min;碰撞能量:9 eV。
1.5 随访及生存资料分析[10]所有CRC患者出院后按计划进行随访,随访方式包括回院复查和电话随访。电话随访:出院后第1年每月电话回访1次,之后每3个月回访1次。回院复查:出院后第1年每3个月回院复查1次,之后每6个月回院复查1次。随访截止时间为2021年7月。采用ROC曲线计算血清NT5E、TMAO水平对CRC患者预后的预测阈值,根据阈值分为高表达组和低表达组,分析血清NT5E、TMAO高/低表达患者预后的差异。
1.6 统计学处理 采用SPSS 23.0统计软件。计量资料以表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;计数资料用率(%)表示,组间比较采用χ2检验。采用Kaplan-Meier生存曲线分析血清NT5E、TMAO高/低表达CRC患者的生存情况,生存率比较采用log-rank检验;采用ROC曲线分析血清NT5E联合TMAO预测CRC患者死亡的预测效能。P<0.05为差异有统计学意义。
2 结果
2.1 3组 对象血清NT5E、TMAO水平的比较 CRC组血清NT5E、TMAO水平高于良性息肉组、健康对照组,良性息肉组高于健康对照组,差异均有统计学意义(均 P<0.05),见表1。
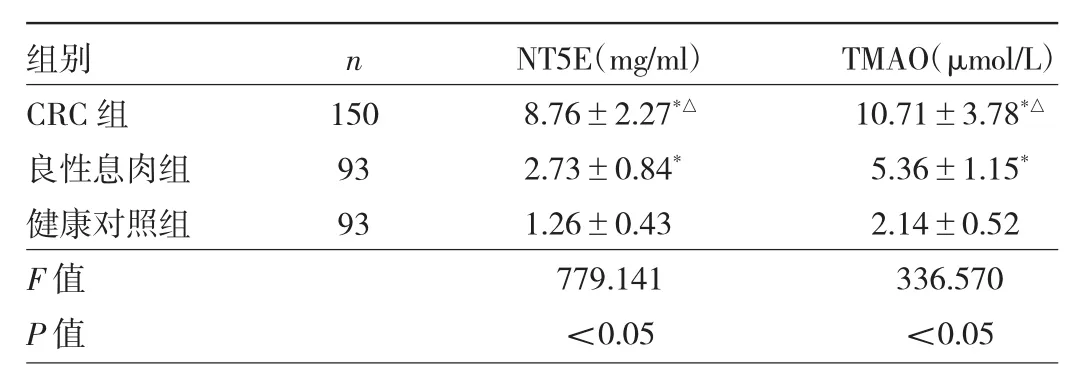
表1 3组对象血清NT5E、TMAO水平的比较
2.2 血清NT5E、TMAO水平与CRC患者临床特征的关系 血清NT5E、TMAO水平与CRC患者性别、年龄、肿瘤位置、病理类型、肿瘤直径均无关(均P>0.05)。分化程度越低、TNM分期越高的CRC患者血清NT5E、TMAO 水平越高(均 P<0.05),见表2。

表2 血清NT5E、TMAO水平与CRC患者临床特征的关系
2.3 血清NT5E、TMAO高/低表达CRC患者预后的比较 随访5年,150例CRC患者中失访4例,不纳入统计分析。CRC患者5年生存率为70.6%(103/146)。NT5E阈值为8 mg/ml,NT5E高表达组为79例,NT5E低表达组为67例。血清NT5E高表达组5年生存率为60.8%(48/79),低于低表达组的 82.1%(55/67),经log-rank 检验,差异有统计学意义(χ2=8.089,P<0.05),见图1。TMAO阈值为10 μmol/L,TMAO高表达组为76例,TMAO低表达组为70例,血清TMAO高表达组5年生存率为60.5%(46/76),低于低表达组的81.4%(57/70),经log-rank检验,差异有统计学意义(χ2=12.290,P<0.05),见图2。

图1 血清NT5E高/低表达CRC患者Kaplan-Meier生存曲线
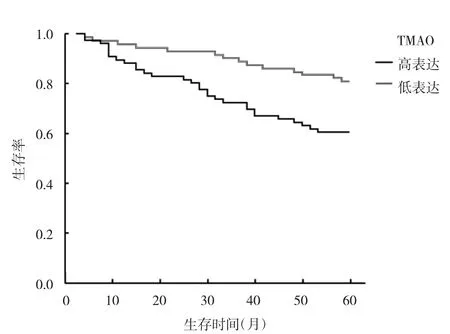
图2 血清TMAO高/低表达CRC患者Kaplan-Meier生存曲线
2.4 血清NT5E、TMAO单独及联合检测对CRC患者死亡的预测效能 进一步探讨血清NT5E联合TMAO检测对CRC患者死亡的预测效能:以43例死亡患者为阳性样本,以103例生存患者为阴性样本,建立ROC诊断分析模型。结果显示,两指标联合检测时的AUC高于两指标单独检测,预测效能较高(表3),ROC曲线见图3。

表3 血清NT5E、TMAO单独及联合检测对CRC患者死亡的预测效能

图3 血清NT5E、TMAO单独及联合检测预测CRC患者死亡的ROC曲线
3 讨论
近年来,随着我国经济社会的发展,人们的生活方式、饮食习惯及我国人口年龄结构都发生了巨大的变化,我国CRC的发病率呈上升趋势,而在世界范围内,CRC已成为继肺癌和乳腺癌之后严重危害人类健康的第三大常见恶性肿瘤[11-12]。目前对于CRC的治疗方式包括外科治疗、放射治疗、化学治疗及免疫治疗,其中外科手术切除是根治CRC的首推方法[13],无论何种治疗方法,肿瘤恶性程度仍是影响CRC预后的关键因素[14]。目前临床上对CRC的恶性程度判断、预后评估主要依赖于结肠镜检查和组织学病理检查,虽然检查效果较理想,但其有创性给患者带来巨大的困扰。随着肿瘤标志物的深入研究,血清学指标检测越来越受到广大医护人员及患者的青睐,因而探寻可以有效预测CRC恶性程度和预后的肿瘤标志物具有重要的临床实际意义。近年来有研究发现,胆囊癌细胞中外源性表达NT5E可以部分逆转miR-30b和miR-340对细胞增殖、侵袭和迁移的抑制作用[15]。Bin等[16]发现在直肠腺癌组织中CD73(NT5E)的表达水平高于癌旁组织。Apsb等[17]研究表明,甲状腺乳头状癌患者NT5E活性升高,其表达与转移淋巴结有关。另有研究显示,NT5E通过调节SYNCRIP的表达参与了胰腺癌的进展过程,其表达水平与胰腺癌的不良预后有关[18]。有研究表明肠道细菌的改变与CRC的发生具有相关性,而TMAO是目前研究最为广泛的肠道菌群代谢产物之一[19-20]。赵雨等[21]研究显示,TMAO可能通过激活PI3K/AKT/mTOR信号通路促进细胞的增殖。包莹等[22]研究显示,Wnt/β-catenin、HGF/c-MET、PI3K/Akt/Mtor、RAS-ERK/TGF-β/SMAD等信号通路及相关基因均参与了CRC转移的过程。综合分析可知,TMAO的作用机制与CRC病理改变存在共同的信号通路。因此笔者推测,NT5E、TMAO可能与CRC恶性进展有密切关系,检测血清NT5E、TMAO水平对CRC患者死亡可能具有一定的预测价值。
本研究结果显示,血清NT5E、TMAO水平CRC组高于良性息肉组,良性息肉组高于健康对照组,且其水平与临床分期、分化程度有关,TNM分期越高、分化程度越低的CRC患者,其血清NT5E、TMAO水平越高。这提示CRC患者血清NT5E、TMAO水平异常升高,且水平与肿瘤恶性程度有关,NT5E、TMAO可能参与了CRC的病理改变过程。CRC患者血清NT5E、TMAO水平异常升高的原因可能是:首先,NT5E基因的启动因子至少有一个缺血诱导因子1α,因而肿瘤微环境中的缺氧状态可促进肿瘤细胞中血清NT5E水平上调[23];其次,转录因子的甲基化可明显下调NT5E的表达[24],而癌细胞中NT5E甲基化缺失,因而导致其表达水平异常升高。而TMAO作为肠道菌群代谢产物之一,CRC患者肠道菌群失调导致TMAO水平异常升高。本研究中采用Kaplan-Meier生存曲线分析显示,血清NT5E、TMAO高表达组5年生存率低于低表达组,提示血清NT5E、TMAO水平与CRC患者生存期有密切关系,低水平表达NT5E、TMAO的CRC患者其治疗后生存期越长,预后越良好。其原因可能是:NT5E可水解生成腺苷,NT5E水平升高导致腺苷含量增加,刺激了癌细胞生长及抑制了机体对恶性肿瘤的免疫应答,并通过腺苷的A2a受体促使内皮细胞增殖[23],而TMAO水平升高激活了PI3K/AKT/mTOR信号通路[21],增强了癌细胞的增殖、转移能力从而影响患者的生存期。本研究显示,血清NT5E联合TMAO检测预测CRC患者生存的AUC为0.836,灵敏度和特异度也都在0.8以上,提示血清NT5E联合TMAO检测可作为预测CRC治疗后生存期的敏感性指标。王奇龙等[25]研究显示,血清CEA、CA19-9、CA242单独预测CRC患者术后转移的AUC分别为0.799、0.678、0.750。可见,本研究中血清NT5E联合TMAO检测预测CRC患者生存的效能优于血清肿瘤标志物,但仍需要后续大样本量的研究进行验证。
综上所述,血清NT5E、TMAO水平与CRC患者肿瘤恶性进展及预后有关,血清NT5E、TMAO有望成为辅助评估CRC预后的指标。
