新型二维纳米材料Ti3C2/Co的抗菌及生物安全性研究
2022-06-20郑云飞贾绮林张斐然
周 璇, 郑云飞, 贾绮林, 张斐然
(北京大学 口腔医院, 北京 100081)
细菌作为一种导致医源性污染的重要生物因素,如何有效控制及消除细菌污染备受研究人员注意。相较于传统的有机抗菌剂,无机抗菌剂具有缓释长效性、不产生耐药性、广谱抗菌性等优势[1]。随着纳米技术的发展,二维层状纳米抗菌材料在医疗器械方面的应用逐渐成为研究热点[2-3]。二维层状纳米材料由于其独特的空间结构具有对单细胞微生物(细菌、真菌等)杀伤力强而对多细胞生物安全性高的特点[4],因而可以作为抗菌剂的理想选择。此类纳米材料可制备成抗菌涂层应用于医疗导管、手术器械及伤口敷料中[4-6]。
二维层状纳米材料是指在某一维度的厚度为0.1~100 nm,而在另一维度上可以无限延伸的材料[7],其结构上的特殊性可以通过纳米刀效应刺穿细菌胞膜而杀死细菌[8]。此外新型二维纳米材料具有高效光催化活性,在光照下可以产生活性氧自由基和释放热量,达到光动力和光热灭菌效果[9-12]。目前用于抗菌研究的二维纳米材料包括石墨烯、层状双氢氧化物、黑磷、过渡金属硫化物以及Mxenes等[13],Ti3C2属于Mxenes中的一种。近年来有研究表明不同化学计量比的MXene抑菌能力具有较大差异,Ti3C2Tx MXene可以有效抑制细菌的生长,但是Ti2CTx MXene却没有抑菌能力[14]。本研究中使用Ti3C2/Co作为二维纳米抗菌材料,主要基于几方面的考虑:(1)Co元素可以与MXene表面的极性基团(—OH,—O)螯合形成Co-MXene复合物[15]。由于钴纳米线(CoNWs)是一维几何结构,在光辐射下可以为光电子提供直线传输通道。通过高效快速的光电子传输,Ti3C2/Co复合纳米材料具有比Ti3C2纳米片更优异的光热性能[16]。(2)钴纳米线(CoNWs)赋予Ti3C2/Co复合纳米材料可控的磁性性能[17],为材料循环可重复利用提供可能。(3)与其他金属纳米线(如ZnNWs,CuNWs等)相比,CoNWs合成条件简单,且不依赖于昂贵的大型仪器,简单易得,可实现大量生产[18]。也有研究表明经近红外光照射后的Ti3C2/Co复合纳米材料产生了更强的光热效应,显示出比Ti3C2纳米片更强有效的抗菌效果[19]。
由于MXenes特有的结构及光学特性、良好的生物安全性,目前已被用于癌症治疗研究中[20]。有研究表明Ti3C2/Co纳米复合物可以作为抗癌药物载体,抑制肿瘤的生长。其原理是通过化学-光热协同作用杀死癌细胞和消融肿瘤组织[15]。但目前为止尚未发现有关Ti3C2/Co复合纳米材料同时在抗菌活性和生物安全性两方面的研究,本文以Ti3AlC2作为母体合成Ti3C2二维纳米材料,并进一步合成Ti3C2/Co复合纳米材料。以大肠杆菌作为试验菌种研究此材料的抗菌活性及抗菌机制,同时进一步验证它的生物安全性,由此拓展此材料在抗菌领域的应用。
1 材料与方法
1.1 材料
Ti3C2/Co复合纳米材料由四川大学化学工程学院提供;大肠杆菌(ATCC 8739)菌株来自美国菌种保存库(ATCC);脐静脉内皮细胞购自武汉普诺塞生命科技有限公司。
1.2 方法
1.2.1 Ti3C2/Co纳米材料的合成及检测
使用氢氟酸(HF)水溶液作为蚀刻剂,从Ti3AlC2MAX相中除去Al同时在MXene片层表面形成Tx端基,进一步进行超声分层,从而获得单层或很少层的Ti3C2Tx。在反应条件为pH≈14、温度为75 ℃,磁场强度为70 mT下将EDTA-2Na和CoCl2·6H2O溶解于DI H2O中;然后再将N2H4·H2O和H2PtCl6·6H2O注入混合物中以获得CoNWs。最后将Ti3C2与CoNWs以2∶1的比例在冰浴中超声处理0.5 h,获得Ti3C2/CoNWs溶液。冷冻干燥成粉末后在扫描电镜下观察Ti3C2及Ti3C2/Co纳米材料的微观结构。
为检测材料的磁性性能,将其置于PBS溶剂中,分别于1、3、5和7 d将磁石置于溶液一侧,观察并拍照磁石对材料的吸附能力。
1.2.2 Ti3C2/Co纳米材料的抗菌性能检测
细菌培养:将冻存于-80 ℃的大肠杆菌(ATCC 8739)菌株取出后快速解冻,并在无菌条件下通过平板划线法接种于LB培养基。24 h后挑取单个菌落,接种于装有10 mL LB液体培养基的无菌试管中。有氧条件下37 ℃恒温摇床中培养增菌至对数生长期后将菌液离心(2 000 r/min,5 min);倒去上清液后使用生理盐水洗涤、离心3次;用1 mL PBS液将沉淀的菌株吹打悬浮;最后以无菌LB培养基调整细菌浓度为1×106CFU/mL备用。
标准平板计数试验:取浓度为1×106CFU/mL的大肠杆菌细菌悬液与PBS液或不同浓度的Ti3C2/Co纳米材料等体积混合于EP管中。试验分为4个大组,分别为空白对照组(PBS液)、光照组、不同浓度(50、150、250 μg/mL)的Ti3C2/Co纳米材料处理组、Ti3C2/Co纳米材料+光照组。其中激光参数设置成波长为808 nm,光照功率为118 mW,照射时间为10 min。各组置于37 ℃恒温摇床中孵育8 h。孵育结束后,将各组稀释一定倍数,取100 μL均匀涂布于相应的固体培养基,放入培养箱中孵育过夜。取出培养板拍照,同时进行菌落计数。细菌存活率=1-(n-n1/n),式中对照组活菌数为n,实验组活菌数为n1。
激光共聚焦显微镜观察:取浓度为1×106CFU/mL的大肠杆菌细菌悬液与PBS液或一定浓度的Ti3C2/Co纳米材料等体积混合于EP管中,对应反应条件分别为空白对照组(PBS液)、光照组、150 μg/mL的Ti3C2/Co纳米材料组、Ti3C2/Co纳米材料+光照组。各组置于37 ℃恒温摇床中孵育8 h。孵育结束后,离心洗涤,加入Live/Dead染色液染色。该染色液中包含SYTO9和PI两种染料,染色后避光孵育15 min,取5 μL滴在载玻片上。然后用激光共聚焦显微镜进行观察并拍照。其中红色荧光的激发和发射波长为510、640 nm,绿色荧光的激发和发射波长为480、520 nm。
扫描电子显微镜表征:取浓度为1×106CFU/mL的大肠杆菌细菌悬液与PBS液或一定浓度的Ti3C2/Co纳米材料等体积混合于EP管中,对应反应条件分别为空白对照组(PBS液)、光照组、150 μg/mL的Ti3C2/Co纳米材料组、Ti3C2/Co纳米材料+光照组。各组置于37 ℃恒温摇床中孵育8 h。孵育结束后,离心洗涤,去除上清液,将沉淀的细菌用戊二醛溶液充分混匀后固定,于4 ℃冰箱过夜放置。然后用50%、75%、90%、100%的乙醇溶液由低浓度到高浓度分别脱水处理15~20 min,最后将菌株重悬于无水乙醇中,滴在硅片上进行干燥,使用扫描电子显微镜对细菌的表面形态进行观察。
1.2.3 Ti3C2/Co纳米材料的生物相容性检测
溶血实验:取正常健康人的新鲜血液用PBS溶液稀释成4%的悬浮液,然后将其与PBS液或不同浓度的Ti3C2/Co纳米材料等体积混合于EP管中,对应反应条件分别为阴性对照组(PBS液)、不同浓度(50、150、250、350 μg/mL)的Ti3C2/Co纳米材料+光照组、阳性对照组(triton-X)。各组置于37 ℃恒温孵箱中孵育8 h。孵育结束后离心(2 000 r/min,5 min),收集离心后的上清液并测量其在570 nm处的吸光度。溶血率=[OD570(实验组)-OD570(阴性对照)]/[OD570(阳性对照)-OD570(阴性对照)]。
细胞培养:选用6~8代间的脐静脉内皮细胞作为实验细胞来评价材料对细胞的影响。脐静脉内皮细胞选用专用血管内皮细胞培养基,在37 ℃、体积分数为5%的CO2和95%空气的细胞孵箱中培养细胞,每2 d更换一次培养基。
细胞毒性实验:将脐静脉内皮细胞接种至96孔板中,每孔细胞的密度约为1×104个/mL。各组孔板对应反应条件分别为空白对照组(专用血管内皮细胞培养基)、光照组、含有不同浓度(50、150、250、350 μg/mL)的Ti3C2/Co纳米材料培养基组、Ti3C2/Co纳米材料+光照组。各组置于37 ℃恒温孵箱中培养24 h后用PBS液洗涤,加入含有cck8的培养基孵育2 h,通过酶标仪读取每个孔板在450 nm处的吸光度。
细胞迁移实验:将脐静脉内皮细胞接种至6孔板中,每孔细胞的密度约为4×105个/mL。置于37 ℃恒温孵箱中培养,待细胞铺满孔板后进行划痕,用PBS溶液洗细胞3次以去除划下的细胞。并在此时在倒置显微镜下进行观察、拍照。然后再进行分组,各组孔板对应反应条件分别为空白对照组(无血清培养基)、含有不同浓度(50、150、250、350 μg/mL)的Ti3C2/Co纳米材料无血清培养基+光照组。各组置于37 ℃恒温孵箱中培养12 h后再次于倒置显微镜下观察各组细胞迁移情况并拍照。
1.2.4 统计学分析
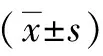
2 结果与分析
2.1 Ti3C2/Co纳米材料合成前后的表面形态
图1和图2分别为Ti3C2及Ti3C2/Co复合纳米材料在扫描电镜下观察的微观结构形态。可观察到Ti3C2及Ti3C2/Co复合纳米材料均成明显的片层状散在分布。材料的厚度仅为纳米级别,而在其他维度上则任意延伸。图3可以观察到由于磁性元素钴的加入,Ti3C2/Co复合纳米材料在一周内均展现出稳定的磁吸附性能。

图1 Ti3C2扫描电镜图像

图2 Ti3C2/Co纳米材料的扫描电镜图像

图3 Ti3C2/Co纳米材料在PBS溶液中存放7 d的磁性性能
2.2 Ti3C2/Co纳米材料的抗菌性能
图4为标准平板计数法观察到的各组材料与细菌共孵育后琼脂平板上的菌落形成单位。通过定性(图4)和定量(图5)的结果看出,Ti3C2/Co纳米材料具有显著的杀菌效果,且其杀菌性能随着材料浓度的增加而显著增加,在近红外光照射下材料的杀菌性能进一步提升。在材料浓度为50 μg/mL时,细菌的存活率与对照组相比降低了25%,两组的细菌存活率有着显著的统计学差异(P<0.05);在材料浓度为150 μg/mL时,实验组与对照组的细菌存活率有着极显著的统计学差异(P<0.001);在材料浓度为250 μg/mL合并近红外光照射时,杀菌率达到100%。
* P<0.05;*** P<0.001。
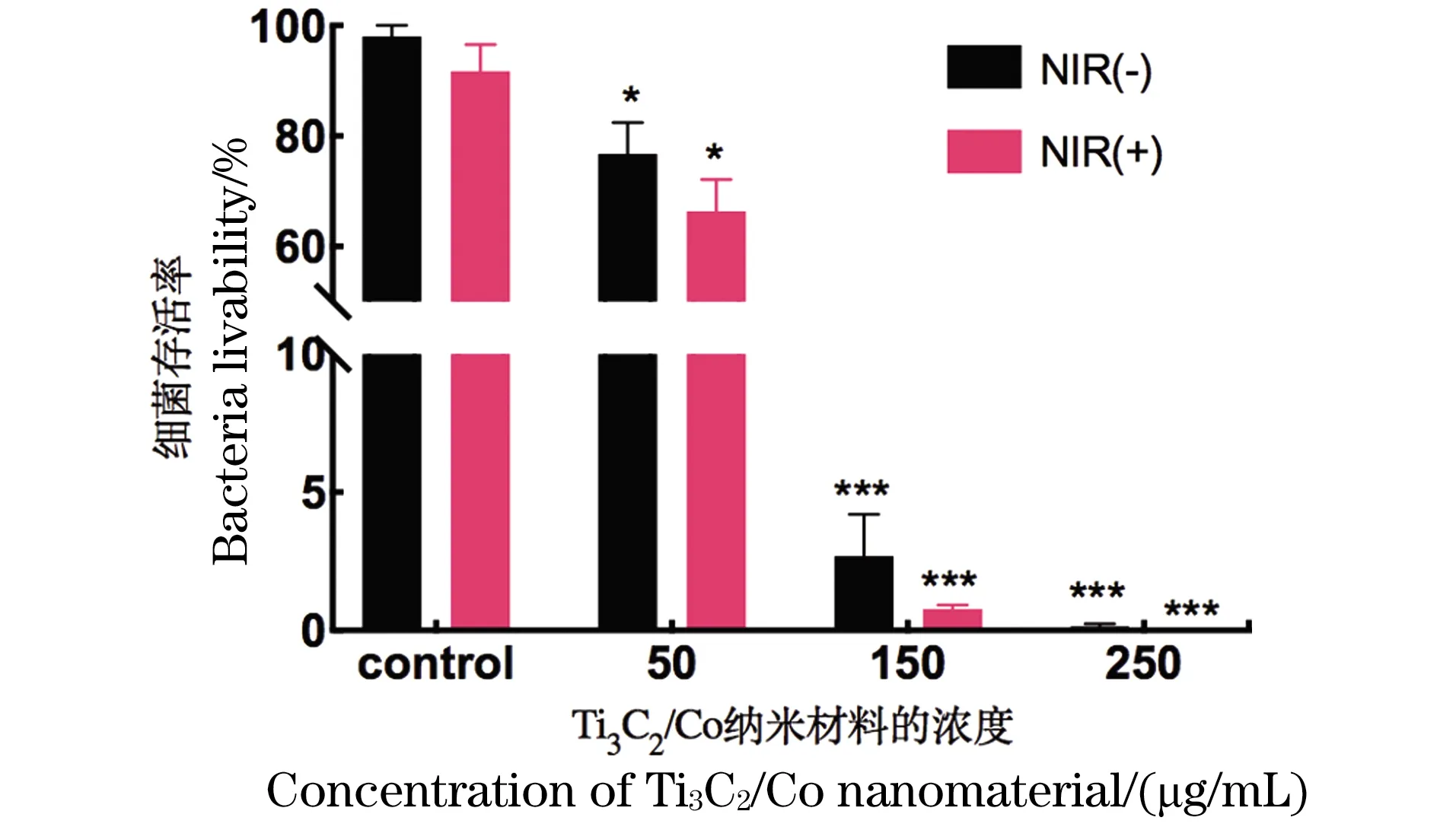
在激光共聚焦显微镜下绿色代表活细菌,红色代表已经死亡的细菌(图6)。如图6所示,对照组呈现99%以上的活细菌,单纯光照组也仅呈现了少数的红色荧光,Ti3C2/Co纳米材料处理组中红色荧光明显增多,而Ti3C2/Co纳米材料结合光照组呈现最多的红色荧光,展现出最强的杀菌活性。
(a)对照组;(b)光照组;(c)Ti3C2/Co;(d)Ti3C2/Co+光照组。标尺:10 μm。
细菌形态分析:在扫描电子显微镜下可以观察到大肠杆菌呈典型的棒状结构,对照组中大肠杆菌的细胞表面较为光滑,但在Ti3C2/Co纳米材料组尤其是在材料结合光照组中大肠杆菌表面明显起皱、凹陷,说明细菌的细胞壁在Ti3C2/Co纳米材料与近红外光光照的共同作用下受到了明显的损伤(图7)。

(a)对照组;(b)光照组;(c)Ti3C2/Co;(d)Ti3C2/Co+光照组。标尺:1 μm。
2.3 Ti3C2/Co复合纳米材料的生物安全性实验
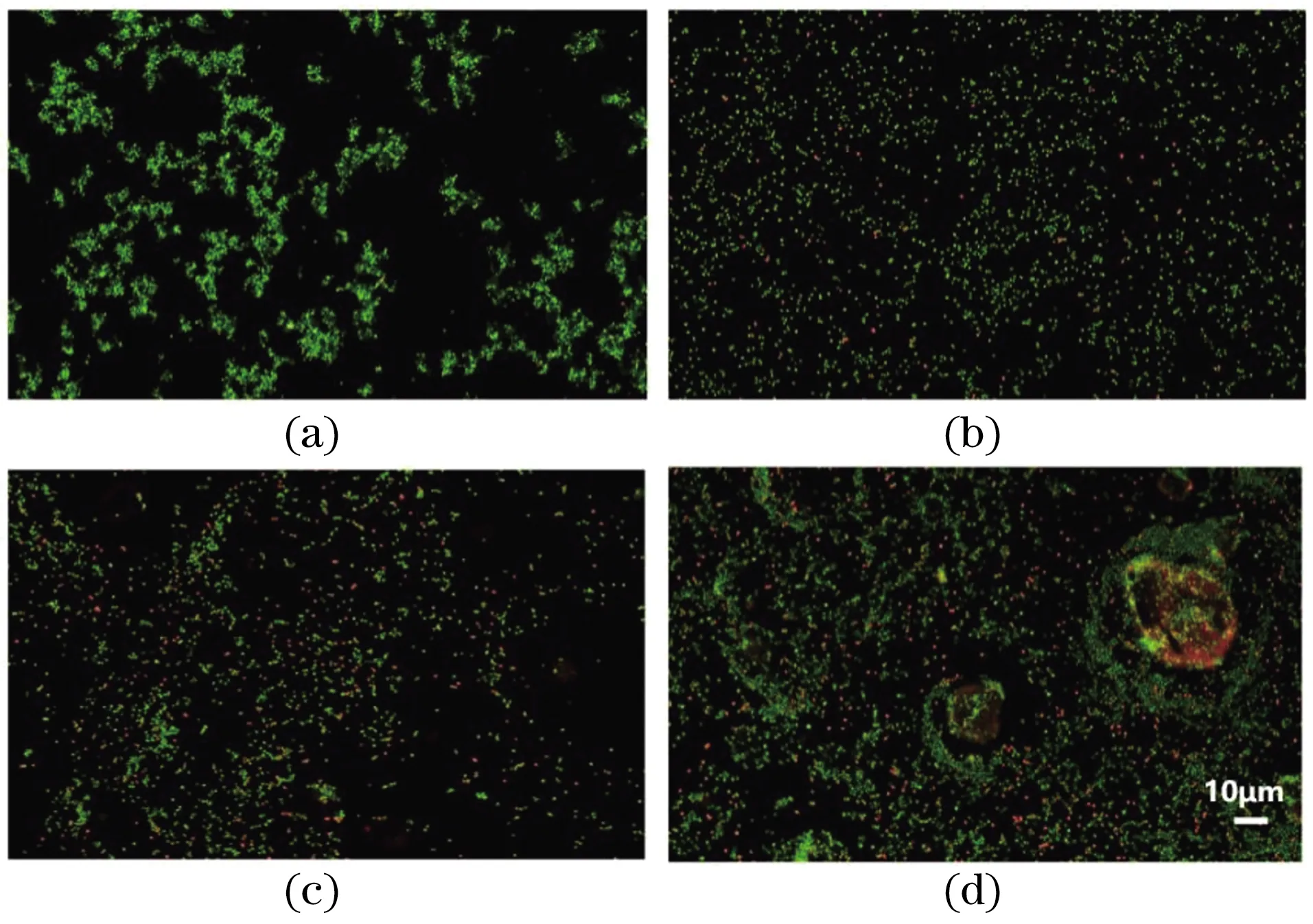
溶血会阻碍抗菌材料的实际应用,因此我们研究了Ti3C2/Co纳米材料对血液中红细胞的生物安全性。图8表明,Ti3C2/Co纳米材料对血红细胞不会产生破坏作用,即使达到最高浓度350 μg/mL时,对红细胞的破坏仍可以忽略不计,在545 nm下测量吸光度时发现各实验组与阴性对照组之间无统计学差异。因此可以认为Ti3C2/Co纳米材料对血液具有相对安全性。
图8 不同浓度的Ti3C2 /Co纳米材料的溶血反应
为了验证Ti3C2/Co纳米材料对细胞增殖活性的影响,通过cck8增殖实验表明,高浓度(350 μg/mL)的Ti3C2/Co显示出对脐静脉内皮细胞具有一定的毒性作用,且与对照组相比有着显著的统计学差异(P<0.05),而当材料浓度低于或等于250 μg/mL时,则表现出轻微的促进增殖的效果,但无显著的统计学差异(图9)。
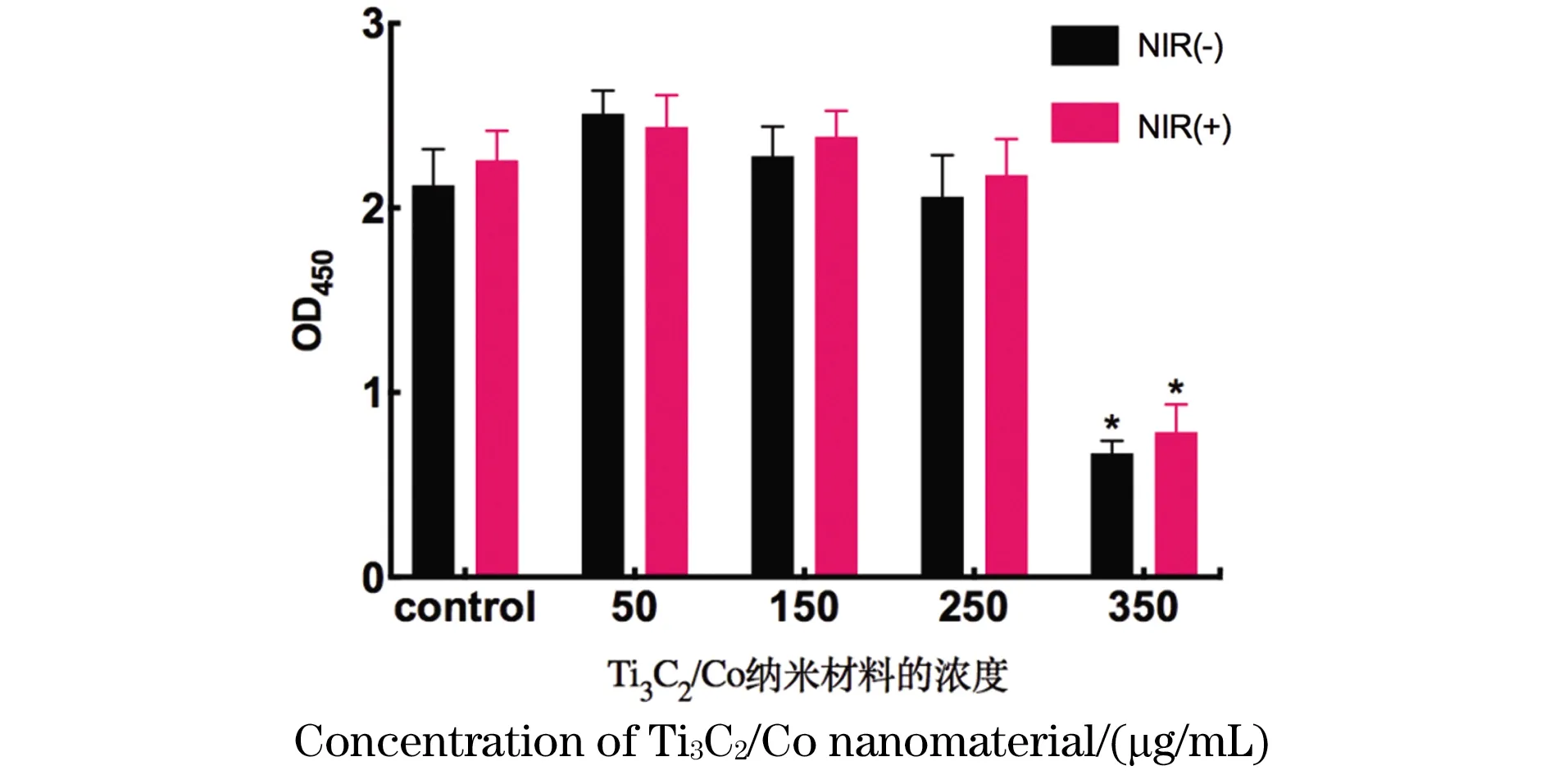
* P<0.05。
进一步验证Ti3C2/Co纳米材料对脐静脉内皮细胞迁移活性的影响。如图10和图11显示,脐静脉内皮细胞具有良好的迁移能力,12 h后各组划痕均有显著缩窄,Ti3C2/Co纳米材料对脐静脉内皮细胞的迁移未见抑制作用,且在低浓度时表现出轻微的促进其迁移的效果,但无显著的统计学差异。
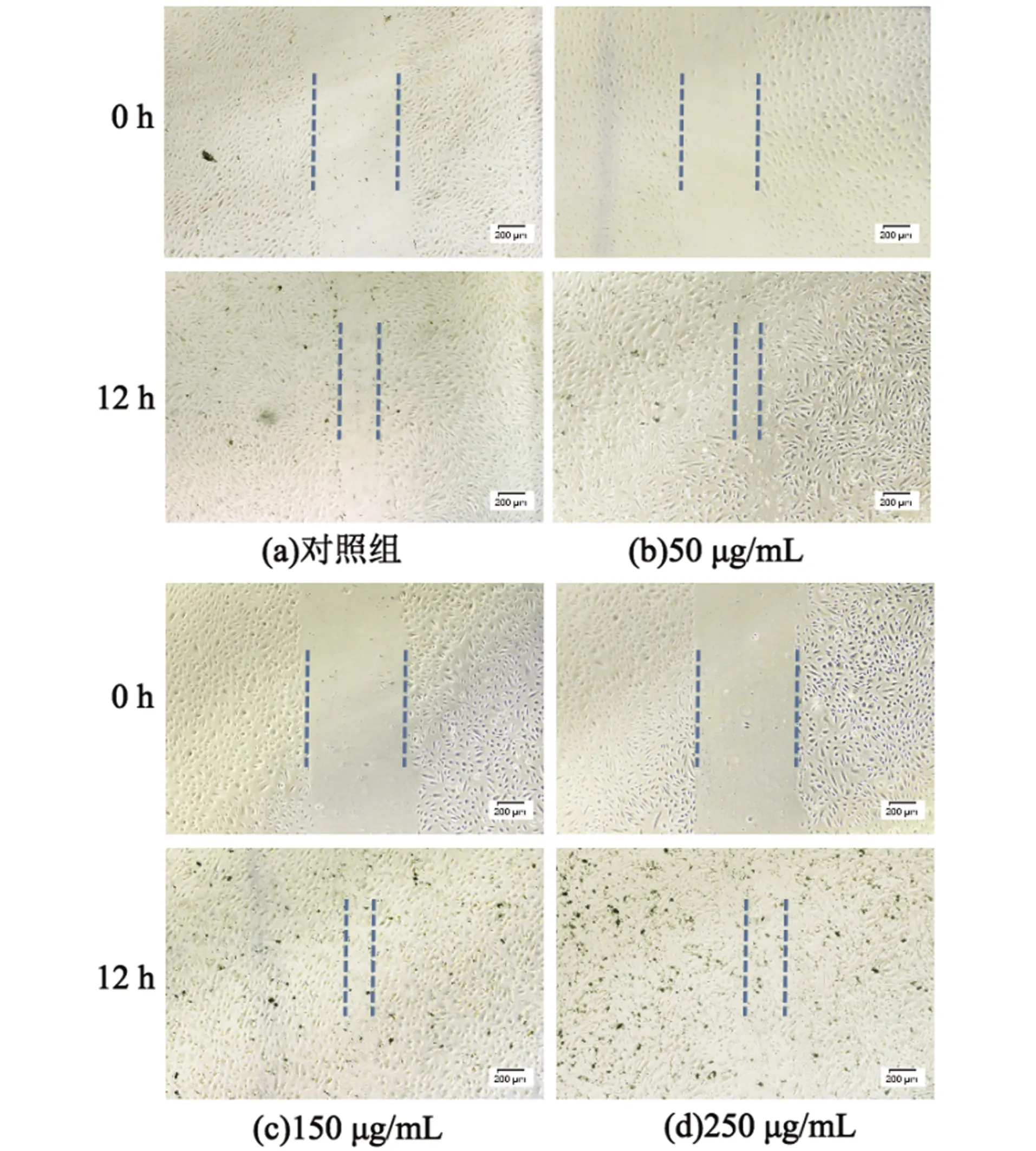
图10 Ti3C2/Co纳米材料与脐静脉内皮细胞培养时的迁移速度
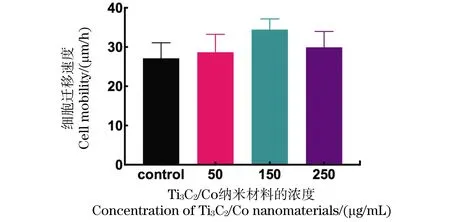
图11 Ti3C2/Co纳米材料与脐静脉内皮细胞培养时各组迁移速度的定量结果
3 结论
(1)Ti3C2/Co纳米材料具有良好的杀菌性能,在近红外光照射的辅助下材料的杀菌性能进一步提升。在250 μg/mL浓度结合近红外光照射时其杀菌率可达到100%。其抗菌机制主要包括材料特殊的二维结构会产生类似于纳米刀的效果刺破细胞壁,同时材料的光动力和光热效应也对细菌的细胞壁产生损伤作用。
(2)Ti3C2/Co纳米材料在一定浓度范围内具有良好的生物相容性,对细胞的增殖及迁移能力均未表现出抑制作用,且对血液亦具有良好的生物安全性,但在较高浓度下表现出了一定的细胞毒性。本研究认为钴元素的加入一方面使材料具有了高效的磁性性能,为材料循环可重复利用提供可能;另一方面相较于Ti3C2纳米材料,其抗菌性能也有了明显的提升;但是可能会使材料的细胞相容性下降。
(3)Ti3C2/Co纳米材料由于具有良好的杀菌性能以及生物安全性,可以制成抗菌涂层,应用于医疗导管、手术器械及防菌纱布中。
