密闭空间内氢气和二氧化碳甲醇化系统的非均相模型及反应特性
2022-06-20尹永利刘晓天杨才华
熊 凯 尹永利 曹 勇 刘晓天 杨才华
1(哈尔滨工业大学(深圳)机电工程与自动化学院 深圳 518055)
2(深圳市绿航星际太空科技研究院 深圳 518117)
3(中国航天员科研训练中心 人因工程重点实验室 北京 100094)
0 引言
随着人类空间探索活动的深入,适宜人类在空间中生存的载人密闭空间装备得到了极大的发展,较为典型的载人密闭空间包括飞船[1]、空间站[2]和火星基地[3]等。维持密闭空间内大气环境始终处于适宜人体生存状态对于保障航天员的生命健康安全具有重要意义。当前在密闭空间内主要采用电解水方式为乘员提供呼吸用氧[4],电解水在产生高纯度氧气(O2)的同时会带来副产物氢气(H2)。在密闭空间内H2是一种危险性气体,存在燃烧甚至爆炸的安全隐患,需要以合理的方式给予消除。此外,乘员呼吸消耗氧气的同时生成二氧化碳(CO2),如果密闭空间内CO2不能及时排出将导致其含量越来越高,高浓度的CO2会使乘员出现呼吸气短、胸闷头痛、恶心欲吐、困倦思睡等一系列不适症状,严重威胁乘员的生命健康[5]。合理消除载人密闭空间内富余的H2和CO2对维护其内部大气平衡及保障乘员的生命健康具有重要意义。传统的消除载人密闭空间内富余H2和CO2的方法是利用Sabatier 反应器将其催化合成甲烷,虽然该方法能同时消除H2和CO2,但是需要采用大体积的容器高压存储其产物甲烷,耗费大量能量且占据巨大的空间,其经济性有待提高[6]。将气态H2和CO2催化合成液态甲醇不需要大体积容器来保存产物,可以节省空间,同时减少了压缩机做功及能量消耗,能够更长时间维持载人密闭空间中的大气平衡,对于长航时的密闭载人空间具有显著优势[7]。
在载人密闭空间内乘员的作息变化会使得富余的H2和CO2随之不断变化,为保持密闭空间内的大气平衡,需要不断调节H2和CO2甲醇化系统的反应状态参数,使其匹配不同工况下H2和CO2的消除需求。对反应过程有重大影响的反应状态参数主要有反应压力、温度及反应物比例等。然而,当前针对H2和CO2甲醇化系统的反应特性随反应状态参数变化规律的相关研究比较缺失,不能对调控过程形成指导。目前的研究主要集中在催化剂特性研究和反应机理研究方面,例如Wang 等[8]和Xiao 等[9]分别研究了不同催化剂对H2和CO2合成甲醇(CH3OH)反应过程的影响;Seidel 等[10]和Graaf 等[11]研究了H2和CO2合成甲醇的反应机理,并建立相应的反应机理模型;Manenti 等[12]和Shahrokhi 等[13]对H2和CO2合成甲醇在固定床反应器中的反应过程进行了研究。以上研究均不能显示各反应状态参数对反应过程中反应速率、甲醇产率和温度的变化规律,无法对反应过程的控制形成指导。此外,温度是反应过程中重要的参数,过高和过低的温度对反应过程都有重大影响,准确的温度建模是对反应过程研究的必要条件。然而现有研究[12,13]针对H2和CO2甲醇化系统中温度特性的研究主要采用均相模型,即认为在反应器中穿过催化剂的反应气体与催化剂温度一致,不能真实展示催化剂和反应气体的温度变化,给反应过程的准确分析带来了困难。因此,迫切需要建立准确的H2和CO2温度分析模型,以得到其准确的温度变化规律。
本文采用微元法建立了催化剂和反应气体的温度一维非均相模型,用于分别计算催化剂和反应气体沿轴向的温度变化,在此基础上,结合H2和CO2甲醇化系统的反应计算模型,分别研究了反应压力、冷却介质温度以及入口反应气体中CO2与CO 比值等重要反应参数对反应过程中各反应速率、甲醇合成速率、催化剂与反应气体温度的影响规律,为准确分析反应气体和催化剂的温度分布以及调节H2和CO2甲醇化系统的反应过程提供了理论指导。
1 系统描述及建模
1.1 反应系统描述
在密闭空间内H2和CO2的反应流程如图1 所示[14,15],其主要由加热混合器、反应器、冷凝器、循环泵等部件组成,其中反应器是整个反应的核心部件,其内部安装多根用于安放催化剂的反应管,用于将反应气体催化合成甲醇,其主要发生如下反应:
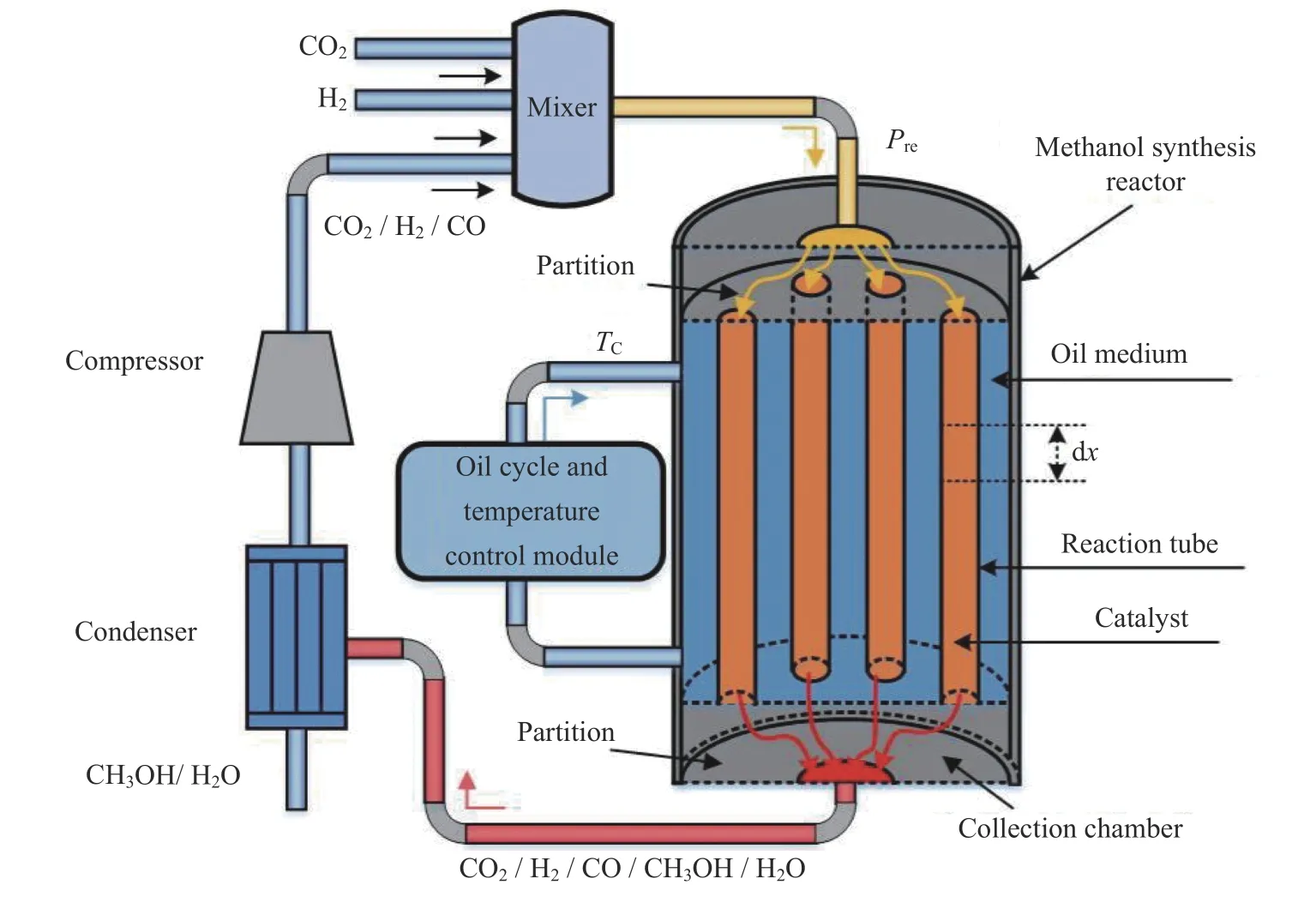
图1 氢气二氧化碳合成甲醇反应流程Fig.1 Flow chart of carbon dioxide hydrogenation to methanol system
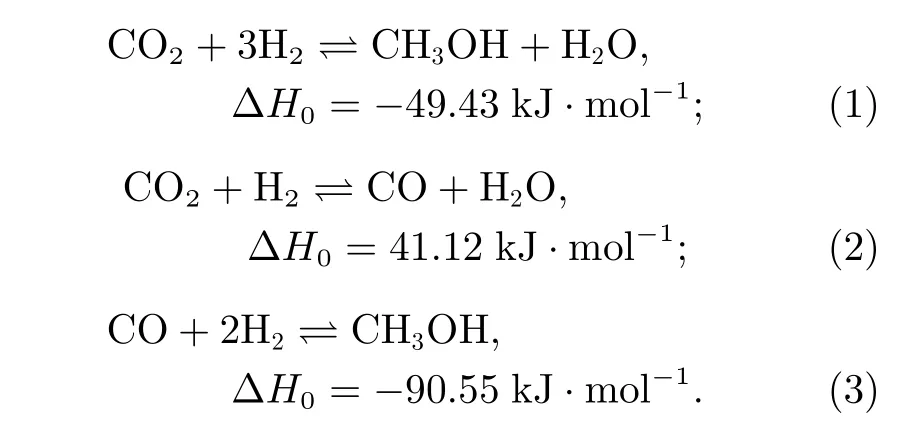
式(1)~(3)分别代表化学反应1~3,其化学反应物均为气态。由于发生反应的条件为高温高压,合理的反应压力为5~10 MPa,反应温度为473.15~573.15 K,需要保持进入反应管内部的气体为高温高压。此外,由于反应过程中会释放大量热量,为了保证反应始终处于正常的温度范围,需要在反应管外部流过具有强换热能力的冷却介质,用于传导耗散产生的反应热,冷却介质的循环流动和温度调节通过循环和温度控制模块实现控制。由于CO2和H2的单程反应不能完全转化成甲醇,需要将反应后的气体经过冷凝器析出甲醇和水以后重新由循环泵打入反应器中进行反应。由于反应过程中发生了产生CO 的逆水气反应,最后被循环泵重新打回的混合气体主要成分是H2、CO2和CO,在加热混合器中与H2和CO2混合后,进入反应器的混合气体成分不变,但是CO2和CO 的比值会随着CO2的输入而发生改变。
1.2 建模
针对反应管中H2和CO2催化合成甲醇反应过程的建模主要是建立物料衡算模型和能量衡算模型,物料衡算质量守恒模型依据质量守恒定律计算反应前后反应物和生成物的质量变化,能量衡算主要根据能量守恒定律计算反应过程中化学能、内能、动力势能和动能等能量之间的相互转化。为准确分析反应管内的反应过程,取图1 中反应管沿轴向的一段长为dx的小微元进行建模分析,其建模状态如图2 所示。

图2 反应管小微元建模Fig.2 Modeling schematic diagram of reaction tube element
1.2.1 物料衡算模型
设定所选取的微元在沿轴向x处,其长度为dx,流入和流出该微元内的各混合气体流量分别为Fi(x)和Fi(x+∆x),其中i代指H2、CO2、CO、CH3OH和H2O。在微元内部发生的反应1~3 的速率分别为r1(x)、r2(x)和r3(x),其计算公式分别如下[10]:


其中,dr为 反应管直径,ε为 催化剂孔隙率,ρc为催化剂密度,为反应物i的反应速率。各个物料成分的反应速率列于表1。
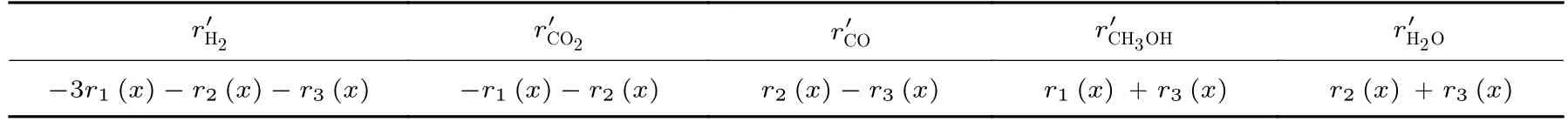
表1 各个物料成分的反应速率Table 1 Reaction rate of each material component
微元内混合气体中各组分分压的计算表达式为

其中,pto(x)为当前微元内气体的总压。
1.2.2 能量衡算模型
由于密闭空间处于空间微重力条件下,气体在甲醇化反应器内的反应管中流动时其重力势能变化可以忽略不计,此外在反应过程中,反应气体保持稳定流动,可以忽略其动力势能的变化。因此,本文能量衡算模型中主要考虑化学能和内能的变化。此外,在本文能量守恒模型中认为反应气流与催化剂之间的温度不一致,相互之间存在对流换热,即该模型为反应气流和催化剂的非均相模型。由于反应管的管径远小于管长,在建模时忽略气流和反应管在径向的温度梯度,认为其径向温度一致,其温度主要是沿轴向变化。对于dx微元内反应气体的能量分析如下:

其中,cf为混合气体的比热容,Ain为反应管内部截面积,Tf为 微元体内温度,Ufh为反应管内部气体与反应管外部冷却介质之间的等效换热系数,Tsh为反应管外部介质温度,Ac为 单位微元体内催化剂表面积,hfc为反应气体与催化剂之间的对流换热系数,Tc为催化剂温度。将式(10)~(13)代入式(9),得到

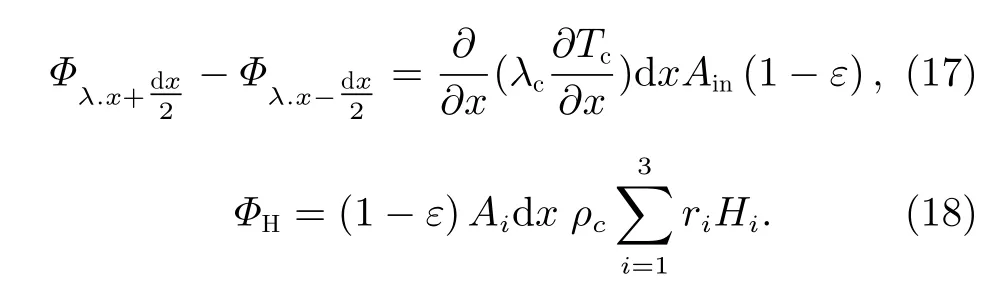
联立式(15)~(18),得到
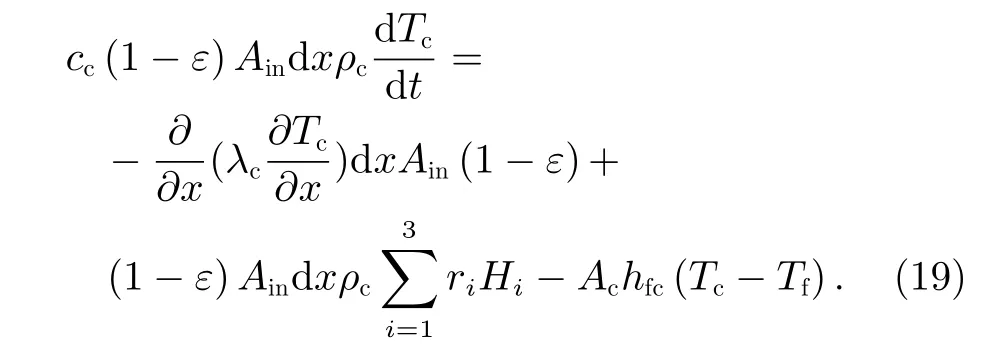
当微元体内反应气体与催化剂之间的传热处于稳态时,有
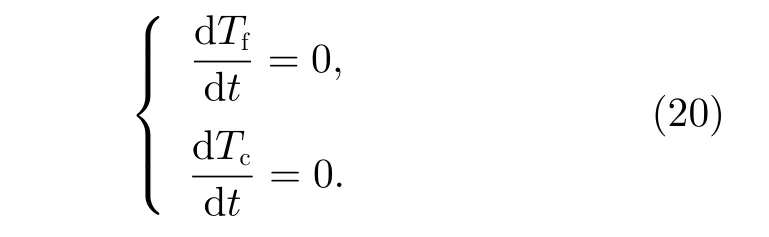
将式(14)、(19)和式(20)联立,得到反应气体和催化剂的温度方程式为

为方便式(21)的求解,将其进行数值离散化,有
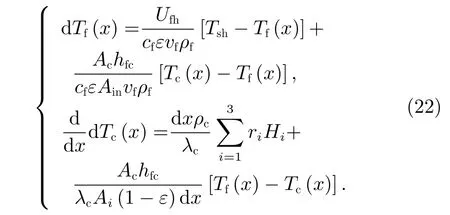
反应气体的一阶倒数以及催化剂的一阶、二阶导数数值表达式为
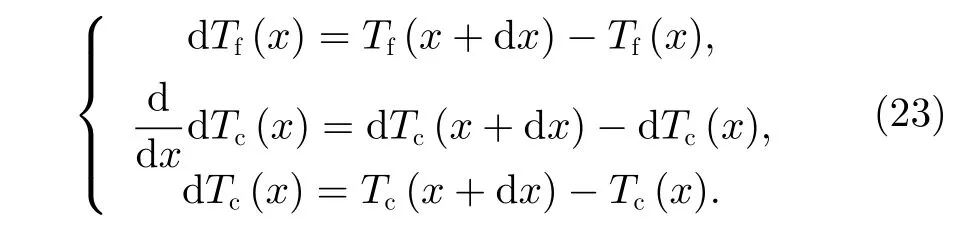
2 计算流程与计算工况
2.1 计算流程设计
对所建立的模型进行数值计算,其计算流程如图3所示,具体如下。
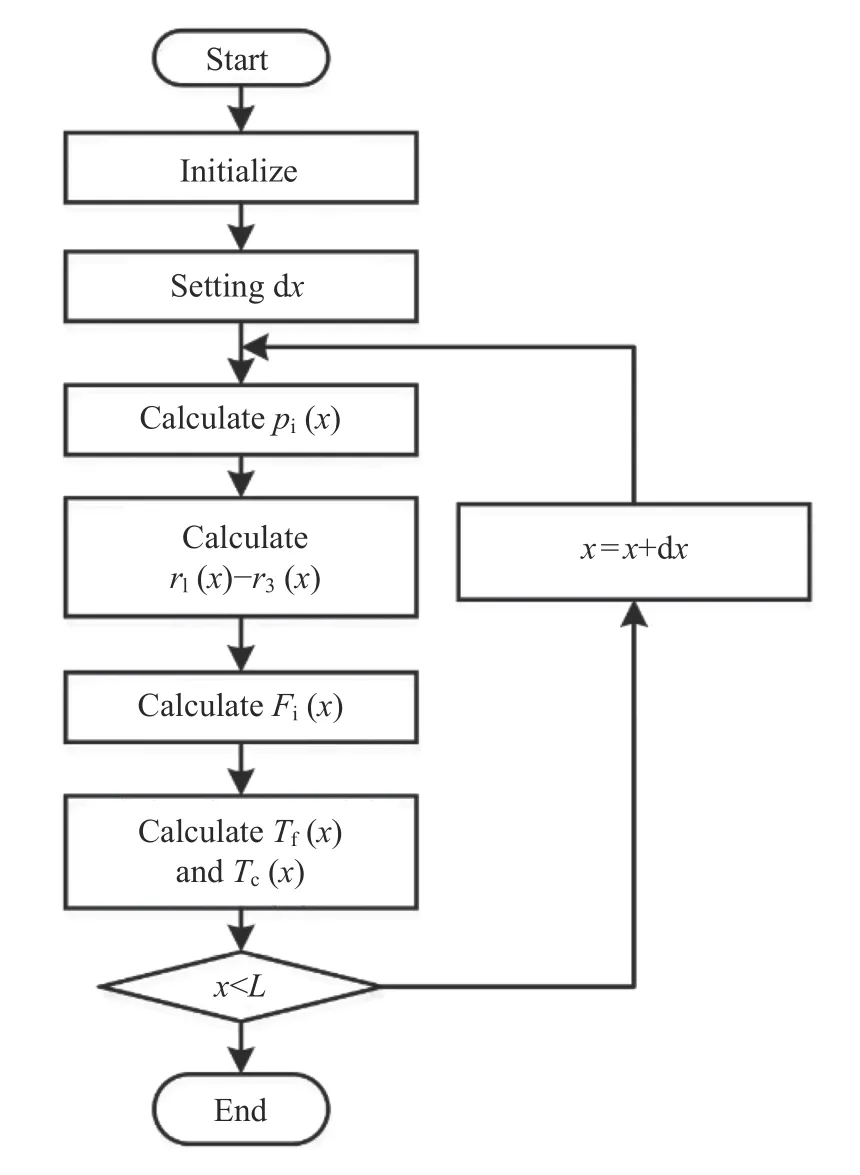
图3 模型计算流程Fig.3 Calculation flow chart of models
(1)在计算开始后对程序进行初始化,并根据反应的初始边界条件对相关反应参数赋值。
(2)设置微元长度dx的值,将长度为L的反应管沿轴向分为L/dx个微元,即解算整个反应管模型需要循环计算L/dx次。微元长度dx的选取会影响模型的计算精度,根据Willson-O 算法[16],当步长t<0.02T(T为计算周期)时,计算结果的系统误差小于1%,综合考虑模型的计算精度和计算时间,选取微元dx为反应管总长度L的0.1%,远小于0.02,既能够保证计算误差小于1%,计算时间也相对较短。
(3)根据模型方程和当前状态参数依次计算当前微元内反应气体各组分的分压pi(x),反应1~3 的反应压力r1(x),r2(x)和r3(x),各组分的物料Fi(x),以及催化剂和反应气体的温度Tf(x)和Tc(x)。
(4)判断当前微元位置x与反应管长度L之间的关系。若x≥L,说明当前微元是沿反应管轴向最后一个微元,所有微元已经计算完毕,程序跳转至结束;若x<L,说明当前微元不是沿反应管轴向最后一个微元,通过x=x+dx跳转到下一个微元,程序跳转到第三步,以当前计算结果作为下次计算流程的初始值,开始下一次计算循环。
2.2 计算工况设置
H2和CO2甲醇化反应器的工作参数见表2,为了表征反应压力、冷却介质温度以及反应气体中CO2与CO 比值对反应过程的影响,采用控制变量法分别对这三个参数设置不同的工况(见表3)。针对反应压力分别设置5 MPa、6 MPa、7 MPa、8 MPa 四种工况,保持冷却介质温度恒定为523.15 K,CO2/CO比值恒定为10。同理,针对冷却介质温度分别设置了493.15 K、508.15 K、523.15 K、538.15 K 四种工况,针对CO2与CO 比值设置了10、3、1 三种工况,其他参数保持不变。

表2 H2 和CO2 合成甲醇反应工作参数Table 2 Working parameter sheet of carbon dioxide hydrogenation to methanol

表3 H2 和CO2 合成甲醇反应仿真计算工况设计Table 3 Working condition arrangement of carbon dioxide hydrogenation to methanol
3 结果与讨论
3.1 反应压力对反应过程的影响
不同反应压力对单管内反应过程的影响如图4所示,图4(a)~(c)中分别显示了反应式(1)~(3)的反应速率r1、r2和r3在不同反应压力下沿反应管轴向的变化规律,从图4(a)中可以看出,不同反应压力下,H2与CO2直接合成甲醇的反应速率r1都具有相同的变化趋势,在沿反应管轴向0~1 m 的区间内先急剧递减,然后1~7 m 区间内缓慢递减,以5 MPa 工况为例,反应速率r1在反应管入口时为5.11×10–2mol·s–1·kg–1,沿着反应管轴向从0 变到1 m 时,其值大幅减小为4.9×10–3mol·s–1·kg–1,然后缓慢减小为出口时的7.49×10–4mol·s–1·kg–1。反应速率r1大幅递减是因为随着反应的进行,H2和CO2的浓度逐渐降低,而产物CH3OH 和H2O 逐渐累积,导致了反应1 的平衡逆向移动,造成反应速率急剧递减。在1 m 以后,H2和CO2已经被消耗至较低的浓度,产物已经生成至较高的浓度,反应平衡逐渐稳定,因此其反应速率变化较小。此外,从图4(a)中可以看出当压力从5 MPa增加为8 MPa 时,反应管速率变化不大,只是在反应管入口阶段从5.11×10–2mol·s–1·kg–1增加到6.18×10–2mol·s–1·kg–1,其他位置的反应速率只有轻微增加。
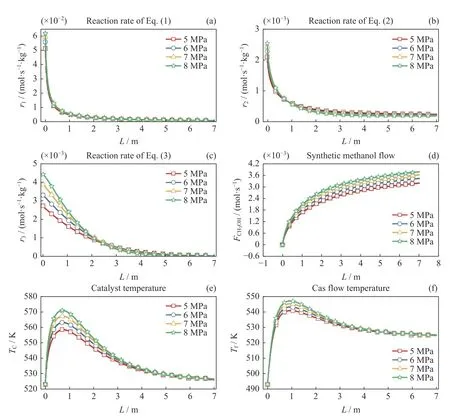
图4 不同反应压力对单管反应过程的影响Fig.4 Effect of pressure on the reaction
图4(b)中显示反应2 的反应速率r2与反应速率r1具有相同的变化趋势,都是先急剧减小然后平缓减小。以5 MPa 工况为例,反应速率r2在反应管入口时为2.10×10–3mol·s–1·kg–1,沿着反应管轴向移动到1 m 时,其值大幅度减小为6.09×10–4mol·s–1·kg–1,然后缓慢减小为出口时的2.47×10–4mol·s–1·kg–1。此外,压力的增加对反应管入口处反应速率有小幅度增加,其他区域反应速率的变化不大。图4(c)中显示了反应3 的反应速率r3随着反应管轴向逐渐递减的变化趋势,其下降趋势相对于反应1 和2 比较平缓,引起其下降的主要原因是,随着产物的累积,反应平衡逐渐逆向移动。此外,在反应管同一位置内反应速率r3也会随压力增加而显著增加,这是因为反应3 的反应物计量数大于生成物,压力的增加促进了反应平衡正向移动。
图4(d)为单管中合成甲醇含量FCH3OH随反应管轴向的变化,从图中可以看出,沿反应管轴向,甲醇含量由于逐渐积累而不断增加,但是其增加量逐渐降低,增加量的降低是因为反应1~3 的反应速率逐渐递减而导致的。
图4(e)(f)显示了不同反应压力下催化剂温度和反应气体温度随着反应管轴向的变化规律,其都是沿着反应管轴向先急剧增加然后逐渐减小的,以5 MPa 工况为例,催化剂温度Tc和 反应气体温度Tf分别从其初始温度523.15 K 和493.15 K 逐渐增加至最高温度,然后逐渐降低而不断接近反应管外部冷却介质的温度523.15 K。由于反应管前端反应速率较快,反应过程中的产热量大于外部冷却介质所耗散的热量,导致催化剂温度Tc不断升高。沿反应管轴向反应速率不断减小,反应过程中的产热量逐渐小于外部冷却介质对反应管的散热量,导致催化剂的温度Tc不断降低而逐渐趋近于冷却介质温度。反应气体温度Tf主要受其与催化剂和外部冷却介质之间的换热影响,在冷却介质温度恒定不变的前提下,其具有与催化剂温度Tc相同的变化趋势。此外,随着反应压力的增加,催化剂和反应气体的最高温度也逐渐增加。当反应压力从5 MPa 逐渐上升至8 MPa 时,催化剂的最高温度从557.70 K 上升至569.52 K,反应气体的最高温度从540.79 K 上升至546.98 K。其最高温度增加主要是因为压力的增加促进了反应速率增加,导致该区域的产热速率增加,最终导致温度升高。催化剂的最高温度569.52 K 接近其最佳反应温度区间的最大值573.15 K,为了不超过该最佳温度,反应压力应不大于8 MPa。
3.2 冷却介质温度对反应过程的影响
不同冷却介质温度对单管内反应过程的影响如图5 所示,图5(a)~(c)中分别显示了反应1~3 沿反应管轴向的反应速率在不同冷却介质温度下的变化规律,在图5(a)不同冷却介质温度下,H2与CO2直接合成甲醇的反应速率r1与图4(a)中的变化趋势一致,都是约在0~1 m 的区间先急剧递减而后在1~7 m 区间缓慢递减,其变化原因与图4(a)一致。此外,当冷却介质温度从493.15 K 增加为538.15 K时,在反应管入口其反应速率从4.14×10-2mol·s-1·kg-1增加为5.63×10-2mol·s-1·kg-1,这是因为冷却介质温度的增加会引起反应温度增加,最终导致反应气体活化能的增加,从而增大了其反应速率。其他位置的反应速率随着温度的变化并不明显。
图5(b)中不同冷却介质温度下反应2 的所有反应速率r2曲线都是先急剧减小而后平缓地减小。此外,随着反应温度的升高,沿轴向同一位置的反应速率有明显提升。当493.15 K 增加为538.15 K 时,反应管入口反应速率r2从5.03×10–4mol·s–1·kg–1上升至4.03×10–3mol·s–1·kg–1,反应管尾端反应速率r2从6.66×10–5mol·s–1·kg–1上升至5.05×10–4mol·s–1·kg–1。由于反应2 是吸热反应,当冷却介质温度升高时会导致其反应温度上升,促进了反应2 的正向进行,导致反应速率r2随着冷却介质的温度上升而明显地上升。
图5(c)中不同冷却介质温度下反应3 的反应速率r3都具有随反应管轴向逐渐递减的变化趋势,这是因为随着反应物的消耗,其反应速率逐渐降低。此外,随着冷却介质温度的增加,反应速率r3在反应管前端会具有较大幅度的增加,在反应管尾端变化并不明显。结合图5(b)可知,随着冷却介质温度的增加,反应2 的反应速率极大增加,从而引起合成的CO 大量增加,导致混合气体中CO 含量的增加,从而推动CO 与H2合成甲醇的反应3 正向移动,最终促进反应速率r3随着冷却介质温度的增加而增加。
与图4(d)甲醇含量FCH3OH的变化趋势一样,图5(d)不同冷却介质温度下FCH3OH沿反应管轴向逐渐增加,且其增加率逐渐降低,其原因与图4(d)一致。图5(e)(f)显示了不同冷却介质温度下催化剂温度Tc和反应气体温度Tf随反应管轴向的变化规律,与图4(e)(f)一样,其都是沿反应管轴向先急剧增加然后逐渐减小的。Tc和Tf都是从其初始温度逐渐上升至最高点后逐渐下降趋近于冷却介质的温度。在四种冷却工质温度下,催化剂温度Tc相对初始温度上升幅度为31.5 K、32.9 K、35.3 K 和39.0 K,上升幅度变化较小。反应气体温度Tf上升幅度为16.7 K、31.4 K、47.0 K 和63.6 K,上升幅度逐渐增大。Tc和Tf上升不仅是因为冷却介质温度上升引起反应速率增加,导致单位时间内产热量增加,还因为冷却介质温度的上升会加热反应管,从而引起反应管内的催化剂和反应气体温度都上升。反应气体温度Tf上升幅度不断增加是因为反应气体入口温度保持493.15 K 不变,当反应管外部冷却介质温度不断升高时,反应气体在被冷却介质传热后温度不断上升,从而相比入口处的温升不断增大。此外,虽然升高冷却介质的温度能够加速反应进行,但是当冷却介质温度为538.15 K时,催化剂的最高温度为577.2 K,略微超过573.15 K的最佳反应温度上限,可能导致催化剂失去活性,因此冷却介质温度不宜高于538.15 K。
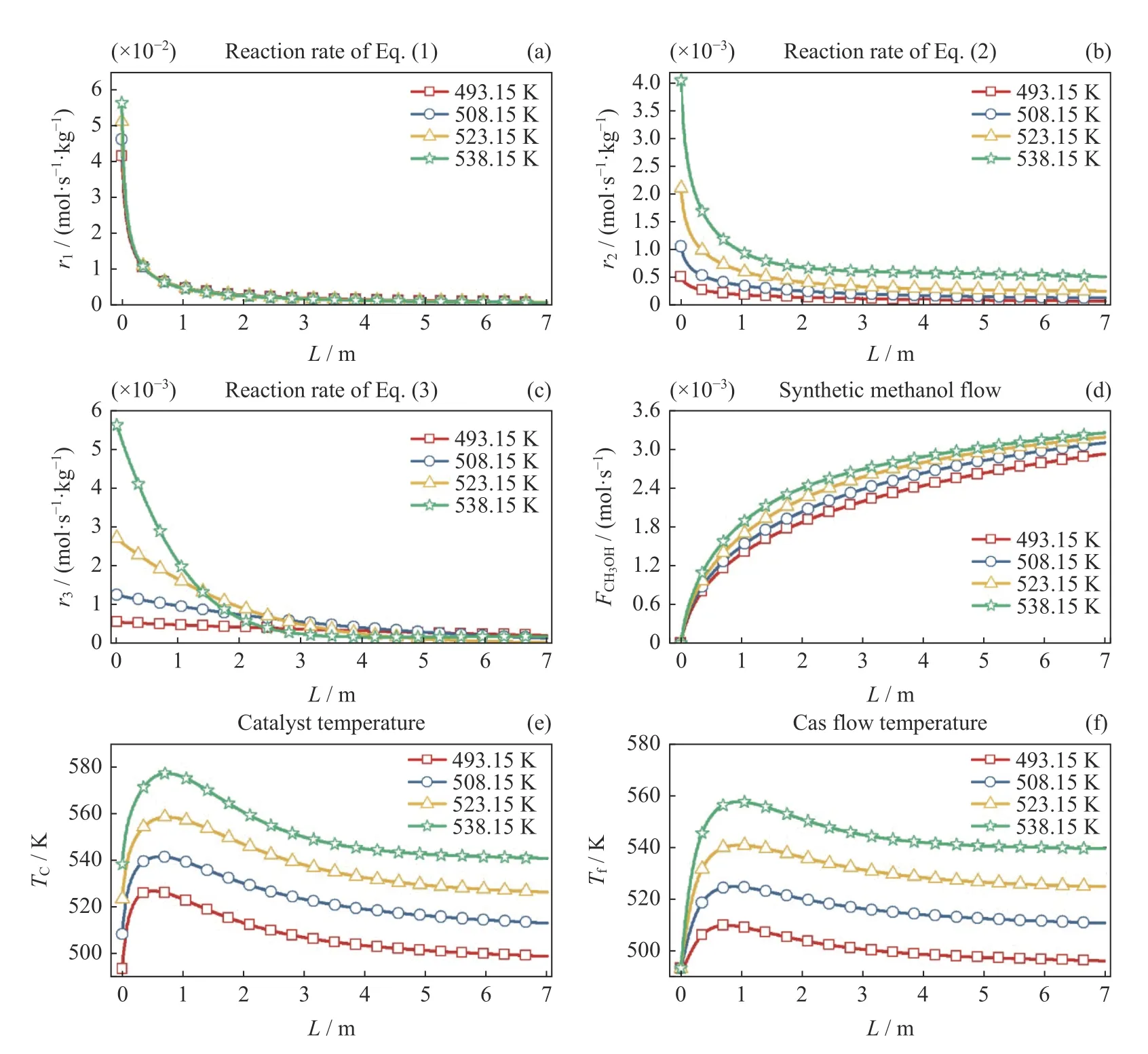
图5 不同冷却介质温度对反应过程的影响Fig.5 Effect of cooling medium temperature on the reaction
3.3 反应气体CO2 与CO 比值对反应过程的影响
反应器入口反应气体中不同CO2与CO 的比值R对单管内反应过程的影响如图6 所示,在图6(a)中不同比值R工况下反应1 的反应速率r1与图4(a)和图5(a)中的变化趋势一致,都是在反应管前端先急剧递减然后在反应管后端缓慢递减,其变化原因与4(a)和图5(a)一致。在反应管入口,当R从10下降为1时,其反应速率从5.11×10–2mol·s–1·kg–1下降为4.17×10–2mol·s–1·kg–1,这是因为R=1时反应气体中CO2的浓度比R=10时小,引起反应1向逆向移动,导致反应速率减小。
图6(b)中不同比值R下反应2 的反应速率r2都是先急剧减小然后再平缓地减小,在反应管入口,R=10 的反应速率r2为2.10×10–3mol·s–1·kg–1,远小于R=1 的反应速率8.51×10–3mol·s–1·kg–1,这是因为此时混合气体中H2含量增加导致了反应2 的反应平衡正向移动,在反应管中后段,反应速率r2在R=10与R=1 的工况下几乎相等,说明随着反应的进行,组分含量变化对反应平衡变化影响逐渐变小。
图6(c)中不同R值下反应3 的反应速率r3均沿反应管轴向逐渐递减,此外,随着R的减小,在同一反应管位置处,反应速率r3逐渐增加,这是因为随着R值的不断减小,反应气体中CO 含量逐渐增加,有利于反应3 朝正向移动,导致反应速率r3不断增加。
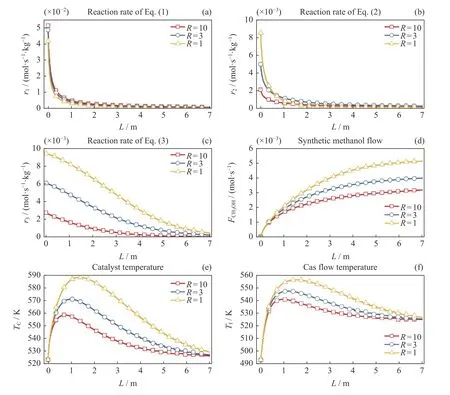
图6 CO2 与CO 比值对反应过程的影响Fig.6 Effect of ratio of carbon dioxide to carbon monoxide on the reaction
图6(d)中不同比值R下甲醇的含量FCH3OH沿反应管轴向不断累积而逐渐增加,且随着比值R的不断减小而增加,在H2与CO2合成甲醇的反应1 的反应速率r1变化较小情况下,其增加主要是由于反应3 合成甲醇的速率r3的不断增加。
图6(e)(f)分别显示了不同比值R下催化剂温度Tc和反应气体温度Tf随反应管轴向的变化规律,其均具有沿反应管轴向先急剧增加而后逐渐减小的变化趋势。随着R从10 变化为1,催化剂温度Tc从其初始值523.15 K 分别快速上升至最高点558.4 K、570.8 K和588.0 K,然后在最高点慢慢下降至接近初始值。反应气体温度Tf从其初始值493.15 K,分别迅速上升至540.8 K、547.3 K 和556.2 K 的最大值,然后逐渐下降至接近反应管外冷却介质的温度。催化剂和反应气体温度上升的原因与图4 和图5 一致。随着R的逐渐减小,催化剂温度Tc和 反应气体温度Tf的最高温度逐渐上升,主要是因为R值的降低引起了反应3 的反应速率r3迅速增加,导致由反应3 产生的热量迅速增加,最终引起催化剂和反应气体最高温度的增加。此外,当R降低为1 时,催化剂的最高温度为588.0 K,稍微超过573.15 K 的最佳温度上限,可能导致催化剂失去活性,因此比值R的选取应该大于1。
4 结论
采用微元法建立了载人密闭空间内H2和CO2甲醇化反应过程的物理计算模型和一维非均型温度分析模型,开展了反应压力、冷却介质温度和反应气体中CO2和CO 比值等参数对反应过程影响规律的研究,得到的主要结论如下。
在各种工况下,沿反应管轴向,反应速率均先大幅减小然后平缓减小,合成甲醇不断增加但其增加率不断减小,催化剂和反应气体的温度都是急剧上升然后逐渐降低并趋近于冷却介质温度。
随着反应压力的增加,冷却介质的温升以及二氧化碳和一氧化碳比值的减小都会增大反应速率,促进甲醇合成速率的增加,并且导致催化剂和反应气体最高温度的增加,为了保持催化剂处于最佳反应温度范围内,反应压力应不超过8 MPa,冷却介质温度应不高于538.15 K,CO2与CO 的比值应不小于1。
