生物信息学分析类风湿性关节炎相关间质性肺病Hub基因及其通路的鉴定
2022-06-17韩玉梅池淑红
薛 菁,马 银,韩玉梅,池淑红
间质性肺病(ILD) 是类风湿性关节炎(RA) 患者比较常见的一种关节外病变[1]。目前,类风湿性关节炎相关间质性肺病(RA-ILD)临床诊疗管理报道较多,而对于其发病机制的研究却相对匮乏[2]。早期的芯片技术到现在的高通量测序技术,都是以挖掘研究疾病相关靶标分子及通路为核心,其应用较为广泛[3]。本研究利用NCBI GEO(GEO) 数据库的RA-成纤维样滑膜细胞(FLS)及ILD肺脏组织基因表达谱数据筛选共同表达的差异基因,并利用DAVID、KEGG以及STRING数据库分析目的基因显著富集的生物学过程,分子功能以及信号通路,为RA-ILD生物标记物的鉴定及分子机制的研究提供思路。
1 资料与方法
1.1 原始表达谱矩阵文件的下载与处理:数据集GSE47460及GSE128813均来源于NCBI-GEO DataSets,其中GSE47460数据集包括582例肺脏组织样本,选取符合标准的194例ILD样本以及91例正常肺脏组织对照样本(297例COPD样本除外),GSE128813数据集包括3例RA-FLS样本以及3例正常FLS对照样本。
1.2 差异表达基因(DEGs) 及目的基因的获取:利用R3.6.1软件的limma包分别筛选两个数据集显著DEGs,以P<0.05并且 |log2FC|>0.5作为筛选差异基因的阈值。分别利用R3.6.1软件中ggplot2和pheatmap包绘制DEGs火山图及热图,并利用Venn将两个数据集筛选得到的DEGs取交集,从而获取目的基因进行后续分析。
1.3 目的基因富集分析:利用富集分析工具DAVID分析目的基因参与的GO功能富集及KEGG通路富集。选取参与富集基因个数≥2,P<0.05作为富集显著性的阈值。
1.4 TOP8核心(Hub)基因筛选:利用STRING(http:∥string-db.org/) 数据库构建目的基因蛋白质互作调控网络图(Protein-protein interaction,PPI),构建后的网络图利用Cytoscape3.6.0软件及MCODE插件筛选TOP8 Hub基因。
1.5 目的基因蛋白质与转录因子(TF) 网络调控图:利用DAVID软件搜索与目的基因显著相关的转录因子,联合目的基因蛋白质互作网路构建和TF相关的调控关系网络图。
2 结果
2.1 DEGs筛选结果:数据集GSE47460 (间质性肺病实验组 vs.正常对照肺脏组织组)和数据集GSE128813 (类风湿性关节炎成纤维样滑膜细胞与正常对照成纤维样滑膜细胞)分别筛选出1 173个和1 154个满足阈值的DEGs(图1A、1B,封三),2组DEGs中包含43个重叠DEGs(图2,目录后),其中表达上调基因24个,表达下调基因19个,重叠DEGs分别在2组数据集中表达热图(图3,封三),见表1。


表1 DEGs的24个高表达基因和19个低表达基因
2.2 目的基因功能及通路富集分析:分析目的基因的功能及通路富集情况。在生物学过程组中,主要富集于胶原蛋白分解代谢的过程、蛋白寡聚化正向调控、间充质细胞增殖、催化活性负向调控、软骨形态发生及上皮细胞向间充质细胞转化涉及心内膜的形成。在细胞成分组中,主要富集于细胞外基质、中间体及胞外区。在分子功能组中,主要富集于肽链内切酶活性、肽链内切酶金属活性、肝素结合及生长因子(图4,封三)。KEGG-通路分析发现显著富集的通路包括类风湿性关节炎、癌症通路、细胞骨架调控、Rap1信号通路、Ras信号通路、MAPK信号通路及戊糖和葡醛酸盐的相互转化(图5,封三),见表2。
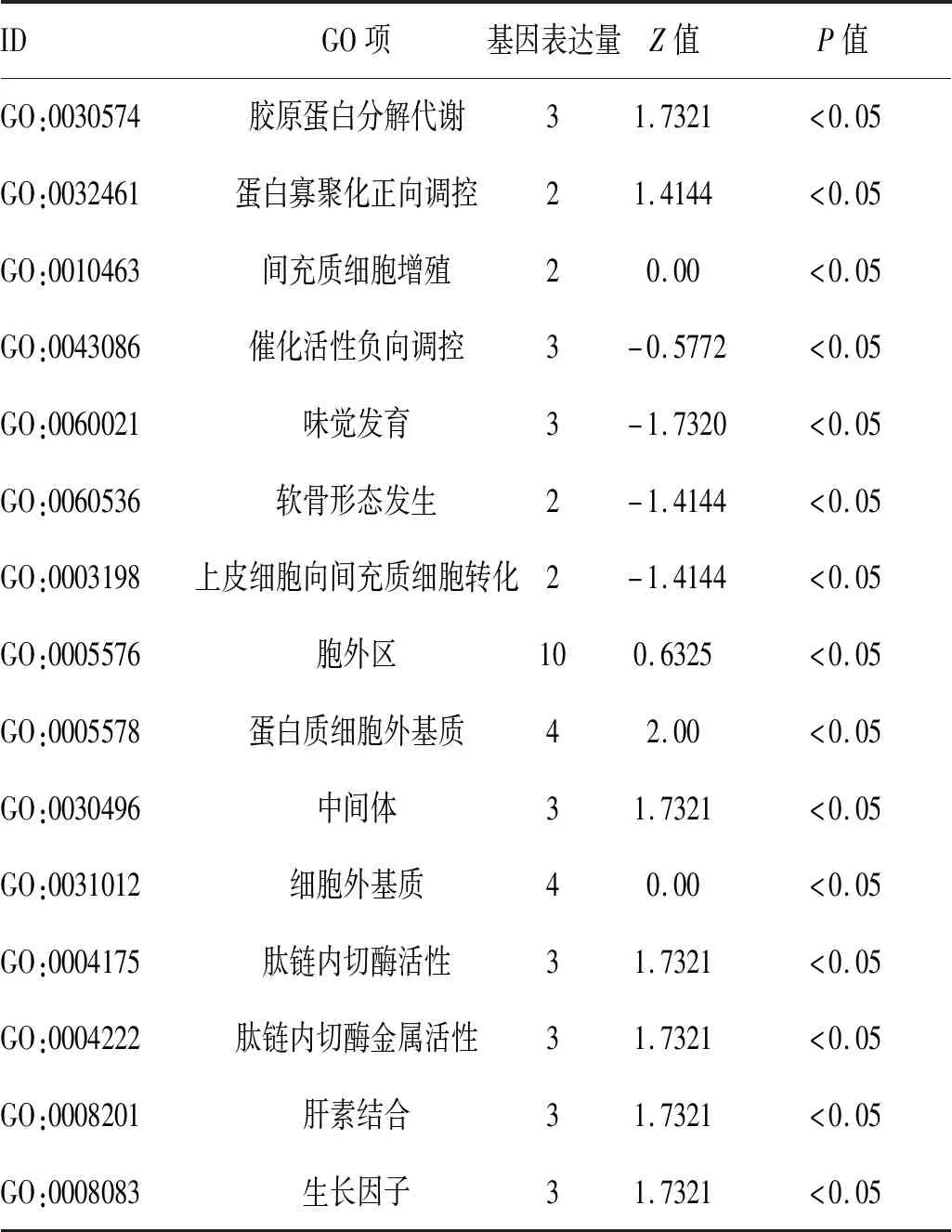
表2 DEGs三个功能组的显著富集分析
2.3 利用PPI对DEGs进行关键候选基因的识别:运用STRING网站和Cyto-scape软件,经分析发现43个共同差异表达基因中有18个DEGs被过滤到PPI网络中,其中包含18个节点和25个相互作用关系(图6,封三)。18个节点中,利用Cytohuabba筛选了8个Hub-基因,分别为基质金属酶1(MMP1),基质金属酶3(MMP3),Discs大同源相关蛋白(DLGAP5),拓扑异构酶2A(TOP2A),着丝粒蛋白F(CENPF),驱动蛋白超家族4A(KIF4A),SHC的SH22结构域结合蛋白1(SHCBP1),去整合酶金属蛋白酶3(ADAMTS3)(图7,封三)。
2.4 目的基因与TF调控关系网络图:利用DAVID工具搜索共同差异表达基因显著相关的转录因子,共筛选得到3个满足阈值的TF,分别为SRY、STST5B、NKX3A。利用Cyto-scape软件构建DEGs与TF调控网络图,其中包括43个节点和112个相互作用关系(图8,封三)。
3 讨论
RA是以滑膜慢性炎症及骨破坏为特征的一种系统性疾病[4]。滑膜衬里层的FLS的异常增殖、侵袭是RA发病的主要原因之一[5]。研究统计,RA患者一生发生ILD的风险约为60%,严重影响了患者的日常生活质量,同时存在死亡风险[6-7]。研究表明,感染、吸烟、黏膜失调、宿主遗传及过早衰老等都是RA患者肺部疾病发展的重要潜在因素[8]。RA-ILD(可先于关节发病) 可能起源于慢性气道和肺泡上皮损伤,从而导致慢性炎症以及气道和肺实质的纤维化改变[9]。然而,作为影响RA患者预后的ILD,一直以来研究方法、动物模型以及治疗手段均较匮乏,比如是否采用抗纤维化治疗/非抗纤维化治疗的方法存在争议[10]。所以说,进一步寻找RA-ILD潜在的诊断与治疗靶基因和相关信号通路,对于临床发掘有效的治疗方法至关重要。本研究通过分别筛选RA-FLS及ILD肺脏组织芯片数据集的共同表达差异基因,同时根据目的基因的PPI网络,共筛选出8个Hub基因,包括MMP-1、MMP-3、DLGAP5、TOP2A、SHCBP1、CENPF、KIF4A、ADAMTS3。Hub基因功能主要富集于胶原蛋白分解代谢、上皮细胞向间充质细胞分化及间充质细胞增殖过程。
关节软骨的细胞外基质(ECM)和基底膜降解是RA患者关节软骨损害的病理基础。基质金属蛋白酶(MMPs) 对降解ECM起着重要作用[11]。在MMPs家族中,MMP1和MMP3属于胶原酶和间质溶解素酶,对ECM的降解发挥着关键作用。研究表明,利用ELISA及qRT-PCR方法检测RA患者关节滑膜组织原代成纤维样滑膜细胞中MMP1和MMP3的表达,均高于阿巴西普细胞治疗组,提示MMP1与MMP3的表达水平与RA疾病活动度呈现正相关[12]。在检测端粒酶介导的人骨关节炎FLS(hTERT-OA 13A FLS)和端粒酶介导的人类风湿关节炎FLS(hTERT-RA 516 FLS)基因表达的差异时,发现MMP1、MMP3及ADAMTS3基因在端粒酶介导的人类风湿关节炎FLS中的表达是明显上调的。而在博来霉素诱发的特发性肺纤维化小鼠模型中,MMP3具有促进上皮细胞向间质转化、异常迁移和其他异常修复过程的功能,而MMP1具有减缓肺脏纤维化的潜在功能,这一结论与本文结论不符,可能与实验样本量的大小以及物种的差异性有关。ADAMTS3是ADAMTS基因家族前胶原N-蛋白酶亚家族成员,其主要作用为合成骨和软骨的组成成分II型胶原分子[13]。研究表明,在SiO2构建的大鼠肺纤维化模型中,miR-144可通过调控靶基因ADAMTS3参与肺纤维化的发生。以上结果提示MMP1、MMP3及ADAMTS3基因可能参与RA-ILD的发生。
TOP2A是一种广泛存在于原核生物和真核生物中的酶蛋白,与细胞增殖、细胞凋亡、细胞有丝分裂等密切相关。其表达的异常与肿瘤的发生发展、治疗及其预后等方面相关[14]。研究表明,青少年类风湿性关节炎患者血浆中TOP2A的水平与疾病的严重程度呈现正相关,并且系统性硬化(SSc) 患者血浆中抗TOP2A抗体阳性发生肺纤维化的概率明显高于抗TOP2A抗体阴性患者,这一发现强调了TOP2A对于风湿免疫疾病诱发的肺部疾病的研究是一个有价值的重要工具[15-16]。
综上所述,通过对RA-FLS及ILD肺脏组织芯片数据集的共同表达差异基因的筛选、搜寻GEO Profiles数据库及查阅相关文献,结果提示,MMP1、MMP3、ADAMTS3、TOP2A可能在RA-ILD中起一定作用。而DLGAP5、SHCBP1、CENPF、KIF4A,其主要富集功能与MMP1、MMP3、ADAMTS3、TOP2A类似,但相关文献报道较少,尚需实验室和临床证实。这也是本文的不足之处,需要进一步开展的工作。
