响应面法优化液体发酵桦褐孔菌多糖的制取
2022-06-17董婷婷马晨曦李凤林
董婷婷,马晨曦,郭 娜,刘 超,李凤林
(吉林农业科技学院,吉林 吉林 132101)
桦褐孔菌(Inonotus obliquus)是一种具有多种药理功能的大型真菌,其中含有的多糖具有抗肿瘤、抗氧化、降血糖、降血脂、抗病毒、抗炎等多重药理作用[1-5]。桦褐孔菌野生型子实体主要生长于高寒地区桦树的树皮上,生长周期缓慢,导致子实体产量受限。但通过深层液体发酵技术获得的桦褐孔菌菌丝体与子实体相比,在生产周期、产量及成本方面具有显著优势[6]。利用液体发酵法制备桦褐孔菌菌丝体,提取活性多糖,为桦褐孔菌后续的研究提供参考。
活性多糖的提取需破坏植物细胞壁并且利用极性溶剂液进行浸提,故细胞壁的破坏程度和浸提方法对植物多糖的提取量和提取速度具有直接影响。徐昙烨等人[7]利用超声波的空化作用使细胞壁破裂辅助提取桦褐孔菌多糖。王艳波[8]利用酶破坏细胞壁的方法辅助提取多糖。使用酶-超声波协同提取法,该方法不仅能特异性水解细胞壁中的纤维素,而且能够利用超声波作用加大细胞壁破裂程度,对比其他提取方法,两者结合可以显著增加多糖的溶出率和溶出速度。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种
桦褐孔菌菌种(BNCC 117822)。
1.1.2 纤维素酶
纤维素酶,购自北京奥博星生物技术有限责任公司,酶活力10 万U/g。
1.2 试验方法
1.2.1 液体发酵培养桦褐孔菌菌丝体
(1)液体发酵培养基。液体发酵培养基:马铃薯煮出液1.0 L,葡萄糖40.0 g,KH2PO43.0 g,Mg-SO4·7HO21.5 g,维B110 mg。马铃薯煮出液1 L。
(2)液体发酵条件。在无菌环境中,用接种铲将斜面固体培养基中的菌种切块(0.5 cm×0.5 cm),接种于装有150 mL 液体发酵液的锥形瓶中,将锥形瓶置于25 ℃下(恒温振荡培养箱)中培养13 d,即可得到桦褐孔菌菌丝体。
(3)菌丝体预处理。用纯水将液体发酵培养的菌丝体清洗后,筛网过滤,经真空冷冻干燥后粉碎,过60 目筛后备用。
1.2.2 桦褐孔菌多糖的制备
菌丝体干粉→溶解→纤维素酶与超声波协同提取→灭酶→离心→蒸发浓缩→醇沉→离心→乙醇洗涤→真空冷冻干燥→桦褐孔菌粗多糖。
精密称取桦褐孔菌菌丝体干燥样品,加入定量的纤维素酶,并加入定量纯水进行溶解,设定好超声功率、温度和时间后,进行酶-超声波协同提取。提取结束后,迅速升温至100 ℃进行灭酶处理10 min,将提取液冷却至室温后,以转速4 000 r/min 离心15 min,取上清液,将上清液蒸发浓缩至10 mL,加入95%乙醇溶液30 mL,于4 ℃下静置过夜后,以转速4 000 r/min 离心15 min,收集沉淀,用乙醇洗涤3 次,将沉淀全部溶解,冷冻干燥至恒质量,即得桦褐孔菌粗多糖[8-10]。
1.2.3 多糖测定
(1)苯酚硫酸法原理。样品中水溶性糖和水不溶性多糖经盐酸溶液水解或水解醇沉后转化成还原糖,水解物在硫酸的作用下,迅速脱水生成糖衍生物,并与苯酚反应生成橙黄色溶液,其颜色深浅与糖含量成正比,可在波长486 nm 处采用分光光度仪测得溶液吸光度,计算出多糖的质量浓度。该方法试验时受蛋白质影响非常小,基本可以忽略,成本低、灵敏度高,是检测多糖的一种常见方法。
(2)标准曲线的制作。准确称取干燥至恒质量的葡萄糖标准品0.100 0 g,用蒸馏水溶解,定容至1 000 mL 容量瓶中,配成0.1 mg/mL 的葡萄糖标准液。精密移取0,0.10,0.20,0.40,0.60,0.80,1.00,1.20,1.40,1.60 mL 葡萄糖标准液于25 mL具塞比色管中,加蒸馏水至2.0 mL,再各加5%苯酚溶液1.0 mL,充分振摇均匀,迅速加入浓硫酸10 mL,振摇5 min,反应液静止放置10 min,置沸水浴中加热20 min,取出冷却至室温,以试剂空白作为参比液,用紫外可见分光光度计于波长486 nm 处测定系列不同质量浓度标准工作液吸光度,以多糖质量浓度为横坐标,吸光度为纵坐标,绘制葡萄糖标准曲线。
(3)样品多糖含量的测定[11-12]。将提取后的多糖溶于一定量蒸馏水中进行复溶,充分溶解并冷却至室温,过滤,精确量取0.5 mL 上清液,加入25 mL具塞比色管中,加蒸馏水至2.0 mL,之后按1.2.3(2)中操作进行,则得到样品中多糖质量浓度,同时做空白试验。
按照以下公式计算提取的活性多糖的得率:
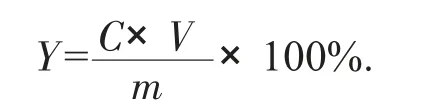
式中:Y——多糖得率,%;
C——样品溶液的多糖质量浓度,g/mL;
V——供试液的体积,mL;
m——桦褐孔菌菌丝体质量,g。
1.2.4 酶-超声波辅助提取单因素试验设计
(1)超声功率对桦褐孔菌菌丝体多糖得率的影响。准确称取5 份桦褐孔菌子实体粉末,分别放入烧杯中并编号,在超声时间为15 min,酶添加量为3%,料液比为1∶30(g∶mL),浸提温度为55 ℃条件下,考查不同超声功率200,250,300,350,400 W 对桦褐孔菌菌丝体多糖得率的影响。
(2)超声时间对桦褐孔菌菌丝体多糖得率的影响。准确称取5 份桦褐孔菌子实体粉末,分别放入烧杯中并编号,在超声功率为300 W,酶添加量为3%,料液比为1∶30(g∶mL),浸提温度为55 ℃条件下,考查不同超声时间5,10,15,20,25 min对桦褐孔菌菌丝体多糖得率的影响。
(3)酶添加量对桦褐孔菌菌丝体多糖得率的影响。准确称取5 份桦褐孔菌子实体粉末,分别放入烧杯中并编号,在超声功率为300 W,超声时间为15 min,料液比为1∶30(g∶mL),浸提温度为55 ℃条件下,考查不同酶添加量(占桦褐孔菌添加量)1%,2%,3%,4%,5%对桦褐孔菌菌丝体多糖得率的影响。
(4)料液比对桦褐孔菌菌丝体多糖得率的影响。准确称取5 份桦褐孔菌子实体粉末,分别放入烧杯中并编号,在超声功率为300 W,超声时间为15 min,酶添加量为3%,浸提温度为55 ℃条件下,考查不同 料 液 比1 ∶10,1 ∶20,1 ∶30,1 ∶40,1 ∶50(g∶mL)对桦褐孔菌菌丝体多糖得率的影响。
(5)浸提温度对桦褐孔菌菌丝体多糖得率的影响。准确称取5 份桦褐孔菌子实体粉末,分别放入烧杯中并编号,在超声功率300 W,超声时间15 min,酶添加量3%,料液比1∶30(g∶mL)条件下,考查不同浸提温度35,45,55,65,75 ℃对桦褐孔菌菌丝体多糖得率的影响。
1.2.5 响应面法试验设计
在单因素试验的基础上,以桦褐孔菌菌丝体多糖的得率为响应值(Y),以对响应值影响最大的3 个因素(超声功率、酶添加量、浸提温度)为自变量,采用Box-behnken 设计三因素三水平的响应面优化试验以达到优化桦褐孔菌菌丝体提取工艺的目的。
响应面试验因素与水平设计见表1。

表1 响应面试验因素与水平设计
1.3 数据处理分析
采用Excel 2010 对单因素试验数据进行处理并作图,进行显著性分析。运用Design Expert 8.061 中的Box-behnken 中心试验设计对试验结果进行分析并作图。
2 结果与分析
2.1 标准曲线制作
按照“1.2.3 多糖测定”绘制标准曲线,回归曲线方程为Y=14.23 4X-0.013,R2=0.997 8,呈良好的线性关系,线性范围为0.01~0.10 mg/mL。
标准曲线见图1。
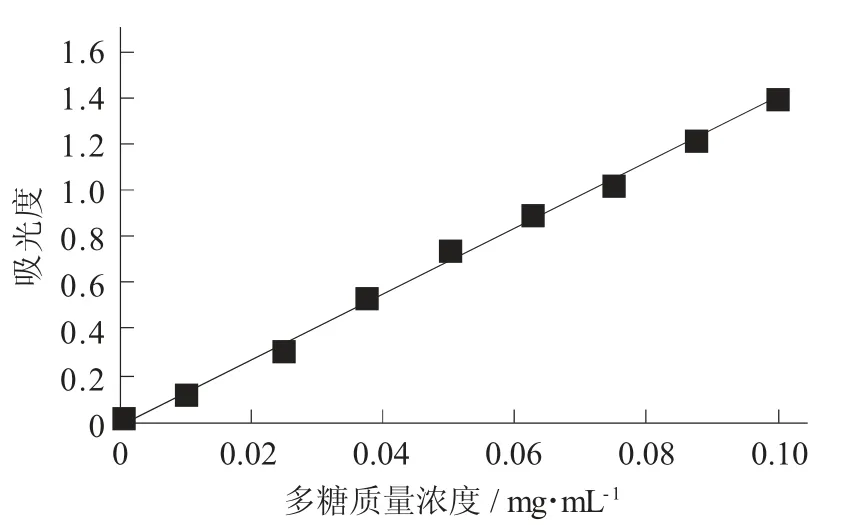
图1 标准曲线
2.2 单因素试验分析
超声功率对桦褐孔菌多糖得率的影响见图2。
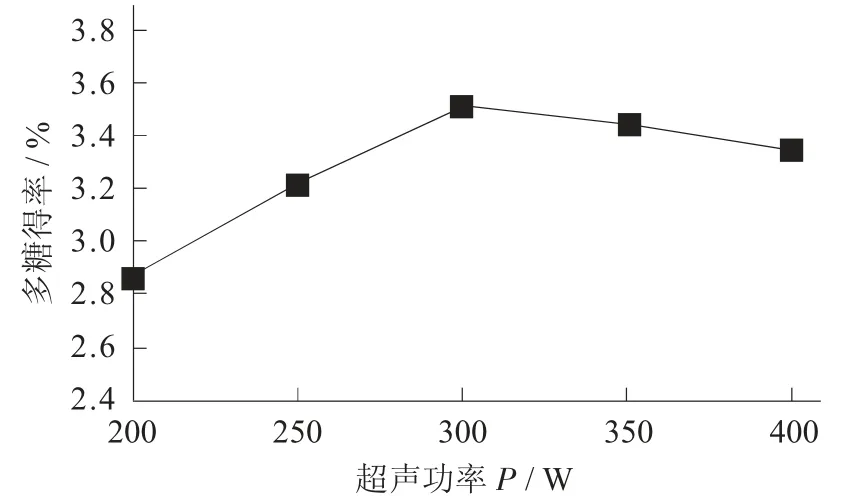
图2 超声功率对桦褐孔菌多糖得率的影响
由图2 可知,超声功率对桦褐孔菌菌丝体多糖得率的影响较大,随着超声功率的增加,多糖得率逐渐上升,超声功率为200~300 W 时,多糖得率增加显著,在300 W 时达到最大值,300~400 W 时可能由于功率过高,多糖链断裂,使多糖得率下降[13]。因此,超声功率300 W 为最佳的工艺参数。
超声时间对桦褐孔菌多糖得率的影响见图3。
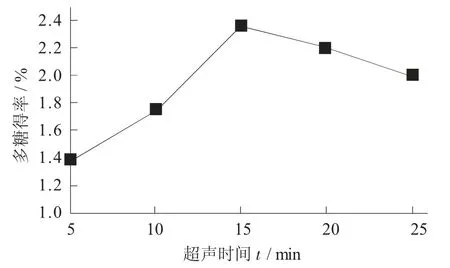
图3 超声时间对桦褐孔菌多糖得率的影响
由图3 可知,随超声时间的增加,多糖得率缓慢上升,在超声时间为15 min 时达到最大,之后缓慢下降,可能由于时间延长,超声波对糖有降解作用。因此,超声时间15 min 为最佳工工艺。
酶添加量对桦褐孔菌多糖得率的影响见图4。
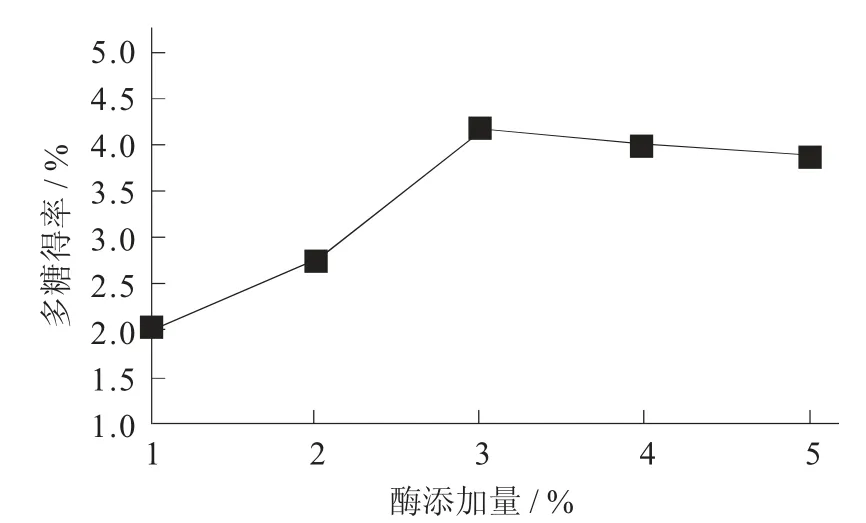
图4 酶添加量对桦褐孔菌多糖得率的影响
由图4 可知,酶添加量对多糖得率有显著影响。在酶添加量为1%~3%时,随着酶添加量的增加,多糖得率逐渐上升,当酶添加量为3%时得率为最大,超过3%后得率开始下降,原因在于底物量一定,而酶已饱和。因此,酶添加量3%为最佳工艺参数。
料液比对桦褐孔菌多糖得率的影响见图5。
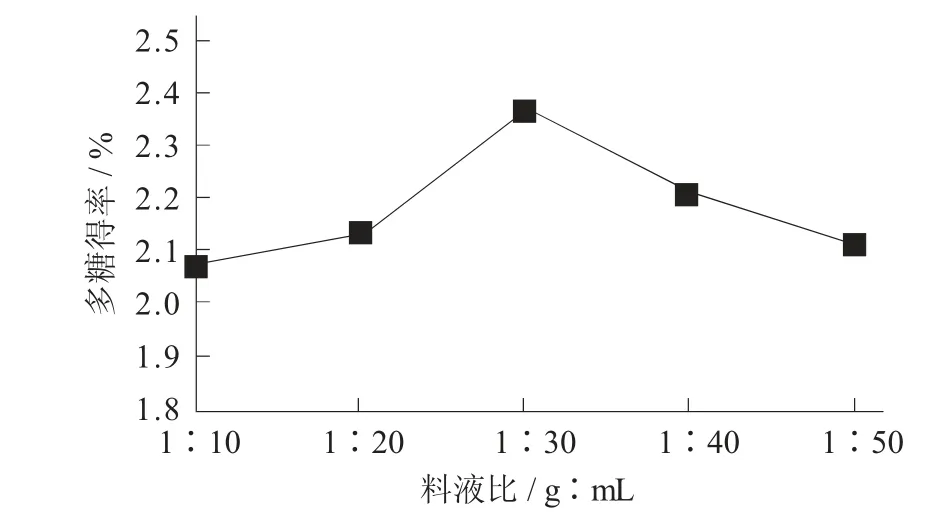
图5 料液比对桦褐孔菌多糖得率的影响
由图5 可知,料液比为1∶10~1∶30 时多糖得率逐渐增加,在1∶30 时达到最大,之后多糖得率逐渐下降,这可能是因为增加溶剂使酶浓度降低,导致多糖得率下降。因此,料液比1∶30 为最佳工艺参数。
浸提温度对桦褐孔菌多糖得率的影响见图6。
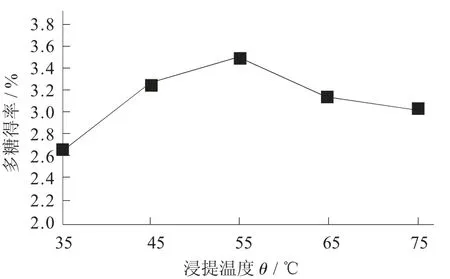
图6 浸提温度对桦褐孔菌多糖得率的影响
由图6 可知,不同浸提温度对多糖得率有极显著影响。随着温度的升高,多糖得率逐渐变大,在55 ℃时达到最大值,之后增加温度,多糖得率反而逐渐下降,原因可能是温度升高,酶蛋白变性,酶活力减弱,使多糖得率下降。因此,浸提温度55 ℃为最佳工艺参数。
2.3 响应面法试验结果及分析
2.3.1 响应面试验结果
以多糖得率为响应值,固定料液比为1∶30(g∶mL),超声时间为15 min 的条件下,以超声功率(A)、酶添加量(B)、浸提温度(C)为自变量,采用Box-behnken 进行试验。
酶-超声波提取的Box-behnken 试验见表2。

表2 酶-超声波提取的Box-behnken 试验
使用Design Expert 对数据进行方差分析和多元回归拟合,得出响应值(Y)对A、B、C 的二次多项回归模型为:

2.3.2 回归模型分析
回归方差分析见表3。
由表3 可知,用上述回归方程描述各因素与响应值之间的关系,表明该模型回归显著,具有统计学意义;并且该模型的R2=0.965 1,调整决定系数为0.920 1,说明该模型与实际试验拟合较好,92.01%以上的响应值能用所建模型解释[14];信噪比13.181远大于4,说明信号充足,可应用于分析和提取工艺参数;失拟项p=0.279 8,大于0.05,失拟检测无显著性,表明未知因素对试验干扰较小[15],具有较高可靠性。模型一次项二次项均达到较显著程度,说明试验的3 个因素对响应面值不是简单的线性关系[16-18],且影响多糖得率的因素主次为C>A>B,即浸提温度>超声功率>酶添加量。
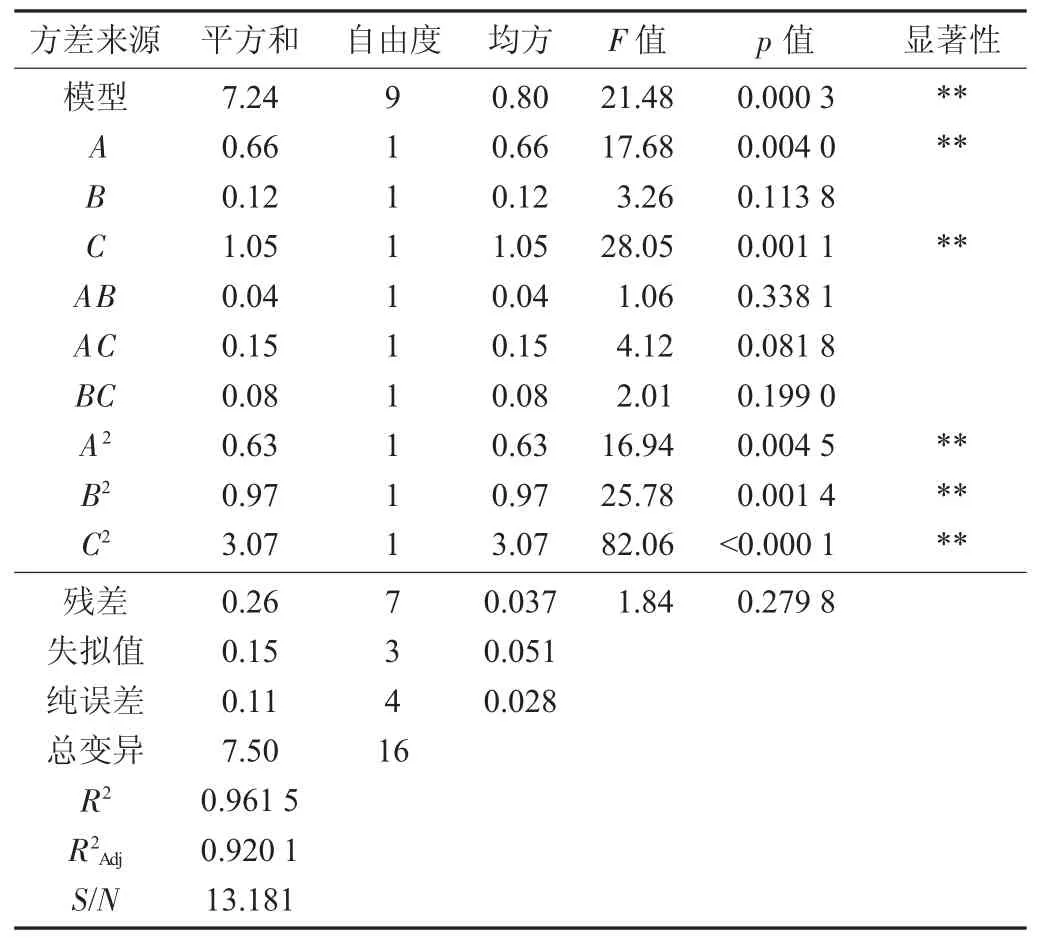
表3 回归方差分析
2.3.3 等高线图和响应曲面
各因素对桦褐孔菌多糖得率影响的三维响应面图见图7。
由图7 可知,考查的3 个因素两两交互作用均比较显著[19]。由图7(a)~(b)可知,当浸提温度为55 ℃时,超声功率与酶添加量的交互作用对多糖得率的曲面较陡峭,影响显著;由7(c)~(d)可知,当酶添加量为3%时,超声功率与浸提温度的交互作用对多糖得率的曲面很陡峭,等高线呈椭圆形,影响显著;由图7(e)~(f)可知,当超声功率为300 W 时,酶添加量与浸提温度的交互作用对多糖得率的曲面较陡峭,影响显著。

图7 各因素对桦褐孔菌多糖得率影响的三维响应面图
2.3.4 验证试验
利用Box-behnken 设计对响应面试验结果进行优化,试验预测的最佳工艺为超声功率321.46 W,酶添加量3.05%,浸提温度52.43 ℃,多糖得率4.436%。在实际操作的过程中,将超声功率调整为300 W,酶添加量调整为3%,浸提温度调整为55 ℃,进行3 次重复试验验证,提取液中多糖得率为4.421%,与理论预测值较接近,表明响应面法优化工艺的可靠性较高。
3 结论
通过单因素试验和响应面法试验优化桦褐孔菌多糖的提取工艺,利用Box-behnken 设计优化最佳工艺进行验证试验,得到其最佳工艺为超声功率300 W,超声时间15 min,酶添加量3%,料液比1∶30(g∶mL),浸提温度55 ℃,在此条件下的多糖得率为4.421%,且试验重复性较好。该提取工艺通过纤维素酶和超声波协同作用来提高桦褐孔菌多糖的得率,有利于提高桦褐孔菌多糖的利用价值,为桦褐孔菌后续食品开发提供试验依据。
