宫腔镜下诊刮电切术和冷刀切除术治疗子宫内膜息肉的临床效果分析
2022-06-16王丽娟
王丽娟
南京市江宁医院,江苏南京 211100
子宫内膜息肉属于妇科常见病,可出现在子宫任何部位,息肉大小不等且形状不规则,不仅对女性身体健康造成不良影响,引起患者白带异常、腹痛、阴道不规则出血,而且随着病情的迁延,容易引发患者出现其他类型妇科疾病[1-2]。子宫内膜息肉传统治疗方式为刮宫术,其操作会对机体造成较大的损伤,术后容易出现感染、子宫穿孔等并发症,无法对隐匿性息肉或者较深息肉进行彻底清除,而随着医疗技术的不断发展,宫腔镜技术在妇科诊治中得到广泛的应用,为子宫内膜息肉的临床治疗提供了更多的选择[3-4]。鉴于此,该研究为探究宫腔镜下不同手术操作方式在子宫内膜息肉病症中的应用效果,方便选取2019年9月—2020年9月于该院进行诊治的子宫内膜息肉患者216例,分析两组患者手术治疗效果,现报道如下。
1 资料与方法
1.1 一般资料
方便选择该院收治的子宫内膜息肉患者216例,采用单盲分组方式分为对照组与研究组,每组108例。对照组年龄26~55岁,平均年龄(36.14±2.45)岁;病程7~46 d,平均病程(24.13±3.96)d;单发性息肉68例,多发性息肉40例。研究组年龄27~53岁,平均年龄(36.22±2.41)岁;病程8~44 d,平均病程(24.23±3.87)d;单发性息肉72例,多发性息肉36例。两组一般资料对比,差异无统计学意义(P>0.05),具有可比性。研究获得医院伦理委员会批准。
纳入标准:均经临床检查、B超、X线等影像学检查,确诊为子宫内膜息肉,符合疾病相关诊断标准[5];认知功能正常;无手术禁忌证;患者明确研究内容且自愿参与。排除标准:恶性肿瘤者;严重器质性病症者;凝血功能障碍者;妊娠期或者哺乳期女性;未能全程参与研究者;精神疾病者。
1.2 方法
两组患者均于月经结束后7 d内接受入院分组治疗,术前常规检查身体,检测并记录患者心肝肾功能、凝血功能等相关指标,麻醉方式均为静脉麻醉,以膀胱截石位展开手术操作,并选择浓度为0.9%的生理盐水溶液作为膨宫液,膨宫压设置范围为90~100 mmHg,消毒、铺巾后对宫颈进行扩张,根据分组方式对患者施以对症治疗,其中对照组采用宫腔镜下诊刮电切术,具体操作:借助宫腔镜对患者子宫内膜息肉的形态予以详细地观察,确认大小后选择合适的刮匙,利用刮匙将息肉刮出,电切操作则以环形电极自息肉基底实施切除,并借助负压吸宫方式彻底清除内膜息肉。
研究组采用宫腔镜下冷刀切除术,具体操作:选择HEOS冷刀进行操作,在宫腔镜辅助下观察患者子宫息肉形态,顺沿息肉基底进行切除,操作中需要注意对息肉周围组织的清理,并借助负压吸宫操作保证彻底祛除息肉组织。
两组患者术中均需保留息肉组织将其送检,术后均接受抗感染治疗,叮嘱患者保持外阴部位的清洁,30 d内避免性生活,注意阴道出血等异常情况。
1.3 观察指标
比较两组患者手术指标、治疗效果、复发率与并发症等情况。手术指标包括手术时间、术中失血量、术后阴道出血时间以及住院时间。治疗效果以患者术后6个月的子宫内膜厚度与术后1个月的子宫螺旋动脉血流状态(搏动指数与阻力指数)进行评估。复发率随访患者术后1年的病情情况进行评估。并发症主要包括脏器损伤、感染、子宫穿孔以及宫腔粘连。
1.4 统计方法
采用SPSS 22.0统计学软件进行数据分析,计量资料符合正态分布,表达方式为(±s),组间差异比较采用t检验;计数资料的表达方式为[n(%)],组间差异比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者手术指标比较
研究组患者在手术时间、术中失血量、术后阴道出血时间以及住院时间方面短于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组患者手术指标比较(±s)Table 1 Comparison of surgicalindicators between the two groups of patients(±s)
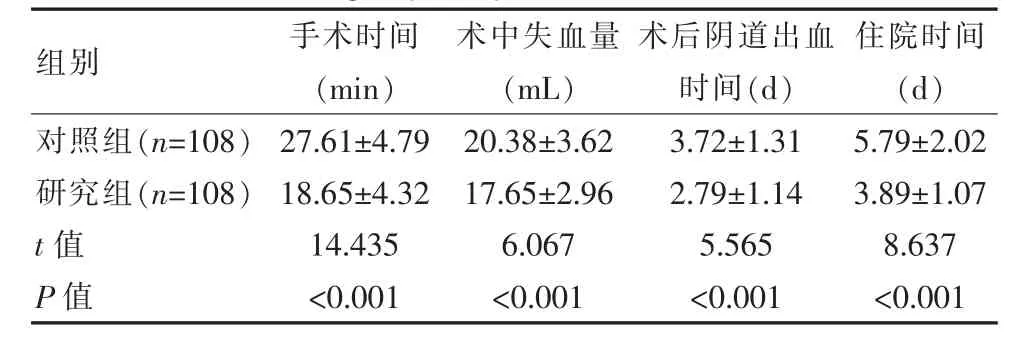
表1 两组患者手术指标比较(±s)Table 1 Comparison of surgicalindicators between the two groups of patients(±s)
组别 手术时间(min)术中失血量(mL)术后阴道出血时间(d)住院时间(d)对照组(n=108)研究组(n=108)t值P值27.61±4.79 18.65±4.32 14.435<0.001 20.38±3.62 17.65±2.96 6.067<0.001 3.72±1.31 2.79±1.14 5.565<0.001 5.79±2.02 3.89±1.07 8.637<0.001
2.2 两组患者复发率与并发症比较
研究组患者病症复发率与并发症发生率均低于对照组,差异有统计学意义(P<0.05)。见表2。
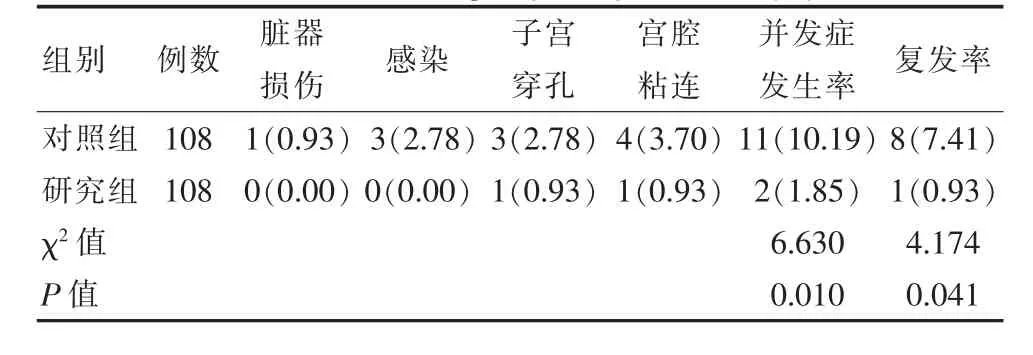
表2 两组患者并发症发生率与复发率比较[n(%)]Table 2 Comparison of complication rate and recurrence rate between the two groups of patients[n(%)]
2.3 两组患者治疗效果比较
研究组患者在子宫内膜厚度与子宫螺旋动脉血流状态均明显优于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组患者子宫内膜厚度与子宫螺旋动脉血流状态比较(±s)Table 3 Comparison of endometrialthickness and blood flow status of uterine spiralartery between the two groups(±s)
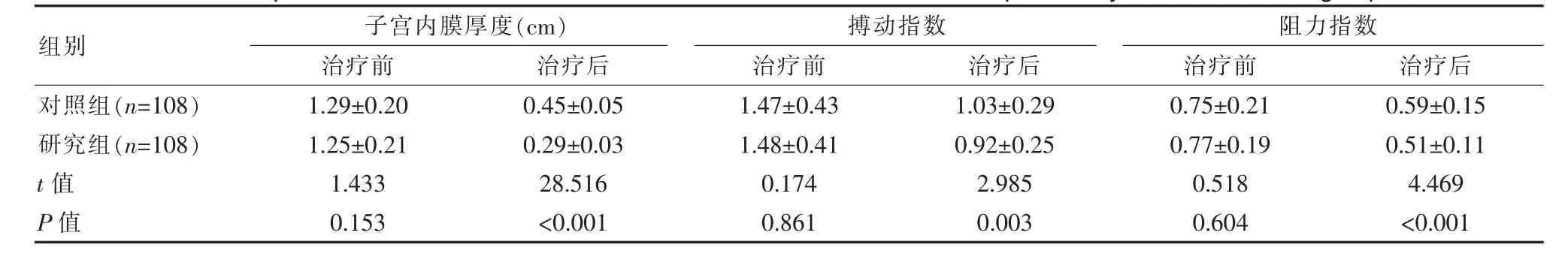
表3 两组患者子宫内膜厚度与子宫螺旋动脉血流状态比较(±s)Table 3 Comparison of endometrialthickness and blood flow status of uterine spiralartery between the two groups(±s)
组别子宫内膜厚度(cm)治疗前 治疗后搏动指数治疗前 治疗后阻力指数治疗前 治疗后对照组(n=108)研究组(n=108)t值P值1.29±0.20 1.25±0.21 1.433 0.153 0.45±0.05 0.29±0.03 28.516<0.001 1.47±0.43 1.48±0.41 0.174 0.861 1.03±0.29 0.92±0.25 2.985 0.003 0.75±0.21 0.77±0.19 0.518 0.604 0.59±0.15 0.51±0.11 4.469<0.001
3 讨论
子宫内膜息肉作为一种子宫内膜病变,多因子宫内膜局部过度增生引起,具有较高的发生率,其多数息肉属于良性病变,临床症状以子宫异常出血为主,常发生于孕龄期与绝经后的女性群体[6-7]。首次发现子宫内膜息肉无需急于手术治疗,可观察其生长状态,部分直径较小的息肉可随着月经自然脱落或者消退,无症状息肉恶变可能性较低[8-9];而对于引起异常子宫出血的子宫内膜息肉患者则应及时对症进行确诊,利用宫腔镜手术将其病理组织送检,及时为患者提供科学的临床治疗方案[10-11]。宫腔镜下各类子宫内膜息肉切除术是目前子宫内膜息肉治疗的首选治疗方式,具有微创、操作简单、恢复快以及预后效果好等优势,而在宫腔镜下,如何选择合适的医疗器械提升子宫内膜息肉临床治疗效果,成为妇科疾病热议的话题[12-13]。宫腔镜下诊刮电切术在宫腔镜辅助下为患者进行息肉刮取,并借助电极环、电探针等能量器械对患者子宫内膜息肉进行切除操作,可以有效清除患者子宫内膜息肉,改善患者临床症状[14];但操作相对用时较长,其治疗中使用的医疗器械可能对子宫内膜造成热损伤与电损伤,影响患者子宫内膜形态与功能[15-16]。宫腔镜下冷刀切除术其优势在于“冷刀”,操作过程中没有高频电或者射频等能量器械,尽可能降低患者子宫内膜的损伤,其操作在无能量作用下切缘碳化,可以为手术治疗的安全性提供保障,为术后检查提供更为高质量的病理组织切片,更适用于具有生育需求的女性患者[17-19]。黄素艳等[20]研究中表明,子宫内膜息肉患者应用宫腔镜下冷刀治疗方式其术后复发率为2.38%,明显低于应用宫腔镜下诊刮电切术组别的数据(P<0.05);该次研究中,研究组患者术后复发率为0.93%,其数据明显低于对照组(P<0.05);该研究在术后病症复发率方面的数据与黄素艳等研究结果具有一致性,说明宫腔镜下冷刀切除术可以明显改善患者术后临床症状,避免病症的复发,有助于控制患者情况。
综上所述,子宫内膜息肉患者应用宫腔镜下冷刀切除术,相对于宫腔镜下电切术其临床治疗效果更具优势,可以改善患者手术指标,对降低患者术后并发症发生率与复发率具有积极意义。
