壳聚糖/海藻酸钠自修复水凝胶的制备与性能
2022-06-16耿志杰于珊曾志文黄骏国翠平鲁道欢裴大婷
耿志杰, 于珊, 曾志文, 黄骏, 国翠平, 鲁道欢, 裴大婷
(1.广东省科学院生物与医学工程研究所, 广东 广州 510316; 2. 国家医疗保健器具工程技术研究中心, 广东 广州 510500)
水凝胶是由亲水的单体或亲水的聚合物分子链交联形成的三维网络结构,能够吸水溶胀而不溶解,在生物医用领域得到广泛的应用[1-4]。其中,天然高分子水凝胶具有亲水性、良好的生物相容性和生物降解性等优异性能,天然高分子水凝胶的研究日益受到人们的关注[5-7]。天然高分子水凝胶因与细胞外基质极其相似的性质和微环境,在药物释放、组织工程等方面的应用潜力逐渐突显[8-11]。基于天然高分子水凝胶在生物医用领域显著的应用潜力,寻求一种简单温和可控的制备工艺构筑水凝胶至关重要。
近年来,以壳聚糖(chitosan,CS)、海藻酸盐等这些廉价易得的原料为代表的天然多糖凝胶获得了较多关注。壳聚糖分子链上有大量的氨基和羟基等反应活性基团,具有较好的生物相容性、抑菌性和生物降解性,壳聚糖的这些特性使其成为制备生物医用材料的理想原料[12-15]。海藻酸钠(sodium alginate, SA)是天然的线性高分子,因其良好的生物相容性、生物降解性、无毒性、低免疫原性等优良性能被广泛地应用在生物医用领域[16-20]。但由于海藻酸钠分子链的羧基活泼性有限,常需要使用其他小分子试剂提高羧基活性,影响其生物相容性,从而影响其应用,对海藻酸钠进行功能化改性是拓展海藻酸钠应用范围的必然趋势[21-22]。
本研究以自带抑菌性能的壳聚糖和无毒的海藻酸钠为原料,设计了一种温和的反应工艺获得点击交联水凝胶。首先将海藻酸钠氧化获得醛基化的海藻酸钠,使其具有更高的化学反应活性,然后室温条件下将CS和氧化海藻酸钠(oxidized sodium alginate, OSA)溶液混合即得到快速交联的水凝胶。该凝胶制备过程简单,成胶时间可调,无须额外添加小分子交联剂,提高了水凝胶的生物安全性。该自修复水凝胶具有良好的生物相容性、明显的抑菌性能和促创面愈合效果,有望用于细胞培养、创面修复、药物释放、组织工程等领域。
1 材料与方法
1.1 试剂与仪器
1.1.1 试剂
CS:分析纯,脱乙酰度95%,黏度100~200 mPa·s,aladdin;SA:分析纯,黏度(200±20) mPa·s,aladdin公司;高碘酸钠(NaIO4):分析纯,天津市福晨化学试剂厂;冰乙酸、无水乙醇、乙二醇:分析纯,麦克林试剂公司;小鼠胚胎成纤维细胞株(NIH-3T3):中国科学院上海细胞库;荧光素双醋酸酯(FDA):分析纯,上海联迈生物工程有限公司;CCK-8: APExBIO公司;无菌磷酸盐缓冲溶液(PBS)、DMEM培养基、胎牛血清(FBS):分析纯,Gibco公司; 大鼠:SPF级,南方医科大学动物实验中心。
1.1.2 实验仪器
电子天平:ME204E/02,梅特勒-托利多仪器(上海)有限公司;傅里叶变换红外光谱仪:Nicolet IS10,美国赛默飞;冷冻干燥机:FD-1C-50,北京博医康实验仪器有限公司;桌面型扫描电子显微镜:ProX,荷兰飞纳公司;旋转流变仪:MCR302,奥地利Anton Paar;拉力试验机:KJ-1065A,东莞市科建检测仪器有限公司;酶标仪:Spark,瑞士Tecan公司;CO2无菌培养箱:MCO-170AICUVL-PC,日本松下;倒置荧光显微镜:DMI8德国 Leica。
1.2 实验方法
1.2.1 OSA的制备
称取10 g SA分散于100 mL无水乙醇中磁力搅拌形成悬浊液,将与SA等物质的量(9.89 g)的NaIO4加入100 mL纯水中形成均匀的水溶液,然后将两者混合室温条件下避光反应6 h后加入与NaIO4等物质的量的乙二醇终止反应0.5 h,然后将反应混合液倒入大量的无水乙醇中沉析,弃上清液后将下层的沉淀物倒入透析袋(截留分子量3500),去离子水中透析3 d,最后收集透析液冷冻干燥得到纯化的 OSA。
1.2.2 CS-OSA点击交联水凝胶的制备
称取1 g 的CS,将其溶于50 mL 1% 的冰乙酸溶液中,常温下磁力搅拌配成质量分数2%的CS溶液,然后用NaOH调溶液的pH 值接近中性得到CS 溶液;称取2 g OSA 溶于20 mL去离子水中,常温下磁力搅拌配成质量分数10%的 OSA 溶液。将 CS 和 OSA 溶液分别以4∶1和2∶1的体积比快速充分混合均匀即得到 CS-OSA 水凝胶,分别记作Gel-1、Gel-2。
1.3 测试与表征
1.3.1 ATR-IR测试
对冷冻干燥的CS-OSA凝胶样品,采用傅里叶变换红外光谱仪在4 000~500 cm-1测量范围内进行光谱扫描。
1.3.2 SEM测试
对冷冻干燥的CS-OSA凝胶样品的断面喷金处理后,采用桌面型扫描电子显微镜在5 kV加速电压条件下观察样品的表面形貌。
1.3.3 流变性测试
采用旋转流变仪的震荡模式,选用8 mm转子(PP08),振幅扫描在10 rad/s 的频率下,应变扫描范围0.1%~100%,确定凝胶的线性粘弹区,在线性粘弹区,固定应变1%, 频率扫描范围0.1%~100% 测定水凝胶的储能模量(G′)和损耗模量(G″)。固定频率为10 rad/s,连续交替进行低应变(1%)-高应变(100%)扫描,4个循环震荡振幅扫描测试。
1.3.4 拉伸性能测试
将凝胶切成长25 mm、宽10 mm、厚4 mm的长条形试样(湿态凝胶),采用拉力试验机以2 mm/min的拉伸速率测试其拉伸性能。
1.3.5 溶胀度和体外降解测试
CS-OSA凝胶各个样品冷冻干燥后称取凝胶质量m0,将各凝胶样品浸泡在pH 7.4的缓冲溶液中,间隔一定时间取出凝胶用滤纸拭去表面多余的水分并称重,直到凝胶质量不再继续增加认为达溶胀平衡,称取质量ms。凝胶的平衡溶胀度=(ms-m0)/m0。凝胶达溶胀平衡后每隔1 d取出各凝胶样品,用滤纸拭去表面多余的水分并称重,质量记作mt,用凝胶的质量损失率表征凝胶的降解行为,凝胶的质量损失率(%)=(ms-mt)/ms×100。
1.3.6 体外细胞培养实验
水凝胶与NIH 3T3细胞共培养,采用细胞计数kit-8(CCK-8)法,利用酶标仪测吸光度[23],评估凝胶材料的细胞毒性和细胞的存活率。在无菌的48孔板中制备凝胶样品,用75%的酒精浸泡凝胶样品消毒处理,然后用无菌PBS 缓冲液泡洗几次彻底洗净残留的酒精。将500 μL(1×104个细胞)细胞悬液注入已处理好的凝胶样品孔中作为测试组,500 μL(1×104个细胞)细胞悬液注入无凝胶的孔中作为对照组,500 μL 不含细胞的培养基注入无凝胶的孔中作为空白组。将培养板放在CO2无菌培养箱(37 ℃,5% CO2)中培养1、3、5 d,分别用含10% CCK-8的细胞培养基500 μL 注入各个孔中继续孵育1 h,用酶标仪在540 nm 测各个孔溶液的吸光度计算细胞的存活率,细胞存活率(%)=(D测试组-D空白组)/(D对照组-D空白组)×100,其中,D测试组、D对照组、D空白组分别为测试组、对照组、空白组的吸光度值。然后用倒置荧光显微镜观察细胞经荧光素二乙酸酯(fluorescein diacetate, FDA)活细胞染色剂染色后的形貌。
1.3.7 抑菌性能测试
抑菌实验采用大肠杆菌和金黄色葡萄球菌,参考Zou等[24]的方法。实验前将制备的水凝胶样品紫外光照消毒处理,然后将等质量的凝胶测试样分别与大肠杆菌和金黄色葡萄球菌在37 ℃ 培养箱共培养48 h作为测试组,未放置凝胶样品的培养菌液同样条件下培养48 h作为对照组,用酶标仪测610 nm吸光度,计算细菌菌落数量,然后将测试组和对照组的菌液分别稀释到合适的浓度,将其接种到琼脂培养基平板上,37 ℃ 培养箱中培养12 h观察测试组和对照组菌落的生长情况。
1.3.8 皮肤创面愈合测试
选用SPF级S-D雄性大鼠(每只重200~250 g)作为实验对象,将大鼠麻醉,脊背两侧剃毛,用无菌手术剪在背中部脊柱两侧全层皮肤各剪一个10 mm 的圆形创面,止血处理后随机分组备用。用水凝胶样品覆盖创面,3M压敏胶包扎创面作为实验组;对照组创面不作处理,用3M压敏胶包扎创面。定期观察实验组和对照组大鼠创面的愈合情况。本实验获得广东省质量监督医疗保健器具检验站伦理审查委员会的批准(2021009)。
2 结果
2.1 CS-OSA水凝胶的红外光谱图
对比图1中CS、OSA、Gel-1、Gel-2 谱图可看出,CS 谱图中在3 324 cm-1出现了N-H 和O-H 宽而强的伸缩振动吸收峰,1 597 cm-1处出现了N-H的弯曲振动吸收峰,OSA 谱图中在1 608 cm-1出现了醛羰基的对称振动吸收峰。而Gel-1、Gel-2谱图中在3 324 cm-1和1 597 cm-1处消失了CS 上N-H 的特征峰,1 608 cm-1处消失了OSA 上醛羰基的特征峰,在1 553 cm-1处出现了新的吸收峰,这归属于-N=C 的伸缩振动,表明CS 上的氨基与OSA 上的醛基发生了席夫碱反应,产生了亚胺键,说明CS-OSA 水凝胶的成功制备。
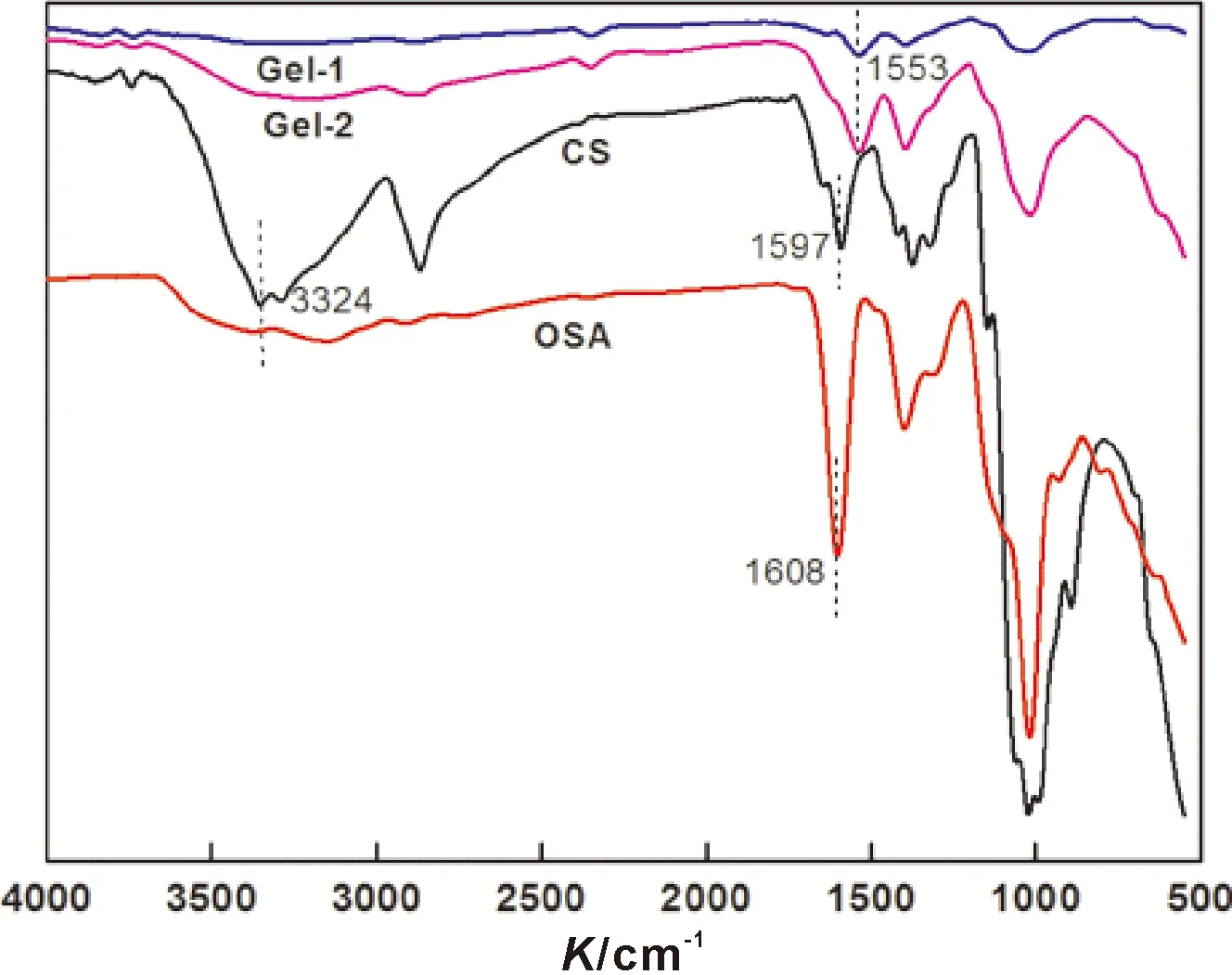
图1 凝胶的红外光谱图
2.2 水凝胶的微观形貌
在CS 和OSA 体系中,CS 上的氨基和OSA 上的醛基发生席夫碱反应生成亚胺键形成交联结构,同时CS 分子和OSA 分子间也可能有氢键作用形成交联结构,亚胺键和氢键作用促使自交联水凝胶快速形成。从图2中可以看到,CS-OSA 水凝胶具有三维网络结构,图2B较图2A的网孔致密且网孔较大说明改变CS 和OSA 的比例可以调节CS-OSA 凝胶的网络结构。交联体系中增加OSA 的量使得交联体系中醛基的量增多,CS-OSA 水凝胶的交联点增多,从而水凝胶的网孔结构更均匀致密。
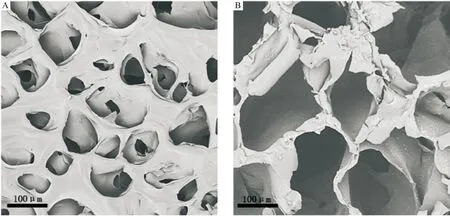
A:Gel-1 凝胶的SEM图;B:Gel-2 凝胶的SEM图
2.3 CS-OSA水凝胶的形成机理及成胶效果
采用倒置小瓶法测试了CS-OSA 凝胶在室温下的成胶时间,将CS 溶液与OSA 溶液分别以确定的体积混合,一定时间后倒置反应瓶,如果混合液30 s 内不流动则认为样品由溶液状态转成了凝胶状态,此时的时间记为凝胶时间。测试结果表明CS 溶液与OSA 溶液混合后均能快速的形成凝胶,Gel-1 的成胶时间约8 s,Gel-2 的成胶时间约5 s,体系中OSA 增多,成胶时间缩短。这归因于OSA 增多,体系中有更多的醛基与CS上的氨基发生反应。图3A展示了CS-OSA 水凝胶形成机理示意图,图3B展示了Gel-1 和 Gel-2 的成胶效果。
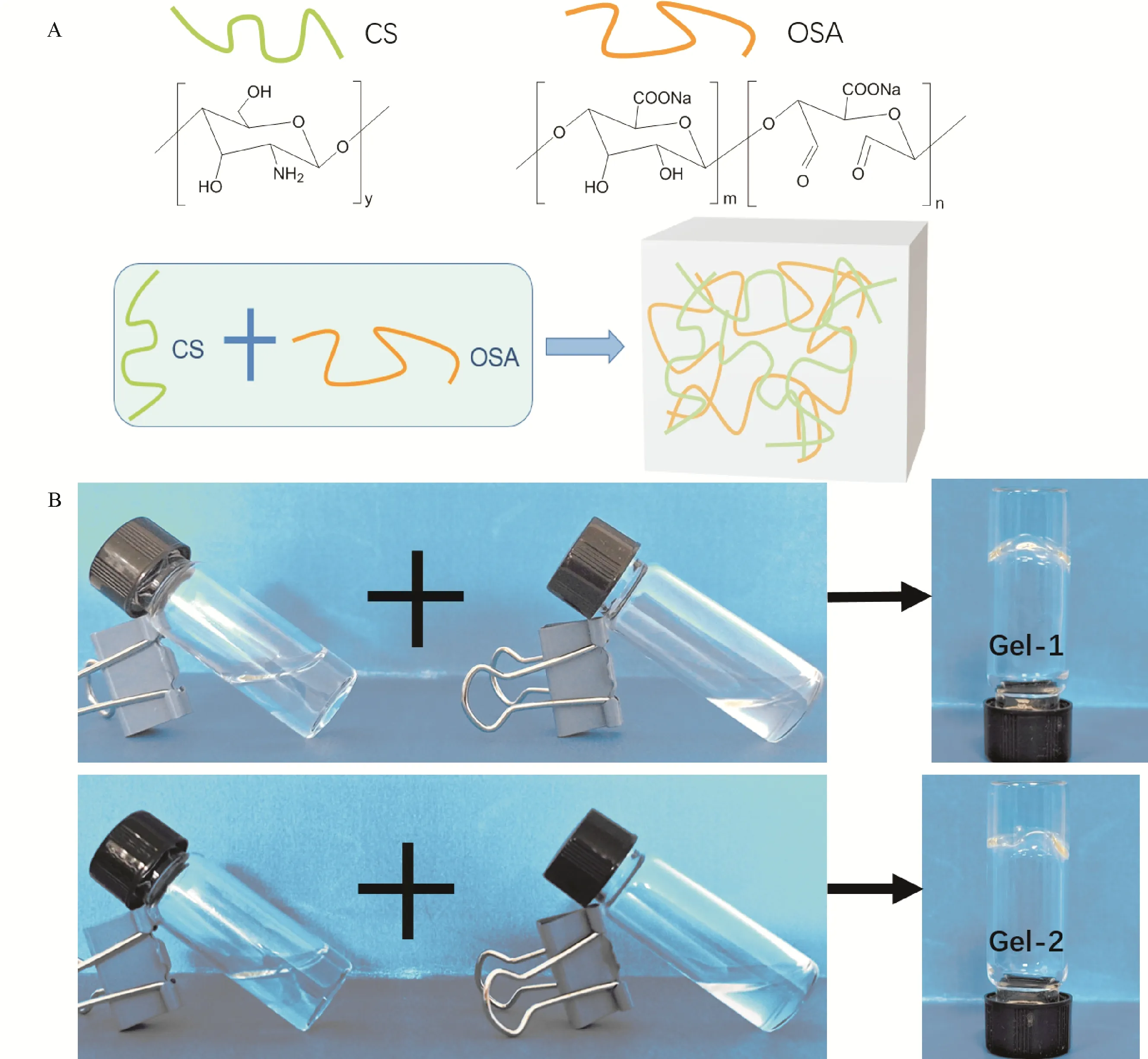
图3 CS-OSA水凝胶的成胶机理示意图A及成胶图B
2.4 CS-OSA水凝胶的溶胀和体外降解性能
从图4可见,Gel-1和Gel-2水凝胶在PBS中的溶胀度分别高达95和76,表明CS-OSA水凝胶具有明显的吸水溶胀性能。凝胶内部网络的交联结构直接影响凝胶的溶胀行为,Gel-2较Gel-1凝胶内部交联密度大,则Gel-2凝胶的饱和溶胀度较低。随着降解时间的延长,CS-OSA凝胶的质量损失逐渐增大,降解初期Gel-1和Gel-2凝胶的质量损失率相差不大,降解15 d后,降解曲线开始变缓,Gel-1凝胶较Gel-2凝胶降解多,质量损失率分别达74%、61%,这表明凝胶的内部交联结构对凝胶的降解有显著的影响,凝胶网络结构交联密度大的降解速度较慢,适当提高凝胶网络结构的交联密度可提高凝胶的稳定性。
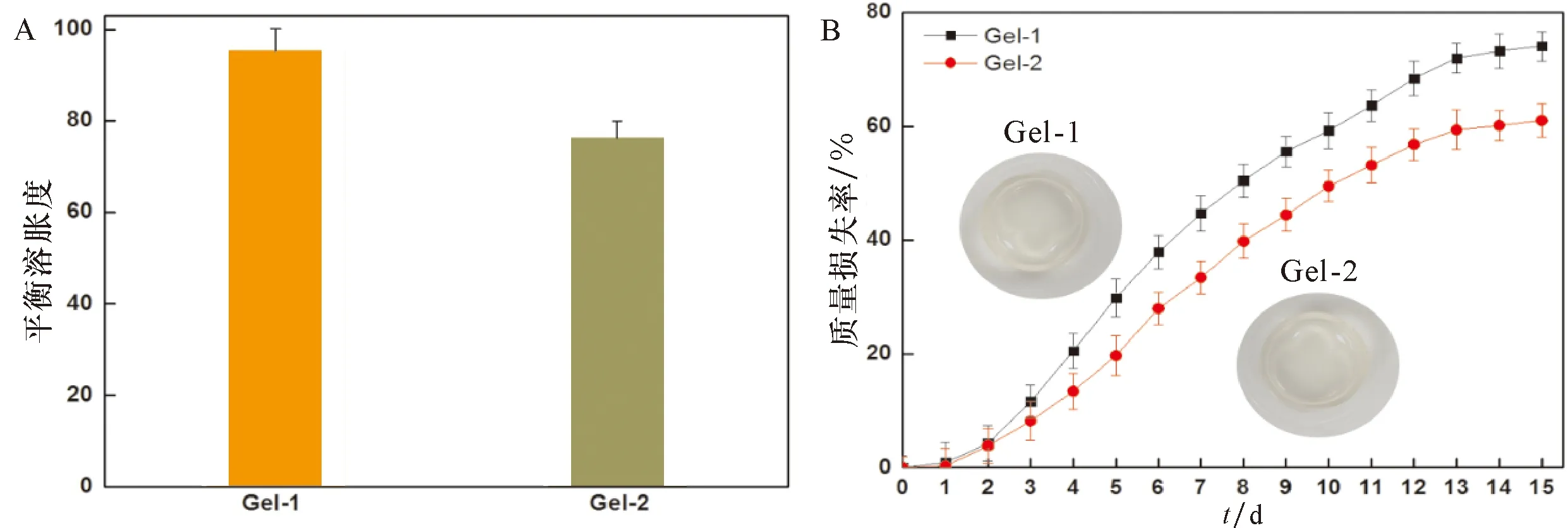
A:凝胶的平衡溶胀度;B:凝胶质量损失率
2.5 CS-OSA水凝胶的流变性能和自修复性能
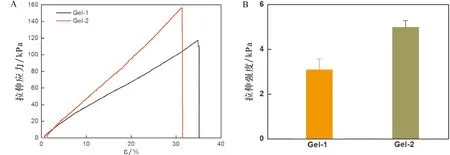
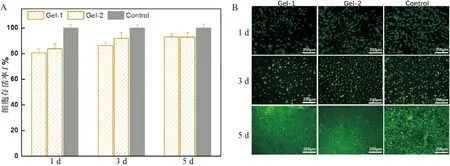
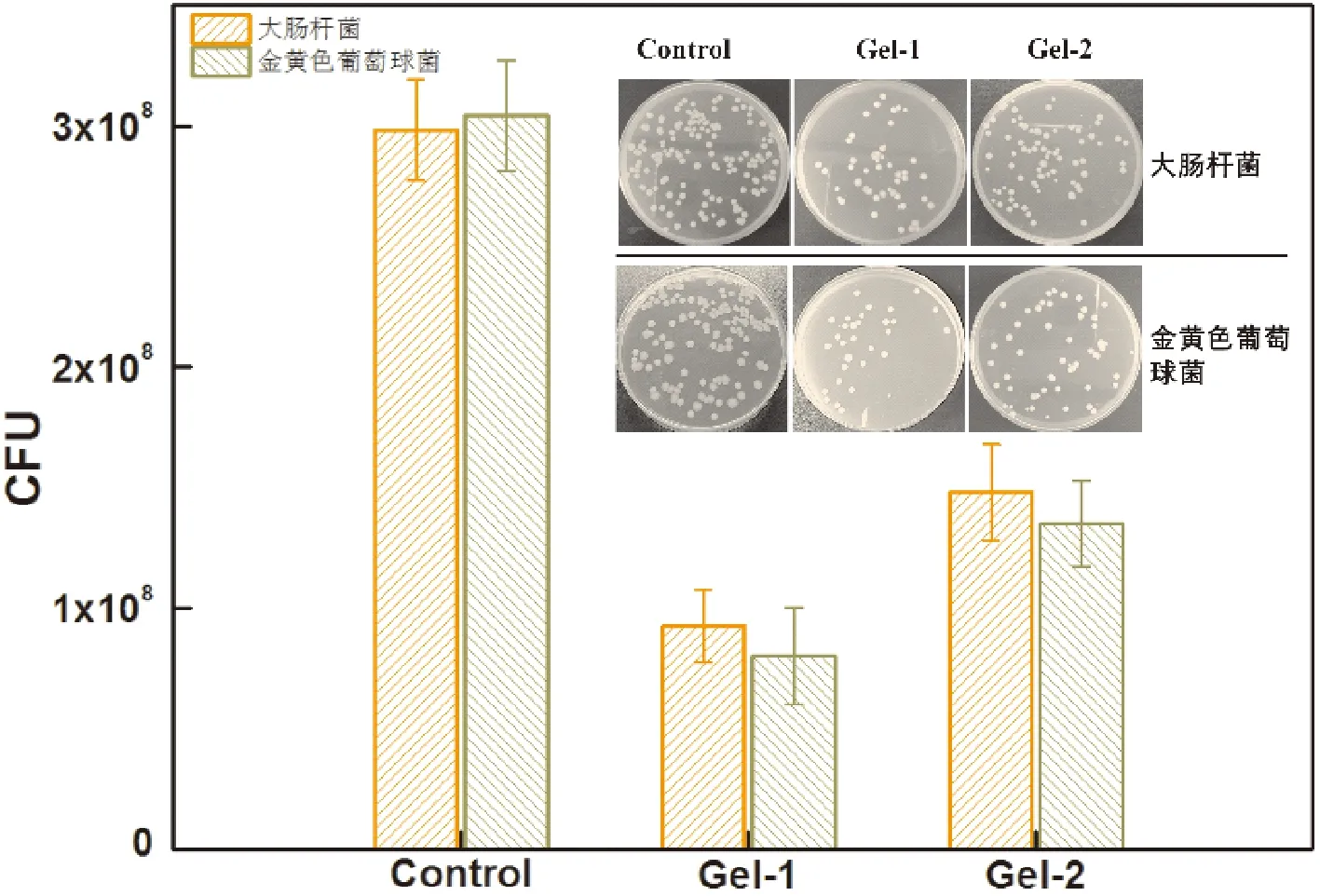
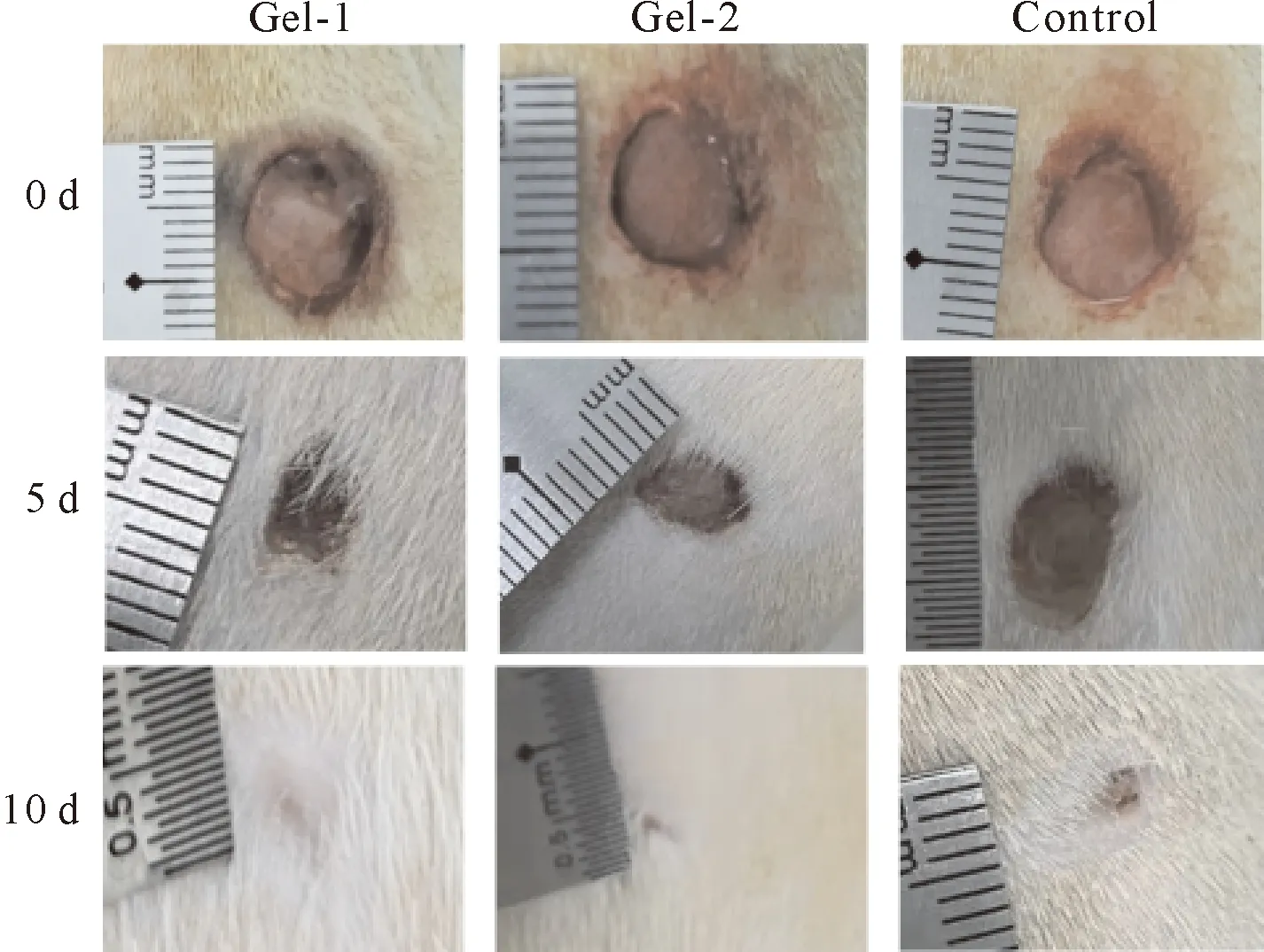
采用流变学测试评价了CS-OSA 水凝胶的流变性能。图5A是振幅扫描,在低应变范围内G′>G″,表明该阶段是凝胶态,随着应变的增加G′明显降低,G″明显增大,当G′ A: 振幅扫描; B: 频率扫描; C: Gel-1凝胶循环震荡振幅扫描; D: Gel-2凝胶循环震荡振幅扫描; E: 凝胶的自修复效果图 CS-OSA凝胶体系中凝胶的网络交联结构可能是影响凝胶拉伸性能的主要因素,由图2可知Gel-1 和Gel-2 的网络交联密度不同,图6显示Gel-1 和Gel-2 的拉伸性能有差异。图6A显示Gel-1 和Gel-2 应变均能达到30%以上不断裂,断裂时Gel-1较Gel-2 达到的应变更大,而Gel-2 的拉伸应力更大,随着应变的增加Gel-2 较Gel-1 的拉伸应力增加的更快。图6B显示Gel-2 较Gel-1 的拉伸强度更高,Gel-2表现出更好的拉伸性能,这说明CS-OSA凝胶体系中醛基含量增多,凝胶的机械性能增强,这与图2中Gel-2 有更均匀致密的网孔结构结果相一致。CS-OSA凝胶具有一定的拉伸强度,这为CS-OSA凝胶在创面修复方面的应用奠定基础。 A:拉伸应力-应变关系; B:拉伸强度 图7是NIH 3T3细胞在CS-OSA 水凝胶表面培养的增殖情况,Gel-1 和Gel-2 的凝胶培养的细胞存活率均在80% 以上(图7A),这说明CS-OSA 水凝胶没有明显的细胞毒性。随着培养时间的延长,细胞的存活率体现出上升趋势,培养5 d时细胞的存活率已达到90% 以上,CS-OSA水凝胶表现出良好的生物相容性,一方面因为制备凝胶的原料是生物相容性好的多糖,另一方面因为成凝胶方式温和,无须额外添加小分子交联剂。为了进一步验证CS-OSA水凝胶良好的生物相容性,分别对在凝胶表面培养了1、3、5 d的细胞进行活细胞染色后荧光显微镜下观察的结果如图7B,实验组和对照组(阴性对照)的细胞数量和形态没有很明显的差别,这与细胞存活率的结果一致,更有力的证实了CS-OSA 水凝胶无明显的细胞毒性,具有良好的生物相容性,CS-OSA 水凝胶具有良好的生物医用前景。 A:细胞存活率; B:荧光显微镜图 从图8中可以看出,与对照组(阴性对照)相比,Gel-1 和Gel-2 水凝胶对大肠杆菌和金黄色葡萄球菌均有明显的抑制作用,且Gel-1 凝胶较Gel-2 凝胶表现出更强的抑菌效果,CS-OSA 水凝胶的抑菌性能很可能是CS 起主要作用,由于Gel-1 凝胶较Gel-2 凝胶中CS的占比大,抑菌效果更好。 图8 CS-OSA水凝胶的抑菌性能 图9显示在手术第5天时实验组(Gel-1 和Gel-2)创面已明显变小,而对照组创面愈合不太明显,第10天时实验组创面已基本愈合完全,对照组创面尚未完全愈合。实验证明Gel-1 和Gel-2对皮肤创面均具有很好的促愈合效果。CS-OSA水凝胶具有很好的生物相容性和一定的抑菌效果,水凝胶含有大量的水分为皮肤创面提供良好的湿性愈合环境,为CS-OSA体系水凝胶在创面修复护理方面的应用奠定基础。 图9 CS-OSA水凝胶促创面愈合效果 随着湿性愈合理论的发展,水凝胶由于能够吸水溶胀,具有很高的含水量使得其在创面愈合方面的应用优势逐渐突显。生物相容性良好的水凝胶应用在创面愈合、护理,尤其是慢性创面的临床治疗、护理上,不仅可以提供湿性愈合的微环境,还能够阻隔创面与外界的直接接触,防止交叉感染,从而促进创面的愈合。 本研究以廉价易得的天然多糖CS和SA为原料,通过对SA改性获得具有双醛基结构的OSA,利用席夫碱反应制备点击交联水凝胶。通过控制CS和OSA的配比调节水凝胶的成胶时间和成胶性能。文中采用CS和OSA溶液以4∶1和2∶1的体积比分别制备凝胶Gel-1 和Gel-2并表征其性能,在温和环保的实验条件下无须额外添加小分子交联剂即可快速成胶,最快可10 s内成胶,凝胶具有良好的快速自修复性能。水凝胶的微观形貌具有均匀的孔状三维网络结构。体外细胞培养和抑菌性能测试证实该体系水凝胶不仅具有良好的生物相容性,对大肠杆菌和金黄色葡萄球菌还具有明显的抑菌效果,动物创面模型实验证明该体系凝胶能促进皮肤创面愈合。通过对比,Gel-1 和Gel-2凝胶性能各有优缺,溶胀性、降解性和抑菌性能Gel-1 凝胶优于Gel-2凝胶,而机械性能Gel-2凝胶表现更出色,后续可根据应用场景选择Gel-1 和Gel-2凝胶。CS-OSA水凝胶有望开发成抗菌支架或创面敷料等产品,为壳聚糖等多糖基水凝胶在生物医用领域的进一步应用奠定基础。 综上所述,本研究设计的多糖体系的CS-OSA水凝胶制备方法简单温和,能够快速成胶,具有良好的生物相容性、抑菌性能、自修复性能和适宜的力学强度。为了更好地应用,可以进一步研究该体系凝胶的渗液吸收能力、组织黏附性能和促进细胞迁移能力,以及作为支架材料负载药物或者生长因子等性能,为后续进一步探索多糖体系水凝胶在生物医用领域的应用拓展提供依据,以期获得更理想的功能性水凝胶敷料。 作者贡献声明 耿志杰:提出研究思路、设计实验,实验操作,统计分析数据,撰写论文;于珊:实验过程监督,论文初审和修改;曾志文:论文修改和建议;黄骏:数据分析和建议;国翠平:数据分析和建议;鲁道欢:文献检索、统计数据;裴大婷:统计数据。 利益冲突声明 本研究未受到企业、公司等第三方资助,不存在潜在利益冲突。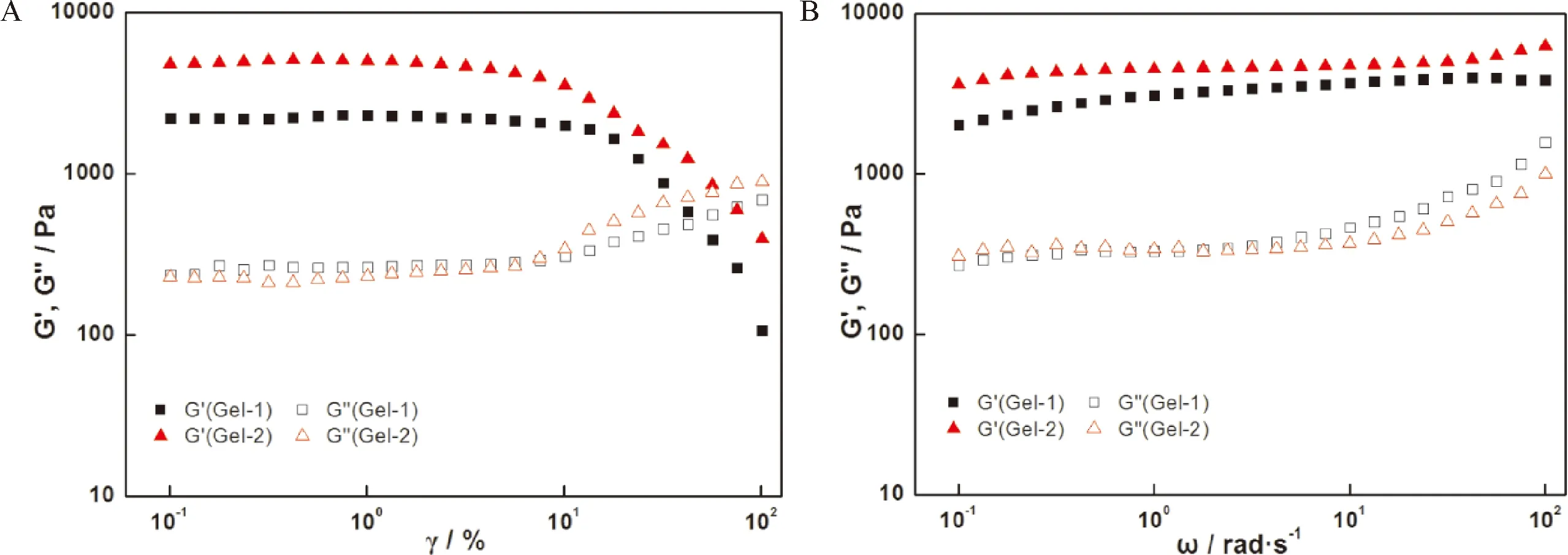
2.6 CS-OSA水凝胶的拉伸性能
2.7 CS-OSA水凝胶的体外细胞培养和细胞毒性
2.8 CS-OSA水凝胶的抑菌性能
2.9 CS-OSA水凝胶的促创面愈合性能
3 讨论
