在APAP、TAA诱导的肝细胞药物性损伤中C/EBPβ对FXR的调控机制
2022-06-16洪炜龙彭旭云杨帆李攀龙梁伟铖叶志强
洪炜龙, 彭旭云, 杨帆, 李攀龙, 梁伟铖, 叶志强*
(中山大学 附属第三医院 1.急诊科; 2.生物治疗中心, 广东 广州 510630)
急性肝损伤(acute liver injury,ALI)是指在各类致病因素作用下,患者在短时间内肝功能急剧恶化,致使肝功能严重紊乱[1]。目前药物性肝损伤(drug-induced liver injury,DILI)在ALI中所占比例最大,DILI发病区域、患病率及死亡率正逐年上升,且以对乙酰氨基酚(acetaminophen,APAP)引起的DILI最为常见[2-4],DILI是急需解决的医学难题之一[5]。已有研究表明法尼醇X受体(Farnesol X receptor,FXR)可能作为DILI过程中的关键基因发挥抗炎作用,减轻肝脏损伤。但FXR在DILI过程中的细胞分子调控机制尚不明确。因此,本研究拟通过硫代乙酰胺(thioacetamide,TAA)及APAP诱导小鼠正常肝细胞系AML12致药物性损伤,并探究该过程中的分子调控机制。
FXR/NR1H4是一种胆汁酸(BA)受体,在胆汁酸代谢以及甘油三酯等脂质代谢调控中起着重要作用。它属于核受体(NR)超家族中的一员,是依赖于配体激活并且在肝脏中高表达的一类核转录因子[6-8]。FXRα(NR1H4)和FXRβ(NR1H5)是存在于哺乳动物中的2个FXR基因,其中FXRα在肝脏中的表达量最高并且能同时编码FXRα1-4四种同工型亚基与DNA区域相结合发挥作用[9-10]。FXR可以参与BA的合成以及肠肝循环,调节血糖以及脂质的稳态,受其激动剂奥贝胆酸(OCA)激活后还可治疗原发性胆汁性胆管炎。有研究发现,使用OCA激活FXR可以有效减少四氯化碳(CCl4)引起的肝细胞凋亡,减轻CCl4所致DILI[11]。FXR-/-小鼠肝原代细胞对于TNF-α以及LPS引起的炎症反应更为敏感,早期补充FXR激动剂GW4064能够显著提高IL-18的水平,同时也能增加诱导型一氧化氮合酶(iNOS)的生成,减少小鼠炎症反应的产生[12]。上述研究表明FXR可能是治疗DILI的一个潜在有效治疗靶点。
CCAAT/增强子结合蛋白β(CCAAT enhancer binding protein beta,C/EBPβ)是一类增强子结合蛋白,根据其转录起始部位的不同,可以翻译为3种亚型:LAP1、LAP2、LIP。C/EBPβ主要对胞外多种信号分子进行应答并作用于相应的靶基因;通过对信号通路的调节,C/EBPβ能在转录水平产生调节作用,如:甲基化、乙酰化、磷酸化等[13]。此外,C/EBPβ能在肝损伤后被激活,进而促进肝脏的再生,它在肝脏抗炎、抗凋亡、促进细胞增殖等方面发挥着重要的作用[14]。
基于APAP为常见诱导肝损伤的药物,本研究以此作为研究对象,寻找DILI过程中可能存在的细胞分子机制。通过生物信息学分析,发现在APAP介导的人和小鼠肝细胞损伤中,FXR的表达均明显减少;同时也发现C/EBPβ在FXR 启动子水平上有显著富集,但目前未有明确报道,所以本课题组进行了深入研究。
1 材料与方法
1.1 试剂与仪器
小鼠正常肝细胞AML12购自浙江美森(MeisenCTCC)。DMEM/F12(DF12)培养液、胰岛素-转铁蛋白-硒添加剂(ITS)购自Gibco;胎牛血清购自PAN;Lipo-3000转染试剂购自Invitrogen;TAA购自Sigma;APAP购自美仑生物;RIPA裂解液购自碧云天;RNA提取试剂盒购自新赛美;逆转录试剂盒及RT-PCR试剂购自诺维赞;抗FXR抗体(D-3)(sc-25309)、抗C/EBPβ抗体(C-19)(sc-150)购自Santa Cruz; beta-Actin抗体(T0022-50 μL)购自Affinity Biosciences;Anti-mouse IgG马抗小鼠二抗(7076S)和Anti-rabbit IgG 山羊抗兔二抗(7074S)购自Cell Signaling Technology;OCA购自Selleck,目录号S7660;pLKO载体,购自吉玛公司;细胞凋亡试剂盒购自凯基公司Cat number:KGA105-KGA108。
1.2 研究方法
1.2.1 细胞培养
每50 mL DF12培养基中添加500 μL ITS(100×)及5%胎牛血清。在5% CO2、37 ℃的培养箱中培养AML12细胞,观察细胞形态,细胞贴壁率约75%~80%时传代、接种和冻存。
1.2.2 Western blot分析
将状态良好的AML12细胞以每孔1×106接种至6孔板,共分为6组:TAA(0、13、33 mmol/L)、APAP(0、2、5 μmol/L)。过夜培养后,在处理组中加入TAA/APAP刺激24h后收样检测。弃去上清,将细胞培养板置于冰上,用PBS沿壁轻轻清洗,弃去PBS,每孔加入200 μL RIPA裂解液,冰上裂解10 min,并将裂解完全的细胞收集起来。13 000 r/min、4 ℃离心细胞裂解液10 min,弃去含细胞碎片的沉淀,收集上清至1.5 mL EP管中。使用BCA蛋白定量法对细胞裂解液进行定量,每管加入50 μL 5× loading buffer,金属浴加热10 min后样品制备完成。根据定量结果,将样品与Marker逐个加入至8% SDS-PAGE凝胶样品槽内;开始用80 V压胶待样品浓缩至水平后再改用120 V,电泳至蓝色液条带到凝胶底部为止;电泳结束后,将样品从凝胶转移到NC膜上。在转膜缓冲液中操作,电压保持在120 V,时间120 min,冰水浴完成转膜。转膜完成后取出NC膜放进5%脱脂牛奶中封闭30 min,在室温摇床上孵育。弃去牛奶,用1×TBST缓冲液洗去多余的牛奶,加入一抗,4 ℃孵育过夜。回收一抗溶液,1×TBST缓冲液洗3次膜,每次为7 min。加入二抗,室温摇床孵育2 h。1×TBST缓冲液洗3次膜,每次7 min;将ECL底物A与B以体积比1∶1混合,现配现用,尽量避光,用吸水纸吸干NC膜上的残余液,膜上滴满配好的显影液,并用凝胶成像系统曝光成像。实验独立重复3次。
1.2.3 RT-qPCR检测
分组同Western blot。使用试剂盒法提取细胞样本总RNA,微量分光光度计进行RNA定量。按照说明书完成逆转录,获得模板cDNA。根据RT-PCR检测试剂盒说明书进行实验。设置3个复孔,求平均值,通过分析 ΔΔCt值,进行定量计算,以 2-ΔΔCt法测定相关分子的 mRNA 相对表达量。实验独立重复 3 次。mRNA引物由生工Sangon Biotech公司合成,FXR的上游引物序列为5′-GCTTGATGTGCTACAAAAGCTG-3′;下游引物序列为5′-CGTGGTGATGGTTGAATGTCC-3′,C/EBPβ的上游引物序列为5′-ATCGACTTCAGCCCCTACCT-3′;C/EBPβ的下游引物序列为5′- TAGTCGTCGGCGAAGAGG-3′。
1.2.4 稳定转染细胞株构建
采用病毒转染的方法构建稳定细胞株。shRNA引物由生工Sangon Biotech公司合成,共分为3组:sh-NC组, sh-C/EBPβ#1(TGGAAGTGGCCAACTTCTA)组和sh-C/EBPβ#2(CTGACGCAACACACGTGTAAC)组。将shRNA序列构入pLKO载体中。配置转染混合液,A液:用25 μL不含血清的培养基稀释0.25 μg pMD2.G质粒,0.75 μg psPAX2质粒,1 μg目的质粒;B液:用25 μL不含血清的培养基稀释1 μL lipo3000。分别将A液与B液轻弹混匀,静置5 min后将A、B液混合摇匀并静置15 min。将状态良好的293T细胞以每孔1×106接种至6孔板,在5%CO2、37 ℃的培养箱中培养24 h后加入转染混合液。48 h后收集培养基上清即病毒液,5 000 r/min、15 min离心病毒液。AML12细胞在转染前一天接种到6孔板中,待细胞密度达到70%左右进行实验。取离心后病毒液上清与正常培养基1.5∶1混合,每1 mL混合病毒液加入1 μL polybreen (100 g/L)转染试剂。弃去AML12原有培养基,加入混合病毒液,转染48 h后加入嘌呤霉素进行筛选。筛选两代后,收集细胞蛋白及RNA以Western blot及RT-qPCR进行效率检测。
1.2.5 流式细胞学检测
分组同Western blot。AML12铺板5% CO2、37 ℃培养至密度约70%后,在处理组中加入相应浓度TAA/APAP刺激24 h,弃去上清,加入500 μL胰酶消化2 min后,加入500 μL含5%胎牛血清DF12终止消化,2 000 r/min、5 min离心收集。用PBS洗涤细胞2次并离心收集,加入500 μL Binding Buffer 将细胞悬浮,加入 5 μL Annexin V-FITC 混匀后,再加入 5 μL Propidium Iodide并混匀,室温下避光反应15 min后上机检测凋亡率。
1.3统计学方法
使用 Graph Prism 8.0软件进行统计学分析。计量资料以柱状图显示,采用t检验或 Mann-Whitney 检验进行统计推断。以P<0.05为差异有统计学意义。
2 结果
2.1 GEO数据库和启动子区转录因子ChIP-seq分析
对GSE74000数据集进行生物信息学分析,该数据集收集了APAP诱导肝损伤患者的肝脏组织、APAP处理后的HepG2和HepaRG细胞的测序结果,通过比较发现显著差异(含上调或下调)基因,使用韦恩图对分析结果取交集,发现只有FXR这个基因在3个独立的测序结果中发生变化(见图1A)。通过ENCODE数据库的ChIP-seq数据库进行分析,发现转录因子C/EBPβ可能结合FXR的启动子区域。Cistrome Data Browser是哈佛大学Shirley Liu教授开发的一款收集众多转录因子已有测序结果的网站。利用Cistrome Data Browser 对GSM427088及GSM2540286 数据集分析发现,在FXR的启动子区域C/EBPβ均有较高强度的结合峰(图1B)。此外,在The Human Protein Atlas数据库中发现C/EBPβ在人肝细胞中含量丰富,由此可见肝脏中FXR的调控与C/EBPβ有着密切的联系(图1C)。
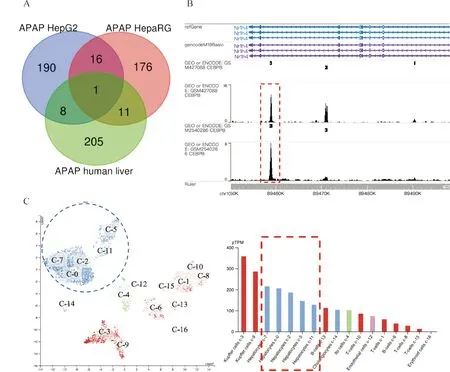
A: GEO数据库从HepG2、HepaRG细胞和人肝组织3个方面分析APAP处理下的差异表达基因;B: ENCODE数据库的ChIP-seq显示转录因子C/EBPβ与FXR启动子结合区域;C:The Human Protein Atlas数据库显示C/EBPβ在肝脏各类细胞中的表达量
2.2 TAA、APAP对小鼠正常肝细胞系AML12的FXR表达影响
采用Western blot检测AML12中FXR的蛋白表达水平,结果显示,TAA(0、13、33 mmol/L)和APAP(0、2、5 μmol/L)给药干预24 h后AML12中FXR的蛋白表达水平呈剂量依赖型减少(图2A、2B)。RT-qPCR检测小鼠正常肝细胞系AML12在TAA(0、13、33 mmol/L)和APAP(0、2、5 μmol/L)的表达情况,可见FXR在处理组均有不同程度的下调,其中APAP 5 μmol/L组表达较对照组显著下调(P<0.01,图2C、D)。
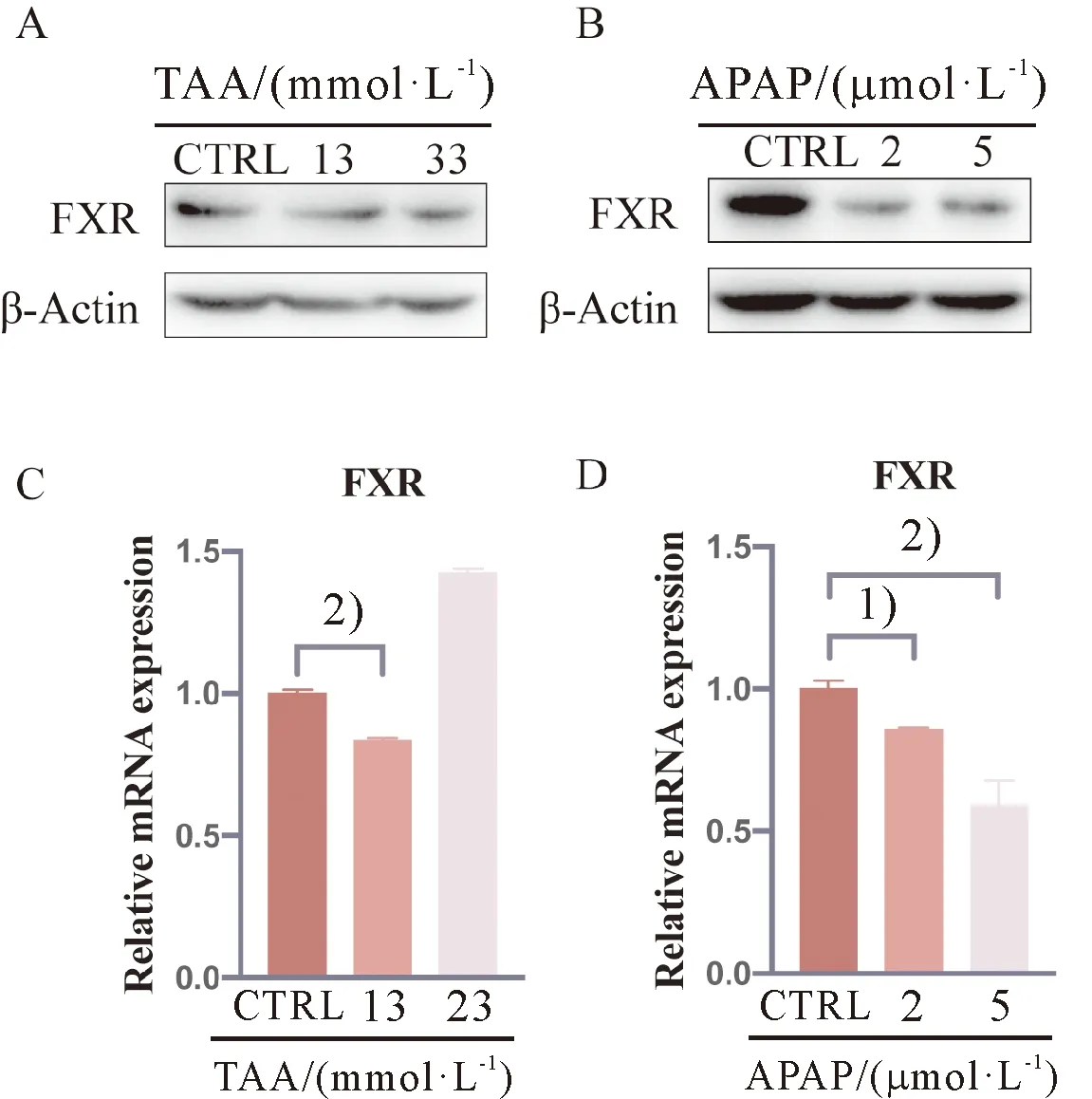
与对照组相比, 1)P<0.05; 2)P<0.01。
2.3 TAA、APAP对小鼠正常肝细胞系AML12的C/EBPβ蛋白表达影响
经Western blot检测可见,AML12在TAA(0、13、33 mmol/L)和APAP(0、2、5 μmol/L)处理24 h后,与抑制肝脏增殖相关的LAP1和LAP2均无明显变化。而在APAP组中,随着药物浓度的增加,与促进肝细胞增殖相关的LIP蛋白表达量逐渐降低(图3A)。
2.4 敲低C/EBPβ表达对小鼠正常肝细胞系AML12的FXR表达影响
Western blot检测显示,稳定敲低C/EBPβ的AML12细胞中C/EBPβ的蛋白表达水平相较于对照组有显著的降低(图3A)。此外,RT-qPCR检测可见,敲低C/EBPβ后其相关mRNA的表达水平有明显的下调,FXR的表达水平也出现相应的下调(图3B)。
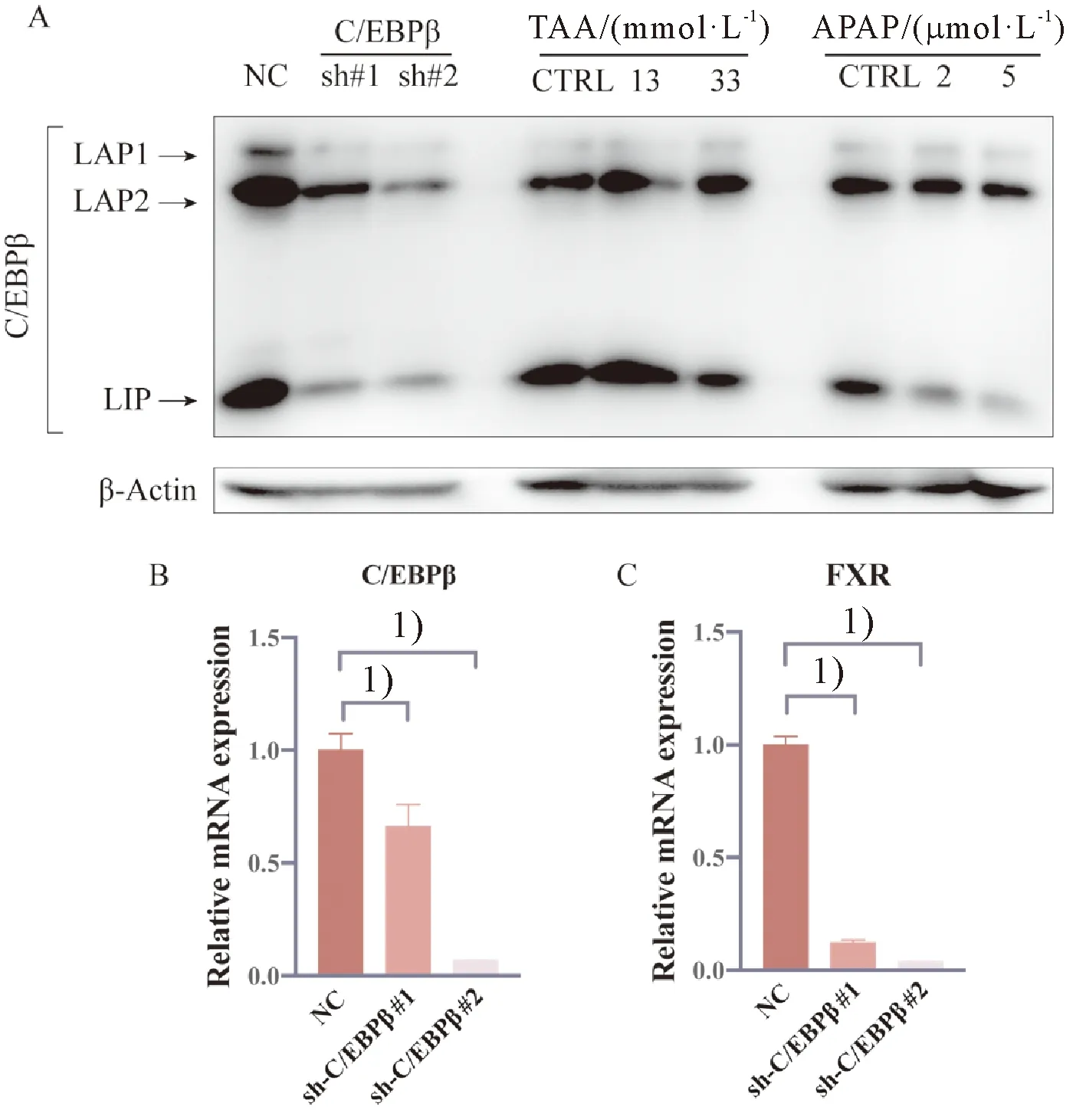
与对照组相比, 1)P<0.01。
2.5 TAA、APAP对小鼠正常肝细胞系AML12细胞凋亡的影响
基于药物的量效关系,选择不同浓度的TAA(0、13、33 mmol/L)及 APAP(0、 2、5 μmol/L)对AML12细胞进行干预,观察其对细胞凋亡的影响。处理24 h后,经流式细胞仪检测可见,TAA及APAP可呈剂量依赖性诱导AML12凋亡(图4)。
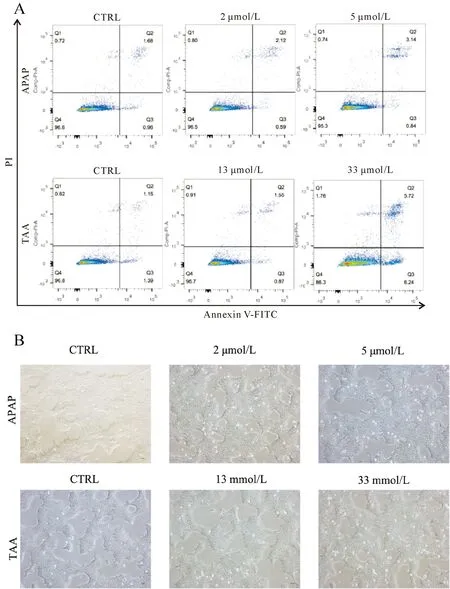
A:TAA、APAP干预AML12细胞24 h后,Annexin V-FITC/PI染色并通过流式细胞仪检测细胞凋亡率;B:TAA、APAP干预AML12 24 h后细胞状态变化(×40)
2.6 OCA可经FXR抑制PARP表达
不同浓度的OCA(0、1、2.5 μmol/L)与固定浓度的TAA(33 mmol/L)及APAP(5 μmol/L)同时对AML12处理24 h后,经Western blot检测可见,在FXR的激动剂OCA处理之后,FXR的蛋白表达水平有些许上调。同时,在两组中均可见,FXR的上调可以一定程度上抑制凋亡相关基因聚ADP-核糖聚合酶(poly ADP-ribose polymerase,PARP)的表达(图5A)。在药物引起肝损伤过程中,细胞凋亡信号机制可能为:转录因子C/EBPβ的生成减少,与FXR启动子结合的数量也相应降低,肝细胞内PARP相关凋亡系统被激活,肝细胞发生凋亡,最终引起肝损伤(图5B)。
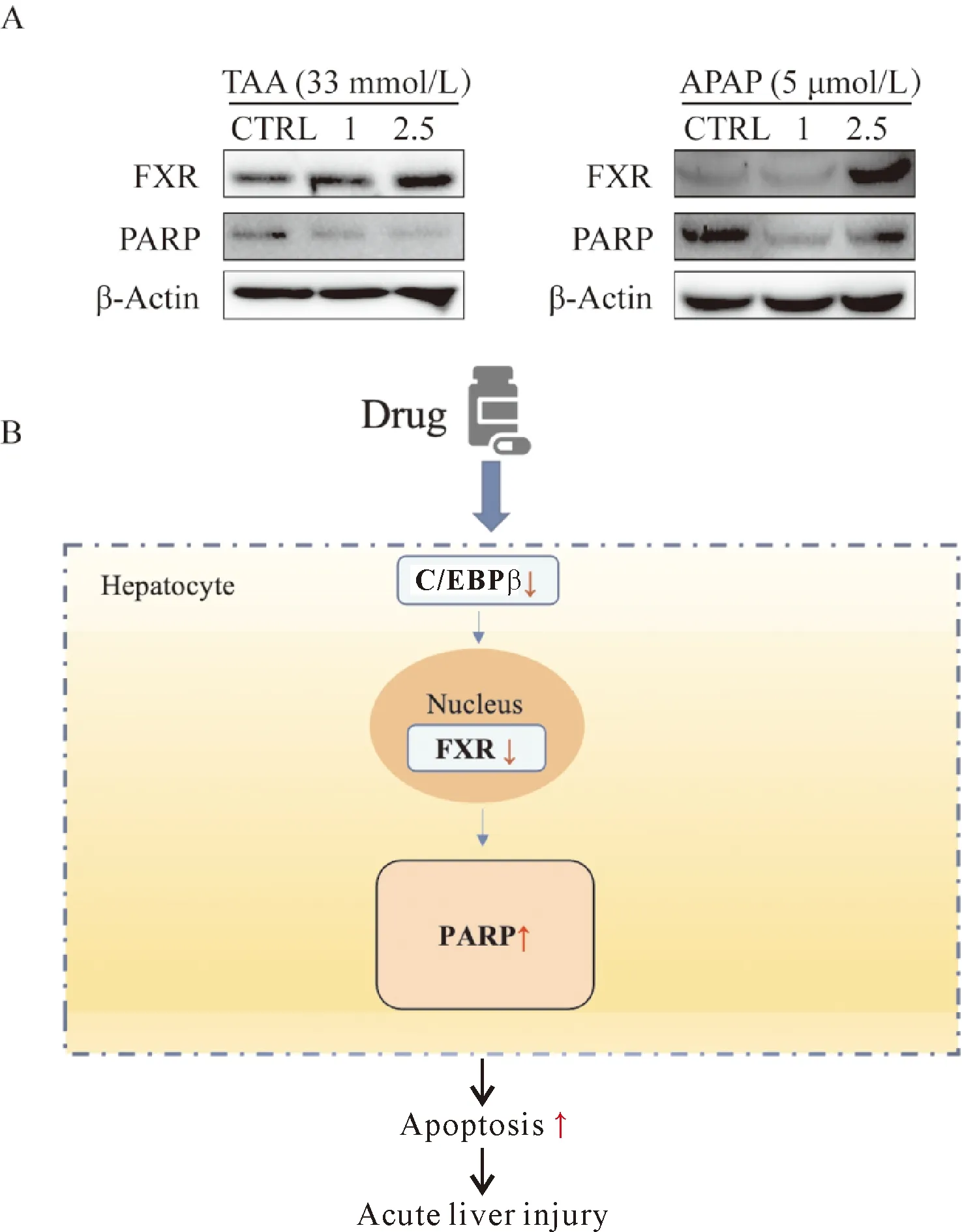
A. OCA分别与TAA、APAP同时干预AML12细胞情况下的蛋白表达;B:DILI细胞凋亡过程可能的信号机制
3 讨论
由于DILI没有相应特效药物进行治疗,在此基础上容易进展为ALI或急性肝衰竭[15],且DILI相应的分子细胞机制仍不明确,对于DILI过程中的分子调控机制的研究显得尤为重要。本研究通过生物信息学分析,以APAP诱导损伤为基础,将患者肝脏组织及具有大多数肝酶的HepG2、HepaRG细胞的测序结果进行分析发现[16],FXR是DILI过程中的重要基因。在TAA及APAP干预的AML12细胞中,本课题组发现FXR在DILI中蛋白表达水平明显下调。前人研究虽发现,FXR经OCA激活后可以减轻CCl4引起的细胞凋亡[11],但具体的调控机制并未阐明,为此本团队进行了研究。
课题组通过生物信息分析后发现,C/EBPβ与FXR的调控有着密切的联系,肝脏中富含的C/EBPβ可能与FXR的转录及后续的表达有密切关系。为了验证这一关系,通过pLKO载体构建C/EBPβ稳定敲低的AML12细胞株,Western blot及qPCR检测发现,C/EBPβ能够调控FXR的mRNA表达水平,这与前人的研究不同,有研究认为在小鼠肝癌模型中FXR的减少会引起HDAC1-C/EBPβ复合物表达减少[17],也有研究认为在CCl4诱导的慢性肝损伤中C/EBPβ-LIP可以反过来抑制FXR的肝脏再生作用[18]。对此我们认为,研究结果的不同与相应的动物细胞模型的差异有较大关系,也与C/EBPβ和FXR之间可能存在相互调控有关,但具体机制仍有待研究。此外本研究也发现,TAA及APAP使AML12药物依赖性地发生凋亡,在使用OCA对该过程进行干预后,PARP凋亡相关基因能够在一定程度下调。
有研究表明,TAA可以引起小鼠肝脏中的FXR表达显著下调[19],而这与TAA经过数个代谢阶段后最终生成的肝毒性物质TASO2有关[20],OCA可以减少TAA干预过程中小鼠PARP的相关表达[21],与本研究结果一致。另一方面,APAP在经肝脏代谢后生成NAPQI,该产物在肝脏谷胱甘肽的作用下进行解毒,当谷胱甘肽耗尽后,NAPQI与细胞内蛋白质半胱氨酸残基结合形成复合物,进一步对肝脏造成损伤[22],近期也有研究表明APAP在损伤肝脏的过程中亦激活了PARP相关系统[23]。因此,TAA及APAP引起的肝损伤机制虽不相同,但却可能存在相同的凋亡调控机制。
本研究中可能的信号机制为TAA及APAP对肝细胞进行干预后,抑制了C/EBPβ的表达,进而减少了C/EBPβ对核内FXR的调控,使得肝细胞内的凋亡系统被激活,胞内促凋亡基因表达增加,肝细胞出现病理性损伤以及功能障碍,最终导致了肝损伤的发生[24-25]。在这个过程中,被激活的也包括了PARP相关凋亡体系,PARP具有稳定基因组、修复DNA损伤、调控细胞凋亡等作用[26],它的激活标志着细胞凋亡的增多。本研究虽阐明了部分机制,但仍有问题未得到解决,如C/EBPβ对核内FXR的具体调控机制及FXR如何对PARP造成影响等。综上,DILI治疗过程中C/EBPβ可能是FXR调控凋亡的关键基因,这为未来的相关治疗提供了新的研究思路。
作者贡献声明
叶志强:提出研究思路和框架,修改论文;洪炜龙:设计实验、统计分析数据,撰写论文;彭旭云:协助实验进展;杨帆:订购所需材料;李攀龙:指导统计分析数据;梁伟铖:生信分析。
利益冲突声明
本研究未受到企业、公司等第三方资助,不存在潜在利益冲突。
