百蕊草LRR-RLKs基因的鉴定与生物信息学分析
2022-06-16张文香常子丽李芳杨香香丁波曹剑锋
张文香 常子丽 李芳 杨香香 丁波 曹剑锋


摘 要 以百蕊草(Thesium chinense Turcz)为材料,根据硝酸银诱导的转录组数据,PCR克隆到两条LRR-RLK基因,通过测序、生物信息学分析、荧光定量PCR等技术对两条基因进行分析。结果发现,两条基因全长分别为1 278 bp与2 115 bp,分别编码425和704个氨基酸,命名为TcLRR1和TcLRR2;TcLRR1与拟南芥EFR基因一致性最高,TcLRR2与水稻Xa21一致性最高;TcLRR2具有完整的LRR-RLK蛋白结构(亮氨酸重复域、信号肽、跨膜结构域、激酶域),而TcLRR1缺乏激酶域;TcLRR1与TcLRR2在非胁迫条件下的组织表达模式一致,都在叶片中表达最高。综上所述,TcLRR2可作为百蕊草抗逆相关的LRR-RLK候选基因进行后续的深入研究。
关键词 百蕊草;基因;LRR-RLK;TcLRR1;TcLRR2;生物信息学
中图分类号:Q343.1+2 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2022.09.001
收稿日期:2022-01-22
基金项目:贵州省科技厅自然科学研究基金项目(黔科合基础〔2016〕1415,黔科合基础〔2018〕1117);贵州省科技厅平台人才项目(黔教合KY字〔2017〕5790-06);贵州林业科技项目(黔科合林〔2017〕01号);贵州省教育厅生物科学一流专业项目(〔2019〕46)。
作者简介:张文香(1984—),女,河北武邑人,博士,副教授,研究方向为植物栽培与植物生理。E-mail:zwx26_2006@126.com。
*为通信作者,E-mail:caojianfeng@gznc.edu.cn。
植物中的受体主要有双元系统、受体激酶两种,广泛参与植物的生长、发育、胁迫、免疫等过程。受体激酶具有胞外区、跨膜区与胞内区三部分,根据胞外区结构的不同又可分为三种类型:含S结构域的、富亮氨酸重复的、类表皮生长因子的[1]。其中,富亮氨酸重复的类受体蛋白激酶最多,此类受体的胞外区域一般具有多个富亮氨酸重复序列,具有与配体结合的功能。目前已在多种植物如拟南芥、玉米、水稻、橘类、大豆、蔷薇科中鉴定出编码此类受体的基因,最早是在玉米中鉴定出来的[2]。
百蕊草(Thesium chinense Turcz)是檀香科(Santalaceae)多年生半寄生草本植物,具有清热解毒、解暑的功效,在我国有着悠久的被用于疾病治疗的历史。百蕊草具有较强的抗菌消炎作用,通常用于治疗炎症相关疾病,是优秀的广谱抗菌中药材,被誉为“天然抗生素”。对百蕊草粗提物和純化成分的药理作用和临床应用研究证实,百蕊草具有抗炎、镇痛、抗菌、抑制肿瘤细胞增殖等多种药理作用[3-5]。百蕊草的植物化学成分研究表明,百蕊草中含有黄酮类、生物碱、多糖等成分,其中黄酮类是其重要的指标性成分,在植物的生长、发育、繁殖和防御中起着多种生理作用。目前对于百蕊草的研究主要在栽培、代谢产物分离与提纯等方面,在分子水平对其生长调控机理的研究还较少。本研究根据喷施硝酸银(1 mmol·L-1)处理及对照转录组表达数据,筛选出了被硝酸银诱导高调表达的富亮氨酸类受体蛋白激酶基因,对其结构与功能进行分析,旨在为从分子水平研究百蕊草的次级代谢和抗逆性提供基础。
1 材料与方法
1.1 实验材料
百蕊草样品采自于贵阳市乌当区东风镇试验基地(106°81′ E, 26°64′ N),挑选野外自然生长处于初果期,长势、大小和生理状态基本一致的百蕊草植株作为实验植株,采取根、茎、叶组织,迅速冻于液氮。
1.2 实验方法
1.2.1 基因的鉴定和克隆
根据本实验室百蕊草转录组数据[6]拼接序列获得6 878 bp的序列,通过ORFFinder(https://www.ncbi.nlm.nih.gov/orffinder/)在线分析工具,预测完整的开放阅读框(Open Reading Frame),并进行blastp(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastp&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome)在线搜索比对,初步确定基因类型。对通过在线预测得知的两个较长的ORF (Open Reading Frame),分别为1 278 bp(ORF1)和2 115 bp(ORF2)进行克隆,利用 Primer Premier 5 软件设计特异引物,ORF1上游引物为 ORF1-F:5′-ATGAACAAACCCTACGTTATAG GTC-3′,下游引物为 ORF1-R:5′-TCAAATACCTGA CAGGTGGTTATCA-3′;ORF2上游引物为:5′-ATGCTCACCATGCTTGACATGCCTGC-3′,下游引物为:5′-CTACTCTCTTCCCGTGTCCTTGATAA-3′。
引物由生工生物工程(上海) 股份有限公司合成。以反转录合成的 cDNA 第 1 链为模板 进行 PCR 扩增,50 μL 的 PCR 反应体系包含 25 μL Premix PrimeSTAR HS (TaKaRa) DNA 聚合酶,上、下游 引 物 ( 10 μmol·L-1) 各 2.5 μL,cDNA 模 板1 μL,ddH2O补齐至50 μL。PCR反应程序为: 98 ℃预变性 2 min;98 ℃变性 10 s,60 ℃退火 10 s,68 ℃延伸 60 s,30 个循环;最后 68 ℃ 延伸 6 min。PCR 产物经1%琼脂糖凝胶电泳分离,切胶纯化回收。回收产物连接至pMD18-T载体,采用热激法转化至大肠杆菌DH5α感受态细胞中,筛选阳性克隆并测序。
1.2.2 RNA提取与cDNA合成
采用生工生物的UNlQ-10柱式Trizol总RNA抽提试剂盒(B511321)提取百蕊草总RNA,采用Thermo Scientific的反转录试剂盒(EP0743)进行反转录。
1.2.3 生物信息学分析
在HMMER网站https://www.ebi.ac.uk/Tools/hmmer/search/hmmscan进行结构域预测;选择http://web.expasy.org/网址中的ProtParam工具进行理化性质分析,包括分子量、等电点、亲水性、稳定性等。在http://www.detaibio.com/tools/signal-peptide.html网站进行信号肽、跨膜结构的预测,在http://www.cbs.dtu.dk/services/NetPhos/网站进行磷酸化位点预测分析。
1.2.4 进化树分析
以模式植物拟南芥LRR-RLK基因,以及TcLRR1和TcLRR2的蛋白质全长序列构建进化树,拟南芥LRR-RLK蛋白序列及构建方法与参数选择参考Wang等[7]。
1.2.5 荧光定量PCR
以初果期百蕊草的根、茎、叶cDNA为模板,以18SRNA为内参基因,选用ABI的荧光定量PCR试剂盒(B639273),在StepOne Plus型荧光定量PCR仪 (ABI, Foster, CA, USA)上进行扩增。
内参基因引物序列为:
18SRNA-F 5′ TTCTTAGTTGGTGGAGCGATTT3′
18SRNA-R 5′ CCTGTTATTGCCTCAAACTTCC3′
目的基因引物序列为:
TcLRR1-F 5′CTTTCGGGTGTCATTCCTCC3′
TcLRR1-R 5′TCTGAAAAGGTCTCTTGGGATACT3′
TcLRR2-F 5′AATAACTCTTGCCACTGTAGGGT3′
TcLRR2-R 5′ATTTCATCCGTTGGCTTCC3′
反应体系为:上下游引物(10 µM)各0.4 µL,模板cDNA 2 µL,酶(SybrGreen qPCR Master Mix)10 µL,最后加ddH2O到20 µL。扩增45个循环。
2 结果与分析
2.1 基因鉴定与分析
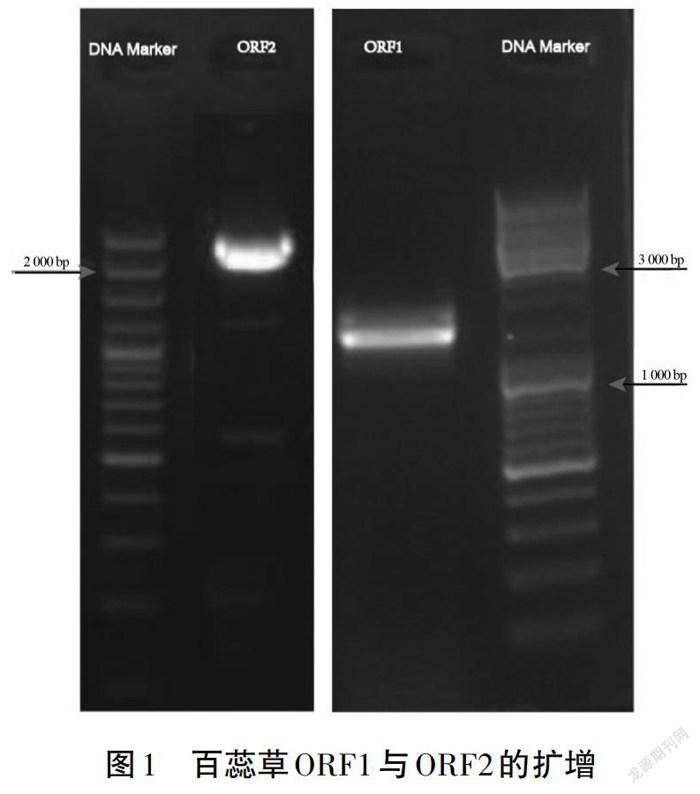
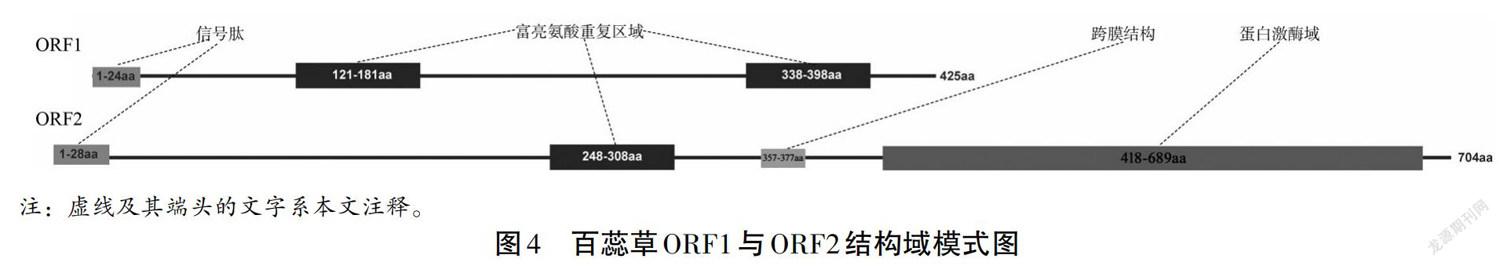
根据转录组数据拼接得到6 878 bp的序列,通过在线预测得知有两个较长的ORF (Open Reading Frame),设计PCR引物进行克隆验证,经过测序,确定两条序列分别为1 278 bp(ORF1)和2 115 bp(ORF2)(见图1),分别编码425和704个氨基酸(见图2)。将翻译得到的蛋白序列在线进行blast比对,发现ORF1的蛋白序列与拟南芥富亮氨酸类受体蛋白激酶EFR(At5g20480)、GSO1(At4g20140)、At3g47570一致性较高(见图3a);ORF2的蛋白序列与水稻的类受体蛋白激酶Xa21及拟南芥At3g47570、EFR(At5g20480)一致性较高(见图3b)。通过HMMSCAN在线分析保守结构域,发现ORF1蛋白序列分别在121aa-181aa、338aa-398aa位具有一个亮氨酸富集区域(Leucine-rich repeat),不具有激酶结构域;而ORF2蛋白序列在248-308aa具有重复亮氨酸区域,在418-689aa具有激酶结构域(protein kinase domain)(见图4)。由于兩个蛋白序列都具有富亮氨酸重复序列,因此将编码ORF1的基因命名为TcLRR1,编码ORF2的基因命名为TcLRR2。
2.2 TcLRR1/2蛋白的理化性质分析
TcLRR1的分子量为46 458.17,等电点为5.97,全长425个氨基酸,其中带负电荷的氨基酸为26个,带正电荷的氨基酸20个,脂肪系数110.75,平均亲水系数0.101,不稳定系数26.77,为稳定蛋白;TcLRR2的分子量为77 780.84,等电点为6.48,全长704个氨基酸,其中带负电荷的氨基酸68个,带正电荷的氨基酸64个,脂肪系数103.44,平均亲水系数0.064,不稳定系数33.48,为稳定蛋白。
2.3 结构预测
在线对两条基因的跨膜结构进行了预测,发现TcLRR1序列1~24位为信号肽序列,没有跨膜结构,预测其序列为胞外序列;TcLRR2序列1~28位为信号肽,357-377aa为跨膜区域,378-704aa位于膜内,29-356aa位于膜外。
2.4 磷酸化位点预测
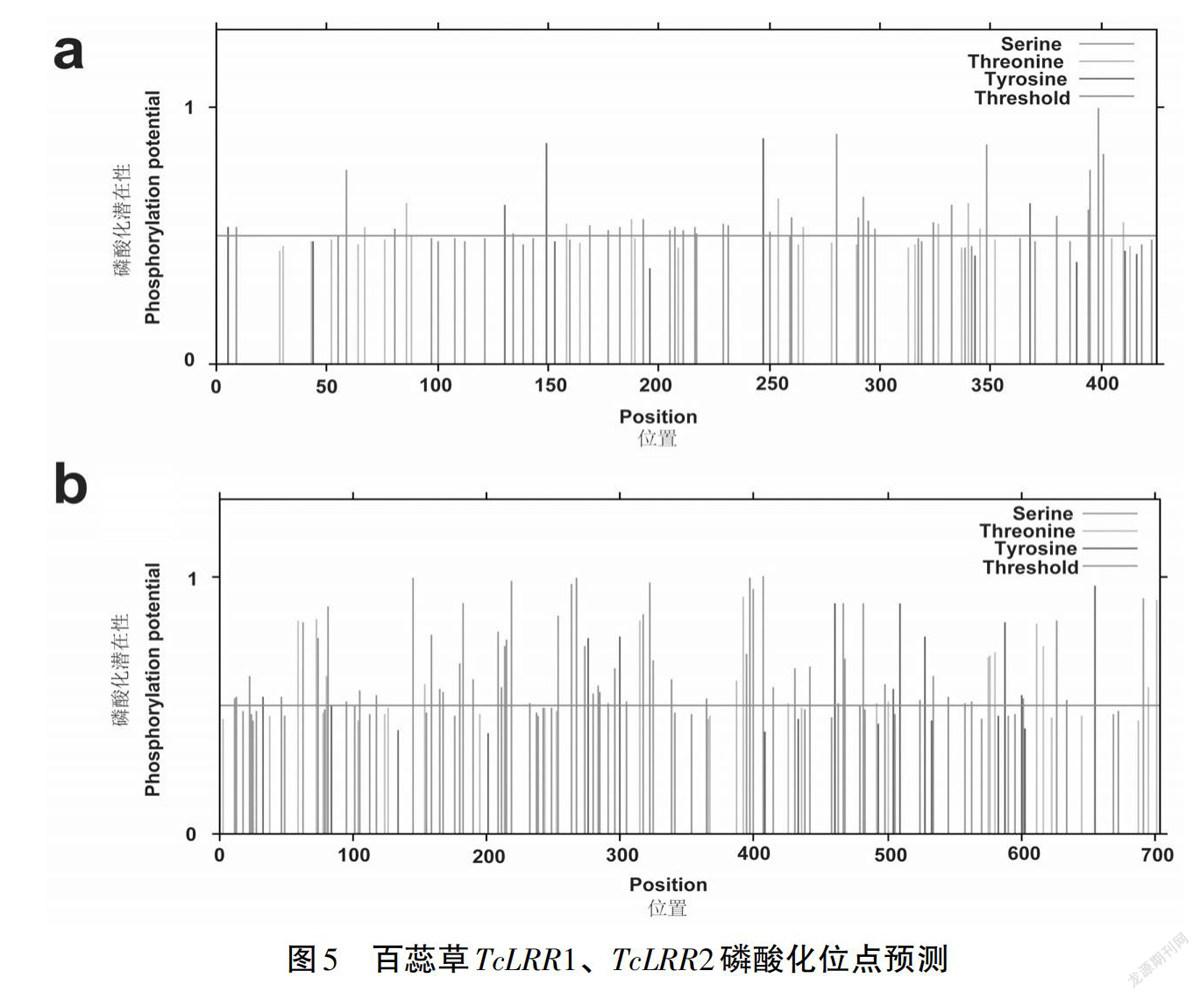
在线进行磷酸化位点预测,发现TcLRR1共具有46个磷酸化位点,其中丝氨酸(S)位点最多,为31个;其次是苏氨酸(T)位点,为10个;酪氨酸(T)位点5个(见图5a)。TcLRR2共具有89个磷酸化位点,其中丝氨酸(S)位点最多,为62个;其次是苏氨酸(T)位点,为17个;酪氨酸(T)位点10个(见图5b)。
2.5 序列比对与进化树分析
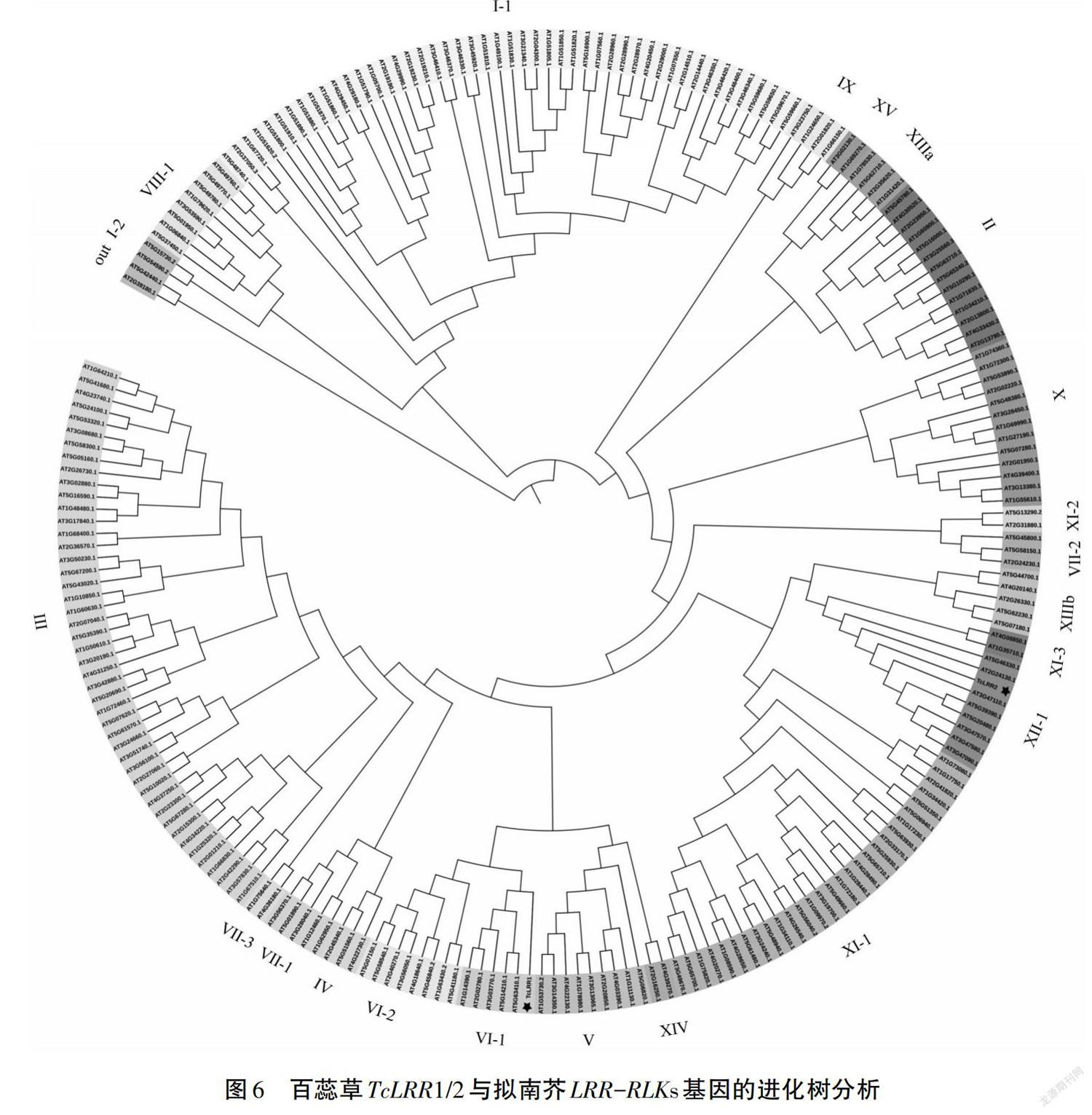
通过TcLRR1与TcLRR2序列比对发现,二者一致性仅16.09%。将两者与拟南芥LRR-LRKs构建进化树,发现TcLRR1属于VI-1亚组,TcLRR2属于XII-1亚组,TcLRR1与blast比对的At3g47570、At5g20480及At4g20140都未聚在同一亚组(见图6);TcLRR2与At3g47570和At5g20480(EFR)聚为同一亚组,与blast结果一致。
2.6 基因表达模式分析
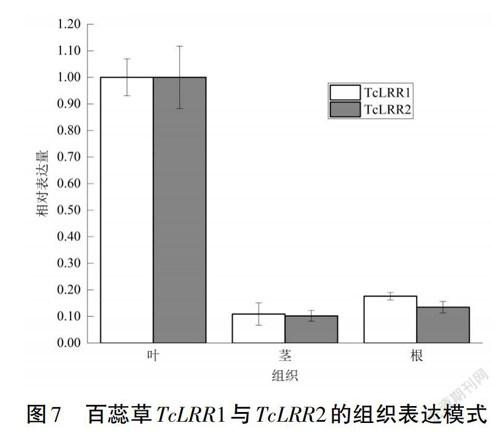
在非脅迫条件下,以初果期的根、茎、叶为材料,选择叶片作为对照研究了TcLRR1和TcLRR2基因的相对表达模式,发现TcLRR1和TcLRR2在叶片中的表达量最高,在茎和根中的表达量低且两者差异不明显(见图7)。
3 结论与讨论
近年来,高通量转录组测序已经成为研究基因表达调控的主要手段,广泛应用于药用植物新基因的发现、代谢途径的确定,以及基因家族鉴定、进化分析等方面。百蕊草是优良的抗炎抗菌药材,其中百蕊草素等黄酮类成分为主要活性成分,前期本课题组通过体外使用非生物诱导因子硝酸银对百蕊草植株进行诱导后,采用高通量转录组测序研究百蕊草黄酮等化合物的次生代谢途径、关键基因的表达调控等,通过高通量转录组测序在获得大量次生代谢相关序列信息的同时也获得了包括LRR家族在内的一些基因家族序列信息[6]。根据转录组表达数据,调取差异表达的6 878 bp的序列进行分析,获得两个具有较长开放阅读框的序列,blast比对结果表明二者都属于LRR-RLKs,分别命名为TcLRR1和TcLRR2。对结构域与跨膜区分析发现,TcLRR1蛋白缺乏跨膜区与激酶区,属于不完全的LRR-RLKs蛋白,TcLRR2具有较长ORF,具有完整的LRR-RLKs基因的结构。进一步对两个基因的蛋白结构进行比对,发现TcLRR1在C端具有很长的缺失,因此推测TcLRR1可能不具有受体激酶的功能,其在植物体内存在的意义还需进一步验证。
不同物种LRR基因的核酸序列差异较大,同源性较低,但是LRR基因编码的氨基酸序列具有相似的结构和功能[8]。TcLRR2基因结构较完整,blastp比对发现它与水稻Xa21的一致性最高,而水稻Xa21基因与水稻的免疫性有关[9],因此猜测TcLRR2可能与百蕊草的抗逆性有关。目前通过转录组测序并进行PCR验证,获得了两个LRR基因序列,说明百蕊草与其他植物一样存在着LRR基因家族[10-11]。植物抗性基因作为防卫系统的一员,在没有外界胁迫影响时表达量很低,当有激发子或诱导子诱导时,抗性基因能高表达,植物能够识别并激活抗病信号传导途径产生防卫反应。抗性基因在不同组织的表达也有差异性[12],本研究通过荧光定量的方法对这两个基因在根、茎及叶中的表达情况进行分析,发现TcLRR1与TcLRR2表达趋势一致,都是在叶片中表达量最高,茎和根中的表达量低且差异不明显,表明该家族基因在百蕊草中可能存在组织特异性表达的特点,推测叶在逆境信号感知中更为敏感和重要。同时,TcLRR1与TcLRR2两者蛋白序列一致性仅为16.09%,对于功能域不完整的TcLRR1来说,其表达的机理与意义还有待进一步验证。
参考文献:
[1] 王小菁.植物生理学(第8版)[M].北京:高等教育出版社, 2019.
[2] WALKER J C, ZHANG R. Relationship of a putative receptor protein kinase from maize to the S-locus glycoproteins of Brassica[J]. Nature, 1990, 345: 743–746.
[3] 武祖发,梁盖敏,刘守金,等.百蕊草的生药研究与寄主调查[J].中草药,1993,24(8):429-430.
[4] 刘永松,罗曼,潘玲,等.抗菌中草药百蕊草的研究进展[J].药学进展,2006,30(6):252-255.
[5] 邹懿,洪敏,杨笑芳.百蕊草化学成分分离[J].中国实验方剂学杂志,2016,22(7):74-77.
[6] 曹剑锋,张引,陈培玉,等.百蕊草转录组测序及黄酮合成相关基因分析[J].分子植物育种,2020,19(15):4977-4986.
[7] WANG J L, HU T H, WANG W H, et al. Investigation of evolutionary and expressional relationships in the function of the leucine-rich repeat receptor-like protein kinase gene family (LRR-RLK) in the radish (Raphanus sativus L.)[J]. Scientific Reports, 2019, 9: 6937.
[8] 张保龙,杨郁文,倪万潮,等.陆地棉CC-NBS-LRR基因的克隆及特征分析[J].江苏农业学报,2006,22(4):351-355.
[9] CADDELL D F, PARK C, THOMAS N C, et al. Silencing of the Rice Gene Lrr1 Compromises Rice Xa21 Transcript Accumulation and Xa21-Mediated Immunity[J]. Rice, 2017, 10(1): 23.
[10] LIU P L, DU L, HUANG Y, et al. Origin and diversification of leucine-rich repeat receptor-like protein kinase (LRR-RLK) genes in plants[J]. BMC Evolutionary Biology, 2017, 17:47.
[11] SUN J M, LI L T, WANG P, et al. Genome-wide characterization, evolution, and expression analysis of the leucine-rich repeat receptor-like protein kinase (LRR-RLK) gene family in Rosaceae genomes[J]. BMC Genomics, 2017, 18:763.
[12] THURAU T, KIFLE S, JUNG C, et al. The promoter of the nematode resistance gene Hs1pro-1 activates a nematode-responsive and feeding site-specific gene expression in sugar beet (Beta vulgaris L.) and Arabidopsis thaliana[J]. Plant Mol Biol, 2003,52(3): 643-660.
(责任编辑:丁志祥)
