兰索拉唑诱导心肌细胞氧化应激损伤的机制研究
2022-06-15钱徐萍张学会孙鲁宁孙诗钰马梦圆程紫萍陈安九王永庆
钱徐萍,张学会,孙鲁宁,王 雨,孙诗钰,马梦圆,程紫萍,陈安九*,王永庆*
1徐州医科大学江苏省新药研究与临床药学重点实验室,江苏 徐州 221004;2南京医科大学第一附属医院药学部,江苏 南京 210029;3江苏盛泽医院药学部,江苏 苏州 215228
兰索拉唑(lansoprazole,LPZ)是二代质子泵抑制剂(proton pump inhibitor,PPI),主要通过抑制胃壁细胞的H+∕K+⁃ATP 酶系统来阻断胃酸分泌,以达到抑酸的效果[1]。临床广泛用于胃溃疡、十二指肠溃疡、反流性食管炎以及卓⁃艾综合征的治疗,也可与其他药物联合用于治疗幽门螺旋杆菌感染。随着LPZ在临床的广泛应用,特别是长期使用,其潜在的不良反应逐渐引起研究者的关注。短期使用LPZ常见的不良反应主要包括腹痛、便秘、腹泻、恶心、头晕或头痛等。长期或大剂量使用LPZ可能会导致骨质疏松、感染、肾脏损伤、维生素B12等微量元素缺乏,并增加心血管事件的发生风险[2-3]。研究表明,长期大剂量使用PPI可导致心动过快[4],也有调查报告显示,163例PPI所致严重不良反应中,心血管系统不良反应有7例,占4.29%[5]。心血管事件主要包括心肌梗死、心力衰竭等,而心肌梗死的发生与细胞内钙超载、活性氧增加、心肌细胞凋亡和线粒体破坏等特定途径有关[6-7]。
活性氧(reactive oxygen species,ROS)是一种引起氧化应激的过氧化物,可通过损伤细胞膜脂质及脱氧核糖核酸(deoxyribo nucleic acid,DNA)等机制损伤细胞[8]。ROS 已被证实可以引发内质网应激,从而参与细胞凋亡过程[9]。内质网应激是一种新的凋亡途径,参与各种状态下的细胞凋亡。当内质网处于应激状态时,内质网的分子伴侣如葡萄糖调节蛋白78(glucose⁃regulated protein 78,GRP78)会相应增加,GRP78 是内质网应激反应的标志蛋白,与错误折叠的蛋白或未折叠的蛋白相结合,使细胞进入降解途径[10]。内质网应激诱导的下游凋亡信号通路包括CCAAT∕增强子结合蛋白同源蛋白或生长停滞及DNA 损伤诱导基因153(CHOP∕GADD153)、c⁃Jun 氨基末端激酶(JNK)、天冬氨酸特异性半胱氨酸蛋白酶(cyste⁃inyl aspartate⁃specific proteinase,Caspase)通路。内环境处于稳态时,C∕FBP 同源蛋白(C∕FBP⁃homolo⁃gous protein,CHOP)和Caspase⁃12 的表达很弱,当稳态失衡时,细胞发生内质网应激,CHOP 和Cas⁃pase⁃12 的表达明显升高,过度表达的CHOP 和Caspase⁃12 会促使细胞周期停滞甚至导致细胞凋亡[10]。凋亡被认为是心肌损伤的重要潜在机制之一。因此,本研究以心肌细胞中ROS 为基础,运用Western blot、荧光显微等技术,探究LPZ 增加心血管风险的可能机制,为临床安全用药提供一定参考。
1 材料和方法
1.1 材料
1.1.1 细胞株H9C2(大鼠心肌细胞),购于中国科学院分子细胞科学卓越创新中心。
1.1.2 药品与试剂
兰索拉唑标准品(纯度99.6%,中国食品药品检定研究院);DMFM培养基、胎牛血清、Trypsin⁃FDTA消化液(Biological Industries 公司,以色列);二甲基亚砜(dimethyl sulphoxide,DMSO)(Sigma 公司,美国);GAPDH 抗体、GRP78 抗体、细胞色素C(cyto⁃chrome C,Cyt C)抗体、HRP标记山羊抗兔IgG(武汉塞维尔生物科技有限公司);B细胞淋巴瘤∕白血病2(B⁃cell lymphoma∕leukemia 2,Bcl⁃2)抗体(Abcam 公司,英国);Cleaved⁃Caspase⁃12 抗体、CHOP 抗体、Cleaved⁃Caspase⁃3抗体(CST公司,美国);Bcl⁃2相关X蛋白(Bcl⁃2⁃associated X protein,Bax)抗体(Protein⁃tech 公司,美国);β⁃actin 抗体(Affinity 公司,美国);N⁃乙酰⁃L⁃半胱氨酸(N⁃acetyl⁃L⁃cysteine,NAC)、PMSF、RIPA 裂解液(杭州碧云天生物技术有限公司)。
1.1.3 主要仪器
CO2培养箱HF100(上海力申科学仪器有限公司),离心机(Fppendorf 公司,美国),倒置荧光显微镜IX73(Olympus 公司,日本),电泳仪PowerPacTMBASIC(Bio⁃Rad 公司,美国),超声破碎仪(Sonics 公司,美国),化学发光图像分析系统(Tanon 5200 Multi,上海天能科技有限公司),流式细胞分析仪(Beckman Coulter公司,美国)。
1.2 方法
1.2.1 细胞培养及分组
H9C2 贴壁生长,正常培养阶段使用含1%双抗和10%胎牛血清的DMFM 培养基进行培养,隔天换液。细胞给药阶段用含有0.1% DMSO、1%双抗和10%胎牛血清的培养基或相应的含药培养基进行培养,每天换液。细胞于37 ℃、含有5%CO2的培养箱中培养,当细胞密度长至80%左右时进行传代,传代比例为1∶3,取状态良好的对数生长期细胞进行实验。
第一阶段实验分为0 h组、12 h组、24 h组和48 h组,各组细胞间DMSO 含量、培养时间保持一致,LPZ 浓度为10 μmol∕L。第二阶段实验分为Con 组、LPZ 组、NAC 组、LPZ+NAC 组共4 组。Con 组为对照组;LPZ 组中含有10 μmol∕L LPZ;NAC 组中含有1 mmol∕L NAC;LPZ+NAC 组中含有1 mmol∕L NAC和10 μmol∕L LPZ,各组间DMSO 含量保持一致,共同培养48 h。
1.2.2 ROS荧光检测
对数生长期细胞以3×104个∕mL 接种至6 孔细胞培养板,每孔2 mL,置于37 ℃、含5%CO2的培养箱中培养24 h,细胞给药后培养一定时间,用10 μmol∕L DCFH⁃DA染液于37 ℃培养箱孵育20 min,用无血清培养基清洗3次,以488 nm为激发波长在荧光显微镜下进行观察。
1.2.3 Western blot法检测蛋白表达
对数生长期细胞以3×104个∕mL个接种至6孔细胞培养板,每孔2 mL,置于37 ℃、含有5%CO2的培养箱中培养24 h,细胞给药后培养一定时间,用RIPA裂解液(使用前2 min内加入蛋白酶抑制剂)冰上裂解细胞15 min,刮取的细胞裂解液用细胞破碎仪冰上超声3~5 次,每次5 s,然后离心取上清。根据BCA试剂盒操作说明测定蛋白浓度,调齐浓度后加入5×蛋白上样缓冲液煮沸10 min,变性后的蛋白样本立即使用或保存于-80 ℃冰箱。使用10%或12%的SDS⁃PAGF分离胶,按照每孔35 μg的上样量进行电泳,待蛋白分离后停止电泳。用湿转法转移至PVDF膜上,室温条件下用5%脱脂牛奶封闭90 min,经TBST漂洗后放入相应的一抗中,4 ℃孵育过夜。次日取出条带,用TBST缓冲液漂洗3次,每次10 min。室温条件下在摇床上孵育二抗约1 h,结束后仍用TBST 缓冲液漂洗3 次,最后使用Tanon 显色系统进行显影。用Image J 软件对Western blot 条带进行半定量分析,各给药组目的蛋白的表达用对照组进行标准化。
1.3 统计学方法
实验数据以均数±标准差()的形式表示,所有数据均使用Graph Pad Prism 9 软件进行统计分析,多组间比较使用单因素方差分析,P<0.05为差异有统计学意义。每项实验均独立重复3 次,使用Graph Pad Prism 9软件进行作图。
2 结果
2.1 LPZ时间依赖性地诱导氧化应激
为了研究LPZ 长期作用对H9C2中ROS 水平的影响,分别用10 μmol∕L LPZ 孵育细胞12、24、48 h后,采用ROS 检测试剂盒进行检测。结果如图1 所示,10 μmol∕L LPZ 孵育细胞48 h,ROS 荧光强度与对照组相比差异有统计学意义,LPZ 可以时间依赖性地诱导氧化应激。

图1 LPZ对H9C2细胞氧化应激的影响Figure 1 The effects of LPZ on oxidative stress in H9C2 cells
2.2 LPZ时间依赖性地诱导内质网应激,增加凋亡相关蛋白的表达
为了研究LPZ 对H9C2 细胞内质网应激和凋亡相关蛋白表达的影响,分别用LPZ孵育细胞12、24、48 h后,用Western blot进行检测。结果显示,LPZ可以时间依赖性地增加H9C2中内质网应激相关蛋白GRP78 和CHOP 的表达,且在48 h 时最为明显(图2)。Caspase⁃12 和Caspase⁃3 的激活在内质网应激诱导的细胞凋亡中起关键作用。LPZ时间依赖性地增加Cleaved⁃Caspase⁃12 和Cleaved⁃Caspase⁃3 蛋白的表达,且在给药24 h时蛋白表达与0 h比较,差异有统计学意义(图3),说明LPZ引发H9C2细胞内质网应激后触发凋亡。Bax凋亡蛋白表达呈时间依赖性增加,Bcl⁃2 抗凋亡蛋白表达呈时间依赖性降低,Cyt C蛋白表达呈时间依赖性增加,进一步说明LPZ时间依赖性地诱导细胞凋亡。
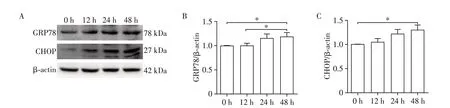
图2 LPZ对H9C2细胞内质网应激蛋白表达的影响Figure 2 The effects of LPZ on expression of endoplasmic reticulum stress protein in H9C2 cells
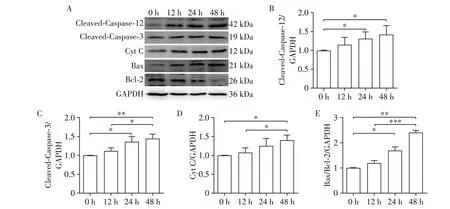
图3 LPZ对H9C2细胞凋亡相关蛋白表达的影响Figure 3 The effects of LPZ on expression of apoptosis related proteins in H9C2 cells
2.3 ROS抑制剂能缓解LPZ诱导的心肌损伤
为了进一步验证氧化应激在LPZ诱导的内质网应激和细胞凋亡中的作用,本研究使用ROS抑制剂NAC(1 mmol∕L)单独或联合LPZ共同孵育细胞48 h,并用ROS 检测试剂盒和Western blot 检测ROS 和蛋白表达水平的变化。与Con 组相比,LPZ 组ROS 荧光强度增强,而NAC 组和NAC+LPZ 组荧光强度无显著变化(图4),说明NAC 对LPZ 诱导的ROS 荧光增强有显著抑制作用。与Con 组相比,LPZ 组内质网应激蛋白GRP78和CHOP表达增强,而NAC组和NAC+LPZ 组内质网应激蛋白表达无显著变化(图5),说明NAC对LPZ诱导的内质网应激有显著抑制作用。与Con 组相比,LPZ 组内质网应激诱导的凋亡相关蛋白Cleaved⁃Caspase⁃12、Cleaved⁃Caspase⁃3、Cyt C 和Bax∕Bcl⁃2 表达增强,而NAC 组和NAC+LPZ组蛋白表达无显著变化(图6),说明NAC 对LPZ 诱导的凋亡有显著抑制作用。

图4 NAC对LPZ诱导的H9C2细胞氧化应激的影响Figure 4 The effects of NAC on LPZ⁃induced oxidative stress in H9C2 cells
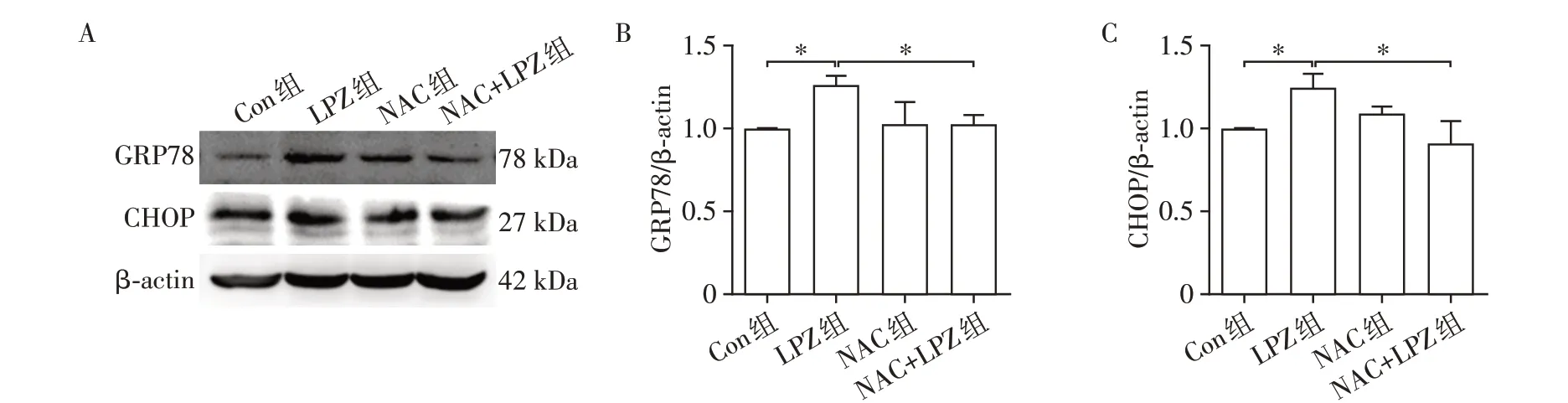
图5 NAC对LPZ诱导的H9C2细胞内质网应激蛋白表达的影响Figure 5 The effects of NAC on expression of LPZ⁃induced endoplasmic reticulum stress proteins in H9C2 cells
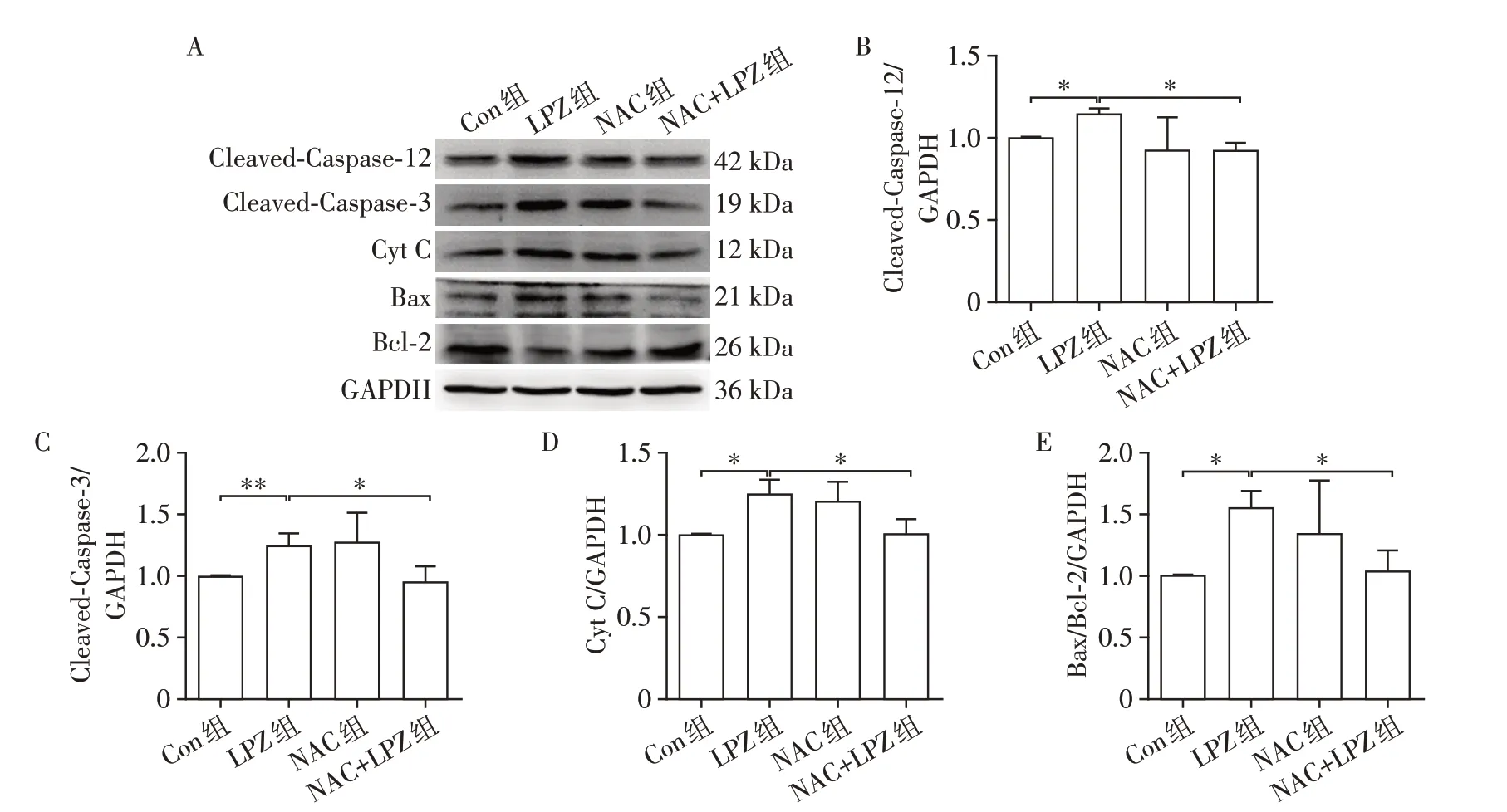
图6 NAC对LPZ诱导的H9C2细胞凋亡相关蛋白表达的影响Figure 6 The effects of NAC on expression of LPZ⁃induced apoptosis related proteins in H9C2 cells
3 讨论
LPZ 是苯并咪唑类化合物,口服后在酸性条件下转化为活性代谢物发挥药理活性,抑制胃酸分泌的最后一步。由于临床使用量逐年增加,潜在的不良反应逐渐引起研究者的关注。LPZ在心脏方面的潜在作用存在争议。Patil 等[11]在大鼠体内的研究表明,多次服用LPZ 和奥美拉唑可以通过降低氧化应激和促炎性细胞因子,降低异丙肾上腺素诱发的心肌梗死。然而,Sehested 等[12]的观察性研究结果表明,大剂量PPI 长期使用会诱发缺血性卒中和心肌梗死,6个月内发生缺血性卒中的风险增加29%,发生心肌梗死的风险增加36%。在一项随机双盲多中心研究中,LPZ组230例患者中有4例发生严重不良反应,其中包括心律失常[13]。本研究表明,长期使用LPZ 会诱导心肌细胞氧化应激和内质网应激,导致细胞凋亡。LPZ 需要在胃液中活化后发挥抑酸作用,但是心肌细胞内的pH不足以使LPZ发生质子化,因此本研究采用LPZ原型药物进行实验,符合药物在心脏组织中的实际情况。
心肌缺血或梗死时,心肌细胞和内皮细胞ROS产生会大量增加[14]。ROS 是引起内质网应激的上游信号分子,氧化应激通常会导致内质网应激,参与并调节细胞凋亡过程[15]。内质网是一个广泛的细胞内膜网络,其相关功能在心脏生理和病理中至关重要[16]。某些因素如氧化应激、缺血和钙稳态等会引起内质网应激,内质网的分子伴侣如GRP78和钙网蛋白的产生都会相应增加,也会启动凋亡信号,包括切割的Caspase⁃3 和Caspase⁃12,最终会导致细胞凋亡[17-18]。内质网应激启动的细胞凋亡与各种疾病的病理生理学有关,包括心血管疾病,如心肌肥厚、心力衰竭、动脉粥样硬化和缺血性心脏病[19]。此外,在内质网和线粒体上表达的Bcl⁃2家族也参与调控内质网应激引起的细胞死亡。Bcl⁃2 是抗凋亡因子,Bax是促凋亡因子,Bcl⁃2亚家族蛋白包括Bcl⁃2和Bcl⁃XL,通过抑制Bax亚家族蛋白,阻止线粒体释放Caspase激活因子,从而抑制细胞凋亡。CHOP诱导细胞凋亡的一个重要途径是调节Bcl⁃2 家族促凋亡蛋白和抗凋亡蛋白之间的平衡[19]。本研究用LPZ孵育H9C2不同时间后发现,LPZ能时间依赖性增加ROS荧光,并显著增加GRP78和CHOP的表达,说明长期使用LPZ 能诱导氧化应激,进一步诱导内质网应激。此外,LPZ增加了H9C2细胞Cleaved⁃Caspase⁃12、Cleaved⁃Caspase⁃3、Cyt C 及Bax∕Bcl⁃2的表达,提示LPZ能诱导心肌细胞凋亡。
NAC是一种含有巯基的抗氧化剂,可促进还原谷胱甘肽的合成,加快细胞内自由基的清除[20]。为了进一步验证LPZ诱导的心肌细胞凋亡与氧化应激的相关性,本研究将ROS 抑制剂NAC 单独或联合LPZ共同作用于细胞48h。结果显示,1mmol∕L NAC单独作用于H9C2细胞48 h对ROS荧光和内质网应激相关蛋白的表达没有影响,也不会增加凋亡相关蛋白的表达,但是能显著减弱由LPZ 诱导的ROS 荧光增加,并很大程度上抑制由LPZ 诱导的GRP78、CHOP、Cleaved⁃Caspase⁃12、Cleaved⁃Caspase⁃3、Cyt C 及Bax∕Bcl⁃2 表达增加,这些结果进一步验证了LPZ诱导的心肌细胞损伤与氧化应激有较大相关性。降低心肌细胞ROS水平,阻断调亡信号通路可有效抑制LPZ 诱导的细胞调亡,对LPZ 长期使用导致的心脏不良反应的治疗和预防具有指导意义。
综上所述,临床相关浓度的LPZ 可能通过氧化应激诱导心肌细胞损伤。本研究表明ROS可作为预防LPZ相关心脏不良反应的潜在靶点,可以进行深入研究。NAC通过抗氧化作用减少心肌细胞调亡,从而保护心脏,这对LPZ临床合理使用有重要作用。
