小鼠脊髓损伤后Bmi⁃1在脊髓中的表达变化
2022-06-15金瑶瑶赵伟华肖晨宇张永杰
金瑶瑶,赵伟华,高 钰,肖晨宇,张永杰*
1南京医科大学人体解剖学系,2衰老及相关疾病研究重点实验室,江苏 南京 211166;3南京中医药大学附属常州市中医医院骨科,江苏 常州 213003;4南京医科大学第一临床医学院,江苏 南京 211166
脊髓损伤(spinal cord injury,SCI)可由跌落、交通事故、脊髓缺血或肿瘤等引起[1-2]。SCI 患者常面临瘫痪、感觉障碍、神经性疼痛等系列问题,给个人、家庭和社会带来沉重负担[3]。研究者始终致力于探索药物、不同术式、干细胞与生物材料移植、电生理与功能锻炼、智能假肢等多种方法治疗SCI,但至今临床尚缺乏行之有效的治疗途径[4-5]。因此,进一步探索SCI后的病理生理改变及相关机制显得极为重要。
B 淋巴瘤Mo⁃MLV 插入区1(B lymphoma Mo⁃MLV insertion region 1,Bmi⁃1)是多梳抑制蛋白复合物1(polycomb repressive complex 1,PRC1)的重要成员之一[6-7],可调节细胞增殖、生长、DNA 修复、凋亡和衰老[8-9]。既往研究显示,自胚胎发育起至成年,Bmi⁃1 在广泛脑区与脊髓中均有表达[10]。Bmi⁃1 敲除小鼠(Bmi⁃1 KO)可存活1~2 个月,在2~4 周时出现共济失调,小脑颗粒层与浦肯野氏细胞减少,海马神经元退行性变,胼胝体区星形胶质细胞增生等[11]。本课题组前期结果显示Bmi⁃1 在脑发育、脑功能及脑衰老中均有重要作用[12]。但Bmi⁃1在脊髓损伤后病理进程中的表达变化及作用尚未见报道。
因此,本研究利用LISA 脊髓损伤造模仪制作T9 脊髓中度钝挫伤模型小鼠,采用Western blot 及免疫荧光染色观察Bmi⁃1 在SCI 后不同时间点的表达及细胞定位,初步探索Bmi⁃1 在脊髓损伤后病理进程中的表达变化。
1 材料和方法
1.1 材料
1.1.1 动物及动物分组
实验用8~10周龄雌性C57Bl∕6小鼠共60只,动物随机分为两组:对照组(即假手术组,n=10)和手术组(n=50)。小鼠饲养、管理及使用均严格按照南京医科大学实验动物管理规范进行(IACUC:1809007)。
1.1.2 试剂和仪器
单克隆兔抗神经元核心抗原(neuronal nuclei antigen,NeuN)抗体(Abcam 公司,美国),单克隆大鼠抗髓鞘碱性蛋白(myelin basic protein,MBP)抗体(Millipore公司,美国),多克隆兔抗神经胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体(Millipore公司,美国),多克隆兔抗离子钙接头蛋白分子1(ionized calcium binding adapter molecule 1,Iba⁃1)抗体(Wako 公司,日本),单克隆大鼠抗血小板内皮细胞黏附分子1(platelet and endothelial cell adhesion molecule⁃1,PFCAM⁃1∕yCD31)抗 体(BD Pharmingen 公司,美国),单克隆小鼠抗Bmi⁃1 抗体(Abgent 公司,美国)。Alex Fluor 594 标记驴抗小鼠IgG、Alex Fluor 488 标记驴抗大鼠IgG、Alex Fluor 488 标记驴抗兔IgG(Jackson ImmunoResearch 公司,美国),DAPI(sigma 公司,美国),多克隆兔抗PCNA抗体(Proteintech公司,美国),HRP标记的单克隆小鼠抗GAPDH 抗体(Proteintech 公司,美国),羊抗小鼠IgG⁃HRP、羊抗兔IgG⁃HRP(KPL 公司,美国)。BCA 蛋白检测试剂盒(Bio⁃Rad 公司,加拿大),FCL免疫印迹检测试剂盒(Amersham Pharmacia公司,美国)。
LISA脊髓损伤造模仪(美国Norton 神经科学研究中心Dr.Shields馈赠)、冰冻切片机(Thermo Fisher公司,美国)、正置荧光显微镜及图像采集系统(Leica公司,美国)、蛋白电泳仪及成像系统(Bio⁃Rad公司,美国)。
1.2 方法
1.2.1 动物手术
小鼠采用1%戊巴比妥钠(50 mg∕kg,腹腔注射)麻醉,固定于LISA 小鼠固定支架,行T9 椎板切除术。手术组采用LISA脊髓损伤造模仪制作T9脊髓中度钝性撞击模型,损伤深度0.6 mm[13];假手术组只行T9 椎板切除术。分层缝合肌肉与皮肤。术后动物置30 ℃加热垫苏醒恢复,每天两次膀胱护理,至膀胱排尿功能恢复后行术后常规护理与喂养。
1.2.2 组织取材与切片
动物手术后将手术组小鼠随机分为5 组,每组10 只。分别于术后1、3、7、14、28 d 采用1%戊巴比妥钠麻醉小鼠,其中每组6只小鼠经左心室4%多聚甲醛灌注后,取距损伤中心头尾侧各5 mm范围内脊髓组织,继行4%多聚甲醛固定,梯度浓度蔗糖脱水,OTC包埋后行冠状位冰冻切片,片厚10 μm;4只经左心室生理盐水灌注后,取距损伤中心头尾侧各5 mm 范围内脊髓组织,用于提取蛋白行Western blot检测。假手术组10只,于椎板切除术后28 d时,同上取6只行4%多聚甲醛灌注取材,4只行生理盐水灌注取材。
1.2.3 免疫荧光染色
冰冻切片经37 ℃30 min 烘干后,常规PBS 洗涤,用含0.1%Triton X⁃100的10%驴血清和0.5%牛血清白蛋白(BSA)室温封闭1 h。一抗为单克隆兔抗NeuN 抗体(1∶1 000)、单克隆大鼠抗MBP 抗体(1∶50)、多克隆兔抗GFAP 抗体(1∶500)、多克隆兔抗Iba⁃1 抗体(1∶100)、单克隆大鼠抗CD31 抗体(1∶100)、单克隆小鼠抗Bmi⁃1抗体(1∶500),4 ℃孵育过夜;加相应二抗,Alex Fluor 594 标记驴抗小鼠IgG、Alex Fluor 488 标记驴抗大鼠IgG、Alex Fluor 488 标记驴抗兔IgG(1∶1 000),37 ℃孵育1 h;DAPI(1∶1 000)孵育10 min,甘油封片后于Leica正置荧光显微镜观察摄片。使用Image⁃Pro Plus 5.0.1 软件分析Bmi⁃1 与Iba⁃1、CD31、NeuN 与GFAP 双阳性细胞百分率,Bmi⁃1 与MBP 双阳性细胞与纤维的面积百分比,每只小鼠脊髓的相应观察区至少计数3张切片,结果取平均值。
1.2.4 Western blot实验
脊髓组织按1∶20质量∕体积比加入RIPA,剪碎、匀浆,冰上静置30 min,13 000 r∕min 4 ℃离心15 min,提取蛋白,采用BCA法行蛋白定量。每组蛋白加样20 μg,蛋白经10%SDS⁃PAGF分离后湿转至甲醇处理的PVDF 膜。含5% 脱脂奶粉的PBST 37 ℃封闭2 h,加入一抗单克隆小鼠抗Bmi⁃1 抗体(1∶1 000)、多克隆兔抗增殖细胞核抗原(proliferating cell nucle⁃ar antigen,PCNA)抗体(1∶2 000)、HRP 标记的小鼠抗GAPDH 单克隆抗体(1∶5 000),4 ℃孵育过夜。PBST洗涤后,加入相应二抗HRP⁃标记山羊抗兔IgG或HRP⁃标记山羊抗小鼠IgG(1∶2 000),室温孵育1 h。按FCL 免疫印迹检测试剂盒步骤加入发光混合液,自动成像仪曝光,保存图像。使用Image⁃Pro Plus 5.0.1软件分析发光强度。
1.3 统计学方法
使用GraphPad Prism 6.0 软件进行分析。各组数据以均数±标准差()表示。采用单因素方差分析(one⁃way ANOVA)进行多组间数据比较,采用SNK 法对多组间数据进行两两比较,P<0.05 为差异有统计学意义。
2 结果
2.1 SCI后小鼠脊髓组织病理学变化
为观察脊髓钝挫伤后的组织缺损变化,首先观察SCI后1、3、7、14、28 d时损伤灶周围的血肿改变,继而采用髓鞘标识物MBP 免疫荧光染色分别观察上述时间点损伤灶及周围MBP 的表达情况。结果显示,SCI术后1 d和3 d时,局部血肿显著;与术后1 d或3 d相比,术后7 d起,血肿面积明显减小;至术后14 d 与28 d 时,损伤灶表面血肿已不明显(图1A、B)。MBP免疫荧光染色结果显示:假手术对照组小鼠的脊髓中MBP阳性细胞与纤维分布规则,脊髓灰质与白质境界清晰;手术组(SCI后1、3、7 d)小鼠,脊髓损伤灶中央主要为空洞及坏死区域、邻近区域MBP 阳性细胞与纤维分布杂乱,灰白质境界不清。至损伤14 d 后,损伤区面积逐渐变小,损伤灶与周围组织之间的边界逐渐清晰。为进一步观察损伤后Bmi⁃1 在不同损伤时间点的表达及细胞定位变化,取损伤边缘区观察Bmi⁃1在小胶质细胞、星形胶质细胞、少突胶质细胞、血管内皮细胞上的表达变化。取脊髓前角观察Bmi⁃1在神经元上的表达变化(图1C)。

图1 小鼠SCI后1、3、7、14、28 d的脊髓组织血肿与损伤灶变化Figure 1 The changes of haematoma and contusitive area in spinal cord at the day of 1,3,7,14 and 28 post SCI
2.2 Bmi⁃1在SCI后的表达与细胞定位变化
为进一步观察Bmi⁃1在脊髓损伤后的表达与细胞定位,取脊髓损伤后不同时间点的脊髓冠状切片,分别行Bmi⁃1 与Iba⁃1(小胶质细胞标志)、MBP(髓鞘细胞标志)、NeuN(神经元标志)、GFAP(星形胶质细胞标志)及CD31(血管内皮细胞标志)免疫荧光双染。结果显示:假手术对照组中可见部分Bmi⁃1与Iba⁃1双阳性细胞,SCI后1、3、7、14、28 d时,Bmi⁃1与Iba⁃1双阳性细胞显著增加,Bmi⁃1在小胶质细胞中的表达持续增高(图2、图3A);与假手术对照组相比,Bmi⁃1 与MBP 双阳性细胞及纤维的面积百分比在SCI 后3、7、14、28 d 时表达均增高(图4、图3B);Bmi⁃1 与NeuN 双阳性细胞在假手术对照组中极少,在SCI 后1 d、3 d、7 d 时增加,在SCI 后14 d 与28 d 时,与假手术对照组间的差异无统计学意义(图5、图3C);与假手术对照组相比,Bmi⁃1 与CD31双阳性细胞在SCI 后3 d、7 d 显著增加,SCI 后1 d、14 d、28 d 时与假手术对照组间差异无统计学意义(图6、图3D);假手术对照组小鼠脊髓中,偶见Bmi⁃1与GFAP双阳性细胞,SCI后的小鼠脊髓中,未发现明显的Bmi⁃1与GFAP双阳性细胞或纤维(图7、图3F)。
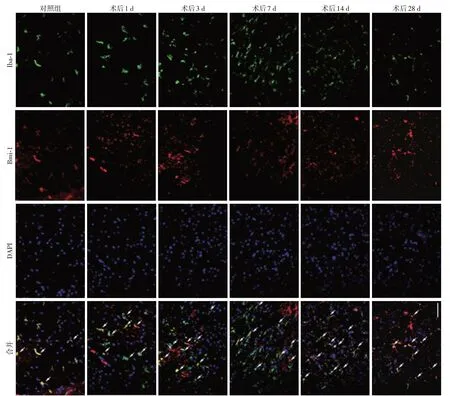
图2 小鼠SCI后1、3、7、14、28 d脊髓损伤灶边缘Bmi⁃1与Iba⁃1双阳性细胞变化Figure 2 The changes of Bmi⁃1 and Iba⁃1 double positive cells around of the contusitive margin in spinal cord at the day of 1,3,7,14 and 28 post SCI
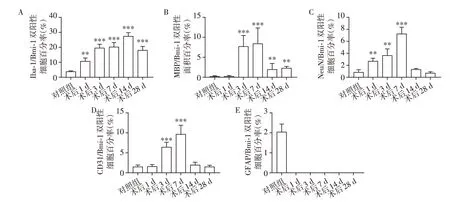
图3 小鼠SCI 后1、3、7、14、28 d 脊髓损伤灶边缘处Iba⁃1/Bmi⁃1、NeuN/Bmi⁃1、CD31/Bmi⁃1、GFAP/Bmi⁃1 双阳性细胞百分率,MBP/Bmi⁃1双阳性面积变化的统计结果Figure 3 The statistical analysis of the ratio of the double positive cells as Iba⁃1/Bmi⁃1,NeuN/Bmi⁃1,CD31/Bmi⁃1 and GFAP/Bmi⁃1,and the ratio of the MBP/Bmi⁃1 double positive area around of the contusitive margin in spinal cord at the day of 1,3,7,14 and 28 post SCI

图4 小鼠SCI后1、3、7、14、28 d脊髓损伤灶边缘Bmi⁃1与MBP双阳性细胞变化Figure 4 The changes of Bmi⁃1 and MBP double positive cells around of the contusitive margin in spinal cord at the day of 1,3,7,14 and 28 post SCI
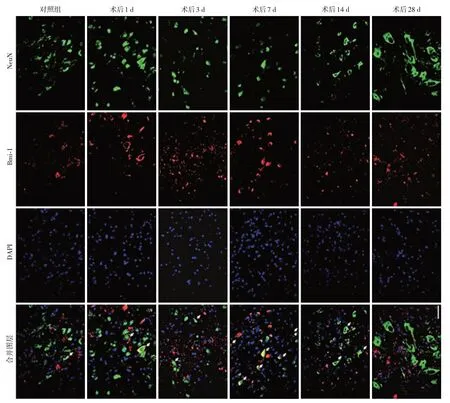
图5 小鼠SCI后1、3、7、14、28 d脊髓前角的Bmi⁃1与NeuN双阳性细胞变化Figure 5 The changes of Bmi⁃1 and NeuN double positive cells in the anterior horn of spinal cord at the day of 1,3,7,14 and 28 post SCI

图6 小鼠SCI后1、3、7、14、28 d脊髓损伤灶边缘的Bmi⁃1与CD31双阳性细胞变化Figure 6 The changes of Bmi⁃1 and CD31 double positive cells around of the contusitive margin in spinal cord at the day of 1,3,7,14 and 28 post SCI

图7 小鼠SCI后1、3、7、14、28 d脊髓损伤灶边缘的Bmi⁃1与GFAP表达变化Figure 7 The expression of Bmi⁃1 and GFAP around of the contusitive margin in spinal cord at the day of 1,3,7,14 and 28 post SCI
2.3 SCI后脊髓组织中Bmi⁃1蛋白水平表达变化
为检测SCI 后不同时间点脊髓组织中Bmi⁃1 的蛋白表达变化,通过蛋白印迹法检测假手术组和脊髓损伤后1、3、7、14、28 d时小鼠脊髓损伤灶周围组织中Bmi⁃1 蛋白的表达。结果显示:与假手术对照组相比,SCI小鼠脊髓损伤灶周围组织中Bmi⁃1的表达于损伤后1 d 时即显著增加并达峰值(P<0.01),后逐渐下降,且在损伤后28 d内始终保持较高的表达(与假手术对照组比较,SCI 后3 d,P<0.01;与假手术对照组比较,SCI 后7 d、14 d、28 d,P<0.05,图8A、B)。同时检测了增殖指标PCNA 在脊髓损伤后的表达变化,结果显示与假手术对照组相比,SCI小鼠脊髓损伤灶周围组织中PCNA的表达在损伤后3 d时显著增加并达峰值(P<0.01),7 d 时表达仍上调(P<0.01),后逐渐下降,与假手术对照组间差异无统计学意义(图8A、C)。
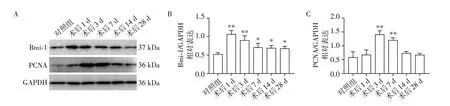
图8 小鼠SCI后1、3、7、14、28 d脊髓损伤局部Bmi⁃1与PCNA的表达变化Figure 8 The expression of Bmi⁃1 and PCNA in spinal cord at the day of 1,3,7,14 and 28 post SCI
3 讨论
Bmi⁃1 可影响多种细胞进程的基因表达,调节细胞增殖、生长、DNA 修复、凋亡和衰老[9]。同时,Bmi⁃1可通过负调节细胞周期依赖性激酶抑制因子p16Ink4a和p19Arf的转录而促进干细胞自我更新[14]。本课题组既往研究显示Bmi⁃1 缺失(Bmi⁃1KO)小鼠脑内氧化应激反应加剧、神经元突触丢失、轴突脱髓鞘、出现反应性胶质增生及线粒体损伤[15-16],小鼠出现早老性神经元退变[17]。上述研究提示Bmi⁃1在脑发育与功能维持及脑衰老中均具有重要作用,可能与抗氧化应激、抑制线粒体损伤、促细胞增殖相关。而氧化应激、线粒体损伤均为脊髓损伤后二次损伤中的重要病理过程[18],但Bmi⁃1 在脊髓损伤后的表达变化及可能作用尚未见相关报道。
脊髓损伤是一种严重致残的神经系统损伤,尤其在二次损伤中伴发的一系列病理生理改变(如炎症、氧化应激、缺血缺氧和脱髓鞘病变等),可加剧损伤程度并抑制神经再生[19]。为初步探索Bmi⁃1在脊髓损伤后的变化及可能作用,本研究采用2 月龄雌性C57Bl∕6 小鼠建立脊髓中度钝挫伤模型,在损伤后不同时间点观察Bmi⁃1 的表达及细胞定位变化。首先,采用MBP染色观察脊髓钝挫伤后不同时间点损伤灶大小的变化,结果与先前采用LISA脊髓造模仪制作的脊髓中度钝挫伤小鼠的术后损伤灶变化趋势一致[20],说明本研究造模成功。
继而采用蛋白印迹检测SCI后Bmi⁃1在脊髓中的表达变化,采用免疫荧光双染初步观察SCI后Bmi⁃1在脊髓中不同类型细胞中的表达变化。因损伤中心区主要为坏死组织,故取损伤边缘区观察Bmi⁃1在小胶质细胞、星形胶质细胞、少突胶质细胞、血管内皮细胞上的表达变化[21]。同时,由于损伤灶在术后面积变化较大,边缘区的神经元类型及分布不均一,不利于观察Bmi⁃1在神经元上的变化;且脊髓前角在该模型鼠中亦受影响[20],故取脊髓前角观察Bmi⁃1 在神经元上的表达变化[22]。结果显示Bmi⁃1在脊髓损伤后1 d 表达即增加并达峰值,在损伤后28 d 时仍保持较高水平,且Bmi⁃1 的表达变化趋势与增殖指标PCNA的表达变化趋势相对一致。免疫荧光染色结果显示,Bmi⁃1 与Iba⁃1、MBP、NeuN、CD31双阳性细胞在脊髓损伤后均有增加,且Bmi⁃1与Iba⁃1双阳性细胞的增加尤为显著。
小胶质细胞是脊髓的固有免疫细胞[23],在维持脊髓微环境稳态、促进吞噬及释放ROS等方面起重要作用。本研究首次发现Bmi⁃1 与Iba⁃1 双阳性细胞在SCI后显著增加,Bmi⁃1在小胶质细胞中持续高表达。提示Bmi⁃1 可能与SCI 后小胶质细胞的活化密切相关,对SCI 后的炎性反应具有重要作用。MBP 阳性的少突胶质细胞是脊髓中的成熟髓鞘细胞[24]。免疫荧光结果显示,Bmi⁃1 与MBP 双阳性细胞及纤维在SCI后3、7、14、28 d时表达均增高。Bmi⁃1在髓鞘细胞中的表达变化可能与SCI后发生的内源性髓鞘再生、分化与成熟有关[25],提示Bmi⁃1可能参与SCI后髓鞘细胞的再生与成熟。因神经元为分化成熟的细胞,故Bmi⁃1 在对照组小鼠的脊髓神经元中表达较低,而在SCI后1~7 d表达上调,提示Bmi⁃1在SCI后在神经元上的表达上调,可能与SCI后神经元性损伤反应[26]或与内源性胶质细胞转分化为功能性神经元[27-28]相关。在神经组织重塑过程中,神经发生与血管新生密切相关[29-30]。先前研究表明,血管生成发生在脊髓损伤后3~4 d,并持续长达1周[31]。本研究结果与此一致,且首次发现Bmi⁃1 与CD31双阳性细胞在SCI 后3~7 d 显著增加,提示Bmi⁃1 可能与SCI 后血管发生相关。SCI 后,星形胶质细胞出现增生性反应,GFAP 表达增加,并形成神经胶质瘢痕[32]。但本研究在SCI小鼠的脊髓中未观察到明显的Bmi⁃1 与GFAP 双阳性细胞。后续研究将进一步采用星形胶质细胞不同标志物,如谷氨酸转运体1(glutamate transporter 1,GLT1)、谷氨酸∕天门冬氨酸转运蛋白(glutamate∕aspartic transporter,GLAST)[33-34]等检测Bmi⁃1 在SCI 后星形胶质细胞不同发生阶段或不同亚型上的表达。
不足的是,本研究为在体观察结果,尚不能明确SCI后,Bmi⁃1在上述细胞中的表达变化是由细胞自身变化所致还是由SCI 后微环境改变间接引起,故后续研究将进一步行体外细胞培养实验,以明确上述细胞损伤后Bmi⁃1的表达变化。
综上所述,本研究首次发现,Bmi⁃1 在SCI 后表达增加,在髓鞘细胞、神经元、血管内皮细胞上均有表达,且在小胶质细胞上的表达尤为显著。提示Bmi⁃1在脊髓损伤后的表达变化可能与小胶质细胞的增殖与活化、内源性髓鞘再生及血管内皮细胞的活化有关,可能在脊髓损伤后的病理过程中具有重要意义。
