N-α乙酰基转移酶表达对顺铂抑制人食管鳞癌ECA109细胞敏感性的影响
2022-06-15武兴刚黄文华董星星赵伯文张祥鑫魏育涛
武兴刚 黄文华 董星星 赵伯文 张祥鑫 魏育涛,3
(1石河子大学医学院第一附属医院,新疆 石河子 832000;2赣州市立医院心胸外科;3济宁市第一人民医院胸外科)
N-α乙酰基转移酶(Naa10) 在人体各种组织细胞内表达,参与蛋白质乙酰化修饰,在调控机体病理生理等生物学进程中扮演重要的角色〔1〕。研究发现Naa10基因在部分恶性肿瘤组织中表达上调,对肿瘤的发生、进展和侵袭起关键作用,有望成为检测部分恶性肿瘤的生物标志物和治疗靶点〔2,3〕。有关Naa10在肿瘤化疗耐药方面的影响研究较少,但有报道发现其可通过影响细胞凋亡从而改变肿瘤细胞对化疗药物的敏感性〔4,5〕。目前食管癌常用的治疗方式有内镜治疗、外科食管癌根治术、放射治疗、药物治疗等〔6〕。但食管癌患者长期预后较差,临床上常用化疗药物有顺铂、紫杉醇、5-氟尿嘧啶、表柔比星、卡培他滨等,但化疗过程中,常常伴随着食管癌对化疗药物产生耐药性。因此,寻找新型的治疗策略,提高食管癌对化疗药物敏感性,从而延长食管癌患者预后较为重要。本研究探讨Naa10表达对顺铂抑制人食管鳞癌ECA109细胞敏感性的影响。
1 材料与方法
1.1细胞株、试剂与仪器 人食管鳞癌细胞ECA109来源于中科院细胞库,RPMI1640培养基( 美国 Gibco公司,货号31800022);胎牛血清(以色列BI公司);胰蛋白酶(美国Gibco 公司);顺铂(DDP,合肥巴斯夫生物科技有限公司);Lipofectamine 2000(Invitrogen 公司);细胞毒性测定(CCK)-8(日本同仁公司);倒置显微镜(日本Olympus IX51);离心机(上海安亭科学仪器厂);酶标仪(美国 Bio-Rad公司,iMark Microplate Reader Model 680);二氧化碳(CO2)培养箱(美国Thermo公司)。
1.2实验方法
1.2.1细胞培养 人食管鳞癌ECA109细胞在含10%的胎牛血清的RPMI1640完全培养基中,37℃、5% CO2培养箱中培养。细胞传代时使用0.25%胰酶消化3~4 min 后,待倒置显微镜下见细胞圆缩时,加入含10%胎牛血清的RPMI1640完全培养基终止消化,以移液枪轻轻吹下贴壁生长细胞,轻柔吹打均匀后分至提前加入培养基的细胞培养瓶中,放入37℃、5%CO2培养箱中培养。细胞冻存时配制冻存液1 ml〔100 μl二甲基亚砜(DMSO)+900 μl胎牛血清〕,静置20 min,按照细胞传代的操作方法离心得到细胞,弃上清,使用提前配制好的冻存液重悬细胞,用移液枪将细胞轻柔缓慢吹打均匀,移入冻存管,放入冻存盒内。4℃保存20 min,-20℃保存1 h后,置于-80℃冰箱内保存。
1.2.2向ECA109细胞转染小干扰RNA(siRNA)及转染效率鉴定 由上海吉玛制药技术有限公司对siRNA进行构建、包装和纯化。将人食管鳞癌ECA109细胞铺至24孔板,将siRNA-Naa10和siRNA-NC分别转染人食管鳞癌ECA109细胞系,设立不同的Lip2000与siRNA比例,转染完成后,放入培养箱中,经过5 h,更换成完全培养基,移至荧光显微镜下观察,确定最佳转染效率及最低细胞毒性的Lip2000与siRNA比例,并用Western印迹检测Naa10的表达状况。
1.2.3Western印迹检测 分别取转染后48 h及72 h细胞,用细胞裂解液提取各分组样品的总蛋白,二喹啉甲酸(BCA)法测定蛋白浓度,将制备好的蛋白加入5×上样缓冲液,沸水浴8 min使蛋白变性,每组蛋白取3 μl上样,进行蛋白凝胶电泳,待溴酚蓝至凝胶底部时停止电泳,将电泳开的蛋白丛凝胶上电转至硝酸纤维素膜(NC膜),后将NC膜浸入含5%(质量分数)脱脂奶粉的TBST中室温封闭2 h,将一抗使用5%牛血清蛋白(BSA)按1∶1 000稀释浸润NC膜,4℃摇床孵育过夜,TBST洗膜后,将条带充分浸润于辣根过氧化物酶标记的二抗(1∶5 000)中室温孵2 h,再次洗膜后使用增强化学发光(ECL)方法进行显影、曝光,胶片晾干后,扫描并分析。使用ImageJ(V2.1)软件对目的蛋白与内参进行灰度对比。
1.2.4CCK-8法检测各细胞组对DDP的敏感性 将ECA109-siRNA-Naa10组、ECA109-siRNA-NC组和ECA109-空白组分别以4×103个/孔接种于96孔板(100 μl/孔),间隔24 h,待细胞完全贴壁后,各孔加入不同浓度的DDP进行培养,浓度分别为1、2、4、6、8、10、20、30、40、50、70 μg/ml,相对应的对照组使用等容积的0.9% NaCl溶液代替DDP,每组每种浓度设3个复孔,充分混匀后置37℃、5%CO2培养箱中孵育。24 h后更换培养基,每孔加含有10%的CCK-8试剂的培养液。混匀后培养箱中继续孵育2 h,全自动酶标仪上以波长450 nm测定吸光度值A450,计算平均细胞存活率,以药物浓度的对数值为横坐标,细胞抑制率为纵坐标,绘制回归直线,并计算出半数抑制浓度(IC50)值。每个处理组进行3次重复实验,确定细胞对药物敏感程度的改变。计算公式如下:细胞存活率=处理组A450值/对照组A450值×100%;耐药指数(RI)=处理组细胞IC50 /对照组IC50。
1.3统计学方法 采用SPSS17.0软件进行方差分析。
2 结 果
2.1siRNA转染效率的确定 荧光显微镜下分别观察ECA109-siRNA-Naa10组、ECA109-siRNA-NC组、ECA109-空白组,发现lip2000与siRNA比例为10 μl∶10 μl的转染效率可达到80%以上,且对各细胞组毒性较小,故选取Lip2000∶siRNA为10 μl∶10 μl用于转染ECA109细胞,见图1。Western印迹检测siRNA转染ECA109细胞48 h的ECA109-siRNA-Naa10组Naa10表达(0.521±0.163)明显低于ECA109空白组(0.923±0.292)、ECA109-siRNA-NC组(0.946±0.499),见图2;转染72 h的ECA109-siRNA-Naa10组Naa10表达(0.205±0.008)明显低于ECA109-空白组(0.617±0.006)、ECA109-siRNA-NC组(0.662±0.017),见图3。

1~3:ECA109-空白组、ECA109-siRNA-NC组、ECA109-siRNA-Naa10组,图3同图2 Western印迹检测siRNA转染ECA109细胞48 h的Naa10表达水平
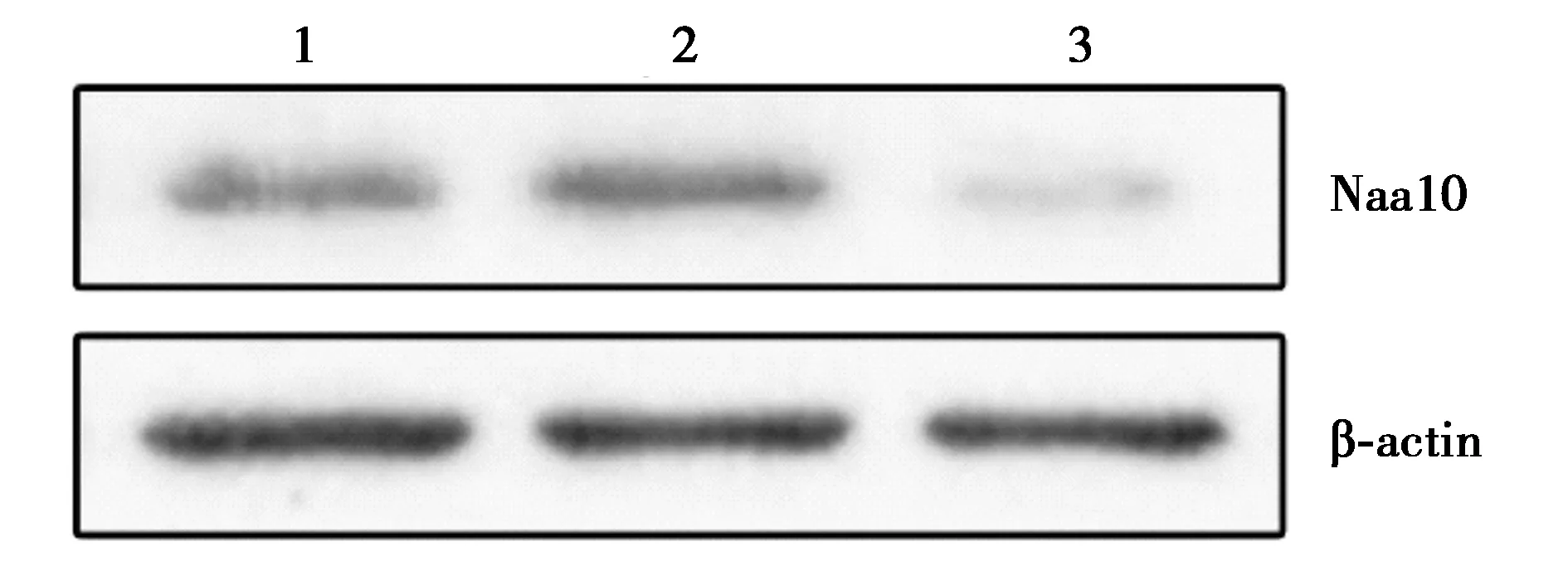
图3 Western印迹检测siRNA转染ECA109细胞72 h的Naa10表达水平
2.2不同浓度DDP作用后对各处理组细胞增长的抑制作用 图4显示,DDP在1~70 μg/ml浓度范围内,作用时间24 h不变的情况下,各组细胞随着DDP药物浓度增加,其存活率逐渐减弱。ECA109-siRNA-Naa10组细胞的IC50值〔(12.776±0.739)μg/ml〕较ECA109-siRNA-NC组〔(19.223±0.276)μg/ml〕、ECA109-空白组〔(18.526±0.568)μg/ml〕明显减小(P<0.001),ECA109-siRNA-NC组与ECA109-空白组细胞对DDP的敏感性基本一致,IC50值变化差异没有统计学意义(P=0.180)。ECA109-siRNA-NC组RI为1.037、ECA109-siRNA-Naa10组RI为0.689。
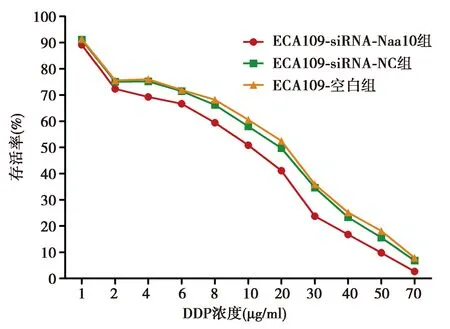
图4 不同浓度DDP作用后各组细胞的存活率
3 讨 论
目前临床上对食管癌患者主要采用手术治疗辅以放化疗等综合治疗手段,但其临床治疗效果及远期预后较差,术后复发率及病死率仍然居高不下,化疗药物出现耐药性是化疗失败的主要因素,DNA拷贝数变化、靶蛋白活性改变、DNA修复能力增强、抗凋亡能力增加等机制可能参与肿瘤化疗耐药的过程〔7〕。DDP是第一代铂类抗肿瘤药物,是食管癌化疗过程中较为常用的一种药物,疗效确切〔8〕。研究发现在两药或者三药联合化疗时,加与不加DDP,在疗效上存在着显著差别〔9〕。食管癌患者在临床化疗过程中常常会使用DDP作为基础化疗药物,在长期使用后也不可避免地出现耐药性。很多研究都在致力于寻找能够抑制多药耐药基因(MDR)1基因及其蛋白表达的药物〔10~13〕。
Fisher等〔14〕报道干扰Naa10后DNA修复蛋白(RAD)51表达下调,该基因是DNA修复复合体的成员之一,在DNA双链损伤修复过程中发挥重要的作用,因此推测Naa10可能具有DNA修复的功能。Arnesen等〔4〕研究发现Naa10也可能同时通过其他途径诱导肿瘤细胞对化学药物的耐受。在宫颈癌细胞中,Naa10表达下调表达可以促进凋亡,同时增加细胞对化疗药物柔红霉素的敏感性。上述研究表明,Naa10参与肿瘤耐药及影响药物敏感性的过程。有关Naa10 在食管癌对顺铂敏感性的作用机制尚未见明确报道。本研究在分子和细胞层次阐明了下调Naa10表达对食管癌药物敏感性的调控。
本研究结果显示,DDP作用后,ECA109-siRNA-Naa10组细胞的 IC50值明显降低,增加了ECA109细胞对DDP的敏感性,这与先前报道的结果不尽相同〔15,16〕,可能是因为Naa10在不同种类的癌症的药物敏感性的影响中存在着不同的生物学意义。尚有研究〔14,17~19〕表明,Naa10表达对肿瘤细胞生物学功能影响不全一致,在部分肿瘤中可以促进细胞周期进行,从而促进肿瘤细胞增殖,但也有研究认为 Naa10能抑制肿瘤增殖〔20〕。不同肿瘤细胞的凋亡过程中Naa10也同样起双重作用〔21,22〕。所以Naa10在不同肿瘤中对化疗药物的作用可能会表现出不同的敏感性的明确机制还需要更多的研究进一步证实。
综上,本研究成功构建以低表达Naa10的食管癌细胞株,发现低表达Naa10能够增强食管癌细胞对DDP的敏感性,这对食管癌耐药研究铺垫了基础,有望对现有化疗方案进行进一步优化,尤其是在耐药性产生后发挥重要作用。
