人乳头瘤病毒感染宫颈病变患者细胞因子水平的变化及其临床意义
2022-06-15郭春香孙淑华
郭春香,孙淑华
[鄂尔多斯市中心医院(康巴什部)妇产科,内蒙古 鄂尔多斯 017010]
人乳头瘤病毒(HPV)感染是导致宫颈癌病变的主要原因,其存在多种亚型,根据其致病程度可分为低危型和高危型。而引发宫颈病变的主要是高危型HPV,其通过与宿主正常宫颈细胞DNA整合,调控基因转录,继而导致宫颈细胞发生恶性增殖,在宫颈病变及其进展中发挥重要的作用[1]。HPV感染会影响机体免疫功能,其中高危型HPV感染与辅助性T细胞17(Th17) / 调节性T细胞(Treg)所介导的免疫应答紊乱密切相关,在宫颈癌疾病的进展中发挥了关键作用;Th17细胞分泌的白细胞介素-23(IL-23)能够激活炎性通路,促使机体产生炎症反应,并促进宫颈癌细胞的侵袭和转移,使宫颈癌进一步发展、恶化[2]。IL-2是主要由1型辅助性T细胞(Th1)细胞分泌的可调节免疫功能的细胞因子,其水平越低,提示患者机体免疫功能下降,可降低HPV感染宫颈病变患者抗病毒能力和抵抗力,宫颈病变随之恶化;IL-10是由2型辅助性T细胞(Th2)细胞分泌的能够抑制抗肿瘤免疫应答的细胞因子,可增加癌细胞发生免疫逃逸的风险,同时可抑制Th1细胞分泌IL-2,进一步抑制机体免疫功能。研究显示,HPV感染患者机体Th1/Th2失衡,Th2细胞功能增强,而Th1细胞功能低下,参与机体宫颈炎性病变与宫颈癌的发生与发展[3-4]。本研究旨在分析HPV感染宫颈病变患者细胞因子水平的变化及其临床意义,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2018年1月至2021年11月鄂尔多斯市中心医院(康巴什部)收治的150例HPV感染宫颈病变患者的临床资料,根据病变类型分为慢性宫颈炎(chroniccervicitis, CCS)组(26例)、宫颈癌(cervical cancer, CC)组(46例)、宫颈上皮内瘤变(cervical intraepithelial neoplasias, CIN)组(78例)。CCS组患者年龄23~63岁,平均(42.99±8.94)岁;饮酒史5例,吸烟史11例,糖尿病史7例,高血压史10例。CC组患者年龄23~63岁,平均(42.98±8.86)岁;饮酒史11例,吸烟史14例,糖尿病史13例,高血压史16例。CIN组患者年龄22~63岁,平均(42.98±8.24)岁;饮酒史19例,吸烟史24例,糖尿病史20例,高血压史21例。CCS组、CC组、CIN组患者一般资料比较,差异无统计学意义(P>0.05),组间可比。纳入标准:符合《妇产科学(第3版)》[5]中的相关诊断标准者;无子宫切除手术史者;近3个月内未进行过相关治疗者;未合并其他妇科疾病等。排除标准:妊娠期女性;伴有自身免疫性、血液系统疾病者;伴有肝、胃等恶性肿瘤疾病者等。本研究经院内医学伦理委员会批准。
1.2 分组方法 根据《妇产科学(第3版)》[5]中的CIN分级标准将CIN组患者分为CIN Ⅰ组(25例,细胞异型性轻,排列不整齐,但仍保持极性,异型细胞局限于上皮层下1/3),CIN Ⅱ组(27例,细胞异型性明显,排列较紊乱,异型细胞占据上皮层下1/3至2/3),CIN Ⅲ组(26例,重度不典型增生异型细胞超过全层的2/3,难以与原位癌区别)。根据临床特征对CC组患者进行分组,通过CT腹部检查观察是否发生淋巴结转移;通过宫颈活检病理检测观察是否发生脉管浸润,其中淋巴结转移情况:有淋巴结转移27例,无淋巴结转移19例;脉管浸润情况:有脉管浸润24例,无脉管浸润22例。
1.3 检测方法 患者入院后,采取空腹静脉血4 mL,取2 mL采用流式细胞仪(深圳迈瑞生物医疗电子股份有限公司,型号:BriCyte E6)检测外周血Th17细胞水平,取剩余2 mL空腹静脉血,离心(3 000 r/min,10 min)分离血清,采用全自动生化分析仪(江苏英诺华医疗技术有限公司,型号:DF-403)检测血清 IL-2、IL-10、IL-23 水平。
1.4 观察指标 ①比较CCS组、CC组、CIN组患者外周血Th17细胞及血清IL-2、IL-10、IL-23水平。②比较CIN组不同分级患者外周血Th17细胞及血清IL-2、IL-10、IL-23水平。③比较CC组患者不同临床特征(有/无淋巴结转移、有/无脉管浸润)患者外周血Th17细胞表达及血清 IL-2、IL-10、IL-23 水平。
1.5 统计学方法 使用SPSS 21.0统计软件分析数据,计量资料以(±s)表示,两组间比较行t检验,多组间比较采用重复测量方差分析。以P<0.05表示差异有统计学意义。
2 结果
2.1 CCS组、CC组、CIN组患者外周血Th17细胞及血清 IL-2、IL-10、IL-23水平 CCS组、CIN 组、CC 组患者外周血Th17细胞及血清IL-10、IL-23水平均逐渐升高,血清IL-2水平均逐渐降低,CC组患者外周血Th17细胞及血清IL-10、IL-23水平高于CCS组、CIN组,且CIN组高于CCS组;CC组患者血清IL-2水平低于CCS组、CIN组,且CIN组低于CCS组,差异均有统计学意义(均P<0.05),见表 1。
表1 CCS组、CC组、CIN组患者外周血Th17细胞及血清IL-2、IL-10、IL-23水平比较( ±s)
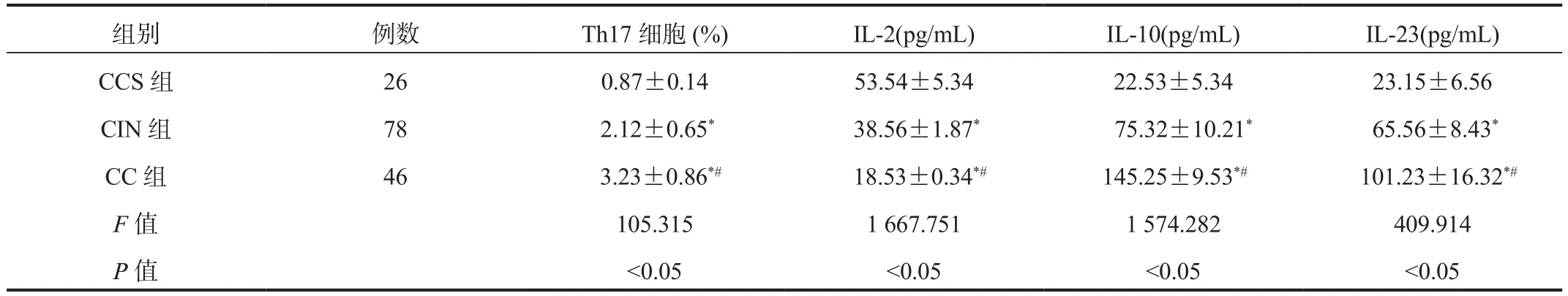
表1 CCS组、CC组、CIN组患者外周血Th17细胞及血清IL-2、IL-10、IL-23水平比较( ±s)
注:与CCS组比,*P<0.05;与CIN组比,#P<0.05。Th17:辅助性T细胞17;IL-2:白细胞介素-2;IL-10:白细胞介素-10;IL-23:白细胞介素-23。CCS:慢性宫颈炎;CIN:宫颈上皮内瘤变;CC:宫颈癌。
组别 例数 Th17细胞(%) IL-2(pg/mL) IL-10(pg/mL) IL-23(pg/mL)CCS 组 26 0.87±0.14 53.54±5.34 22.53±5.34 23.15±6.56 CIN 组 78 2.12±0.65* 38.56±1.87* 75.32±10.21* 65.56±8.43*CC 组 46 3.23±0.86*# 18.53±0.34*# 145.25±9.53*# 101.23±16.32*#F值 105.315 1 667.751 1 574.282 409.914 P值 <0.05 <0.05 <0.05 <0.05
2.2 CIN组不同分级患者外周血Th17细胞及血清IL-2、IL-10、IL-23 水平 CIN Ⅰ组、CIN Ⅱ组、CIN Ⅲ组患者外周血Th17细胞及血清IL-10、IL-23水平均逐渐升高,血清IL-2水平均逐渐降低;CIN Ⅲ组患者外周血Th17细胞及血清IL-10、IL-23水平高于CIN Ⅰ组、CIN Ⅱ组,且CIN Ⅱ组高于CIN Ⅰ组;CIN Ⅲ组血清IL-2水平低于CINⅠ组、CIN Ⅱ组,且CIN Ⅱ组低于CIN Ⅰ组,差异均有统计学意义(均P<0.05),见表2。
表2 CIN组不同分级患者外周血Th17细胞及血清IL-2、IL-10、IL-23水平比较( ±s)
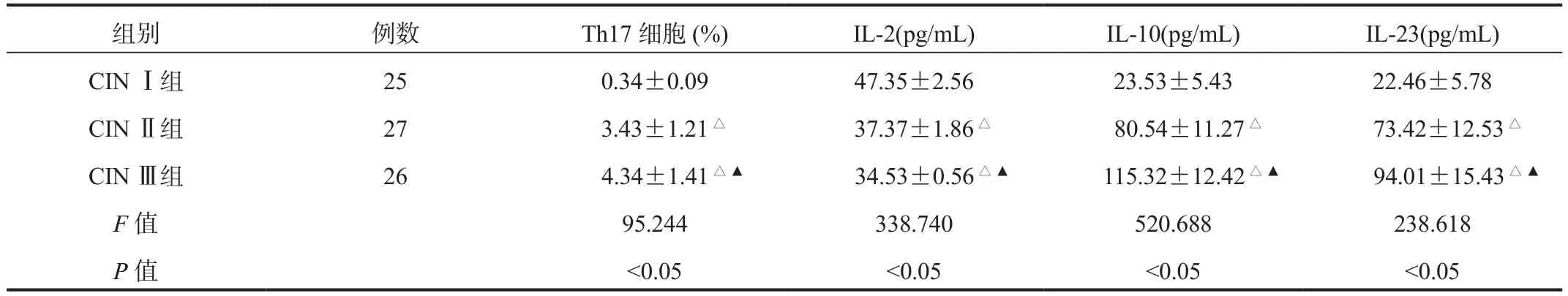
表2 CIN组不同分级患者外周血Th17细胞及血清IL-2、IL-10、IL-23水平比较( ±s)
注:与 CIN Ⅰ组比,△P<0.05;与 CIN Ⅱ组比,▲P<0.05。
组别 例数 Th17细胞(%) IL-2(pg/mL) IL-10(pg/mL) IL-23(pg/mL)CIN Ⅰ组 25 0.34±0.09 47.35±2.56 23.53±5.43 22.46±5.78 CIN Ⅱ组 27 3.43±1.21△ 37.37±1.86△ 80.54±11.27△ 73.42±12.53△CIN Ⅲ组 26 4.34±1.41△▲ 34.53±0.56△▲ 115.32±12.42△▲ 94.01±15.43△▲F值 95.244 338.740 520.688 238.618 P值 <0.05 <0.05 <0.05 <0.05
2.3 不同临床特征CC组患者外周血Th17细胞及血清IL-2、IL-10、IL-23水平 与无脉管浸润、无淋巴结转移CC患者比,有脉管浸润、有淋巴结转移CC患者外周血Th17细胞水平及血清IL-10、IL-23水平均升高,血清IL-2水平均降低,差异均有统计学意义(均P<0.05),见表3。
表3 不同临床特征CC组患者外周血Th17细胞及血清IL-2、IL-10、IL-23水平比较( ±s)
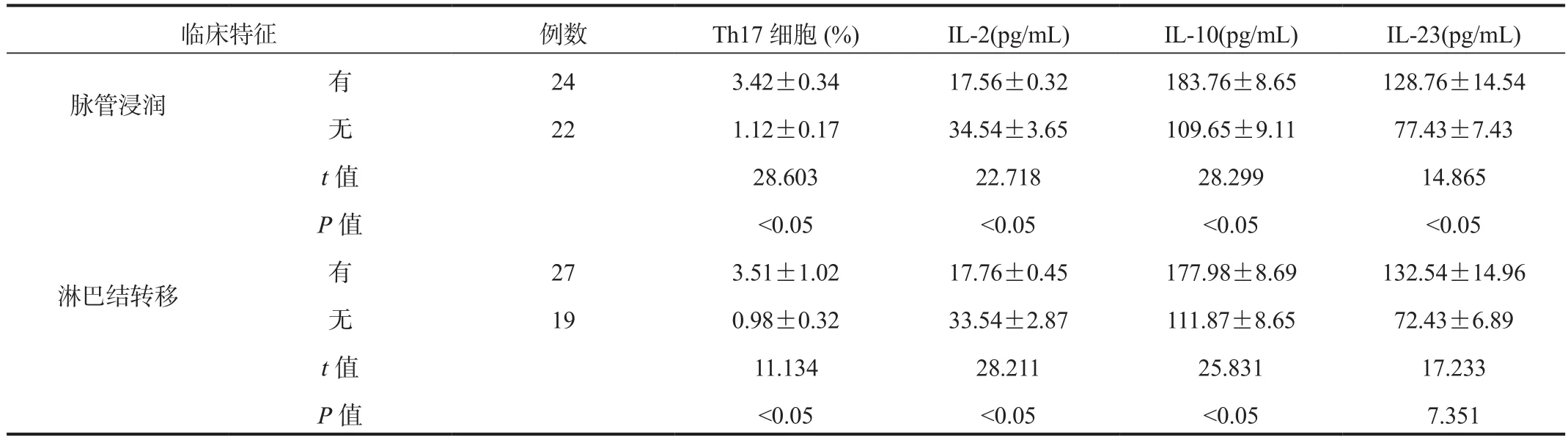
表3 不同临床特征CC组患者外周血Th17细胞及血清IL-2、IL-10、IL-23水平比较( ±s)
临床特征 例数 Th17细胞(%) IL-2(pg/mL) IL-10(pg/mL) IL-23(pg/mL)脉管浸润 有 24 3.42±0.34 17.56±0.32 183.76±8.65 128.76±14.54无22 1.12±0.17 34.54±3.65 109.65±9.11 77.43±7.43 t值 28.603 22.718 28.299 14.865 P值 <0.05 <0.05 <0.05 <0.05淋巴结转移 有 27 3.51±1.02 17.76±0.45 177.98±8.69 132.54±14.96无19 0.98±0.32 33.54±2.87 111.87±8.65 72.43±6.89 t值 11.134 28.211 25.831 17.233 P值 <0.05 <0.05 <0.05 7.351
3 讨论
当机体发生高危型HPV感染后,其首先以游离态潜伏于宫颈的基底细胞层,并于细胞层内大量增殖,HPV DNA基因组序列可整合宿主细胞基因组,增加基因组的不稳定性,从而增加宫颈细胞鳞状上皮增生的风险;且在高危型HPV持续性感染过程中,宫颈细胞组织受到HPV抗原刺激,启动包括适应性免疫、固有免疫等局部黏膜免疫反应,造成免疫抑制微环境,表现为Th17/Treg与Th1/Th2失衡,促进CIN、CC的发生。
张慧莉等[6]研究显示,高危型HPV患者存在明显的Th17/Treg细胞比例失衡,Th17细胞大量分泌白细胞介素-17(IL-17)和IL-23等因子,干扰抗原提呈细胞将HPV抗原提呈给相关的T淋巴细胞,从而促成HPV逃避机体免疫系统的攻击,导致宫颈病变逐步进展。本研究结果中,CCS组、CIN组、CC组患者外周血Th17细胞及血清IL-23水平均逐渐升高,提示Th17/Treg细胞失衡与宫颈病变过程相关,参与了CC的发生与发展。CIN及宫颈癌的发病机制通常受到机体细胞免疫应答的影响,能够表现出免疫耐受情况,在HPV感染患者抗肿瘤免疫中以Th1细胞介导的细胞免疫反应为主,典型细胞因子为IL-2,其可活化T细胞并诱导促进NK细胞增强机体抗肿瘤活性;但大多数肿瘤患者机体相关免疫因子会发生漂移,偏向Th2型细胞因子,以IL-10为代表,其可抑制巨噬细胞、NK细胞活性,通过多途径抑制抗肿瘤免疫应答,表现为免疫抑制,导致机体免疫功能低下,这也是HPV感染宫颈病变患者发生免疫逃逸的主要机制,促进患者病情进展,逐步发展为CC[7]。本研究结果显示,CCS组、CIN组、CC组患者血清IL-10水平均逐渐升高,IL-2水平均逐渐降低,提示HPV感染的宫颈病变患者发生了Th1/Th2漂移,且随着病变程度的加重,漂移越来越明显,不利于HPV的清除。
CIN为CC的癌前病变,其存在3个阶段:自然逆转、持续不变、进展为宫颈癌;机体免疫失衡后会导致患者出现自身免疫性疾病与肿瘤的发生,且随着CIN分级的增加,患者的癌变风险逐步增加[8]。本研究结果中,CIN Ⅰ组、CIN Ⅱ组、CIN Ⅲ组患者外周血Th17细胞水平及血清IL-10、IL-23水平均逐渐升高,血清IL-2水平均逐渐降低,提示CIN患者呈现出明显的Th2、Th17细胞因子高分泌现象,机体处于免疫抑制状态,且随着病情加重,上述现象越明显,最终导致CC的发生。受HPV感染的影响,患者机体Th17细胞活性增强,促使机体血管表皮生长因子的分泌,进一步促进肿瘤微血管生成,从而促进CC疾病进展,发生远处转移;同时其分泌的IL-23对Th17细胞的存活和增殖有重要意义,可间接促进CC的转移与浸润[9];此外,CC患者中T细胞中出现Th1/Th2漂移,且明显向Th2偏离时,则会引发NK细胞中抑制性受体和杀伤性受体发生明显失衡,进而导致肿瘤进一步发展和转移,促进CC进展[10]。本研究中,与无脉管浸润、无淋巴结转移CC患者比,有脉管浸润、有淋巴结转移CC患者外周血Th17细胞水平及血清IL-10、IL-23水平均升高,血清IL-2水平均降低,提示高危型HPV感染可影响机体免疫应答,且随着CIN向宫颈癌方向进展,Thl7/Treg与Th1/Th2平衡开始偏离,继而导致宫颈癌的发展与进一步恶化。
综上,随着HPV感染宫颈病变患者病情进展,外周血Th17细胞及血清IL-10、IL-23水平逐渐升高,血清IL-2水平逐渐降低,检测其水平有助于临床HPV感染宫颈病变患者的病情评估。因此临床需针对HPV感染宫颈病变患者严密监测Th1/Th2以及Th17/Treg相关细胞因子分布情况,评估患者病情,并予以及时治疗恢复患者免疫平衡,有效抑制CIN及CC的发生,改善HPV感染宫颈病变患者的预后。
