2种不同生长规格墨瑞鳕肌肉组织转录组测序分析
2022-06-15尤宏争肖蕊刘肖莲郝爽肖俊郭忠宝
尤宏争 肖蕊 刘肖莲 郝爽 肖俊 郭忠宝
摘要:【目的】掌握不同生長规格墨瑞鳕个体间差异表达基因的表达特点,为其功能相关基因深度挖掘及分子遗传育种提供科学依据。【方法】挑选同一养殖条件下极大个体和极小个体的墨瑞鳕,构建肌肉组织cDNA文库后,采用Illumina HiSeqTM 4000测序平台对存在生长差异的墨瑞鳕肌肉组织进行转录组测序分析,获得的Unigenes在Nr、Nt、Pfam、KOG/COG、Swiss-Prot、KEGG和GO等数据库中进行比对;通过FPKM及DEGseq筛选出差异表达基因,以GOseq和KOBAS对差异表达基因分别进行GO功能注释及KEGG信号通路富集分析,并采用MISA进行SSR鉴定分析。【结果】从墨瑞鳕肌肉组织中共测序获得39749条Unigenes,其长度范围在301~55230 bp,平均长度为1705 bp。注释到Nt、Nr、Swiss-Prot、Pfam数据库的Unigenes分别有27046、20824、18268和17772条,在7个数据库中均得到注释的Unigenes共计6742条,占Unigenes总数的16.96%。根据差异表达基因筛选条件P<0.05且|log2Fold Change|>1,共筛选出722个差异表达基因,其中上调基因308个、下调基因414个。差异表达基因GO功能注释分析结果表明,注释基因数目较多的GO功能条目包括细胞过程、代谢过程、膜、细胞器及结合等;KEGG信号通路富集分析发现,差异表达基因被成功富集到234条信号通路上,主要涉及磷脂酰肌醇3激酶/蛋白激酶信号通路、MAPK信号通路、胰岛素信号通路及FoxO信号通路等。在39749条Unigenes中鉴定筛选出22120个SSRs,占Unigene总数的55.65%,SSR的平均间距为3063 bp。【结论】基于转录组测序分析获得的墨瑞鳕肌肉组织差异表达基因以发挥结合、细胞过程及代谢过程等功能为主,且主要富集在PI3K-Akt信号通路、核糖体信号通路、FoxO信号通路及细胞凋亡等能量代谢相关通路上,通过共同协调而对墨瑞鳕的生长发育起调控作用。
关键词: 墨瑞鳕;肌肉;生长分化;差异表达基因;微卫星(SSR);转录组测序
中图分类号: S917;S965.321 文献标志码: A 文章编号:2095-1191(2022)03-0768-08
Analysis of muscle transcriptome of two different growth specifications of Maccullochella peelii
YOU Hong-zheng XIAO Rui LIU Xiao-lian HAO Shuang XIAO Jun GUO Zhong-bao
(1Tianjin Fisheries Research Institute, Tianjin 300221, China; 2Tianjin Counterpart Support Gansu Front Headquarters, Lanzhou, Gansu 730030,China; 3Guangxi Academy of Fishery Science, Nanning, Guangxi 530021, China)
Abstract:【Objective】To identify differentially expressed genes(DEGs) between small and large individuals of Maccullochella peelii, to provide a scientific basis for the deep study of genes related to growth and development, molecular genetics and breeding. 【Method】Significantly large and small M. peelii individuals obtained under the same breeding conditions were selected and their muscle tissue sampled to construct cDNA libraries. Transcriptome sequencing of M. peelii muscle tissues was conducted using the Illumina HiSeqTM 4000 sequencing platform. The obtained unigenes were compared in Nr, Nt, Pfam, KOG/COG, Swiss-Prot, KEGG and GO databases. The differentially expressed genes were screened using FPKM and DEGseq. GOseq and KOBAS were used to perform GO function annotation and KEGG signaling pathway enrichment, then identified by SSR by MISA. 【Results】A total of 39749 unigenes were generated from muscle tissue of M. peelii, with lengths ranging from 301 to 55230 bp and an average length of 1705 bp. There were 27046, 20824, 18268 and 17772 unigenes annotated to Nt, Nr, Swiss-Prot and Pfam databases, respectively. In total, 6742 unigenes were annotated by seven databases, accounted for 16.96% of the total unigenes. Differentially expressed genes were defined as those displaying an adjusted P<0.05 and |log2Fold Change|>1. A total of 722 DEGs were selected, consisting of 308 up-regulated genes and 414 down-regulated genes. The results of GO function annotation showed that the GO function items with a large number of annotation genes including cellular process, metabolic process, membrane, organelle and binding. KEGG signaling pathway enrichment revealed that DEGs were enriched in 234 signal pathways, mainly involving phosphatidylinositol 3 kinase / protein kinase signal pathway, MAPK signal pathway, insulin signal pathway and the FoxO signal pathway. A total of 22120 SSRs were identified from 39749 unigenes, accounted for 55.65% of the total number of unigenes. The average spacing of SSRs was 3063 bp. 【Conclusion】The obtained DEGs in M. peelii muscle tissue based on transcriptome sequencing mainly play the functions of binding, cellular process and metabolic process, and mainly enriched in PI3K Akt signal pathway, ribosomal signal pathway, FoxO signal pathway, apoptosis and other energy metabolism related pathways, which together regulate the growth and development of M. peelii.014C7B63-A0F3-407B-A447-0D6F456619EF
Key words: Maccullochella peelii; muscle; growth and differentiation; differentially expressed genes; microsatellite (SSR); transcriptome sequencing
Foundation items: National Modern Agriculture Industry Technology System Construction Project(CARS-46); Tianjin Science and Technology Planning Project (21YDTPJC00070); Guangxi Characteristic Freshwater Fish Industry Innovation Team Project of National Modern Agriculture Industry Technology System Construction Project (nycytxgxcxtd-2021-08-03)
0 引言
【研究意义】墨瑞鳕(Maccullochella peelii)又名虫纹鳕鲈、澳洲龙纹斑、河鳕、东洋鳕和澳洲淡水鳕鲈等,隶属于鲈形目(Perciforme)鮨鲈科(Percichthyidae)鳕鲈属(Maccullochella)。墨瑞鳕原产于澳大利亚东南部墨累—达令盆地,因其肉质细嫩、味道鲜美,且富含EPA(二十碳五烯酸)和DHA(二十二碳六烯酸),在澳大利亚素有“国宝鱼”之称(罗钦等,2020)。目前,在我国天津、江浙及山东等地已引进养殖,是一个具有良好发展前景的淡水养殖优质品种(饶秋华等,2020);但在养殖过程中,常出现相同养殖环境中规格不一的情况,严重制约着养殖效益的进一步提高。关于墨瑞鳕生长缓慢、规格不一的原因至今尚未明确,因此,亟待对存在生长差异的墨瑞鳕肌肉组织进行转录组测序分析,为解决其生长缓慢的问题提供思路,进而保障墨瑞鳕养殖业持续高质量发展。【前人研究进展】转录组测序是通过高通量测序技术对特定条件下机体某组织的所有转录本数据进行比对分析及功能注释,旨在挖掘与性状相关的功能基因和信号通路(白献晓等,2017;崔凯等,2019)。随着高通量测序技术的快速发展及测序成本的不断降低,转录组测序技术在水产研究领域中已得到广泛应用(张毓霞等,2018;赵彦花等,2019;黄新芯等,2021)。严璐琪等(2016)采用Illumina高通量测序对黑壳与金壳葡萄牙牡蛎进行转录组分析,通过功能注释与比对分析鉴定出14个与壳色表达有关的贝壳基质蛋白基因,其中5个下调基因可能与金壳基因表达相关。刘思嘉等(2018)采用转录组测序技术检测低温耐受与低温敏感鲤品种在低温胁迫下的差异表达基因,发现编码糖酵解/糖质新生途径中的多个关键酶基因可能与其低温适应过程有关。孟玮等(2021)基于高通量测序技术对不同盐度条件下的日本黄姑鱼幼鱼肌肉组织进行转录组测序,结果表明日本黄姑鱼对急性盐度胁迫的适应可能是一个涉及多组织和多基因的复杂过程,盐度变化会影响肌肉组织的离子通道、离子转运体及蛋白降解和免疫系统功能。关于鱼类生长优势分子机制的研究成果也取得长足进展,林明德(2019)基于高通量测序获得的杂交石斑鱼和褐点石斑鱼脑组织、肝脏和肌肉转录组数据,筛选出一批生长相关的差异表达基因;罗志嘉等(2019)以生长存在显著差异的快长组和慢长组角鳖肝脏为材料,通过RNA-Seq测序分析探索了角鱉生长发育的分子机制;王登东等(2019)通过转录组测序在云龙石斑鱼脑组织、垂体、肝脏和肌肉样本中发现成纤维生长因子、表皮生长因子、血管生成因子等相关基因表达差异显著,并预测了云龙石斑鱼生长优势的重要贡献因素;冯培哲(2020)通过对金钱鱼垂体和肝脏组织的转录组分析,为进一步研究金钱鱼的生长调控机制和分子特征提供了理论依据;李雅慧等(2021)通过转录组测序对比2种不同规格罗氏沼虾基因表达量的差异,探究其生长差异的分子机理;王红明等(2021)通过转录组数据分析了饲料添加剂对龙胆石斑鱼的生长性能等影响。可见,在水产动物中,高通量测序已广泛应用于生长、发育等相关生命活动的分子机制研究。【本研究切入点】目前,关于墨瑞鳕的研究主要集中在遗传多样性检测(Loughnan et al.,2010)、资源恢复(Forbes et al.,2016)及饲料营养(Francis et al.,2019)等方面。此外,Downing和Litvak(2001)研究表明光照强度能增加黑线鳕幼鱼的摄食量,进而影响其生长;狄正凯(2020)通过探究光照因子对墨瑞鳕生长性能、肌肉营养成分及应激反应影响的变化规律,证实合理选择光照条件对促进墨瑞鳕生具有重要意义;但尚无针对墨瑞鳕生长差异产生机理阐释及转录组学分析的研究报道。【拟解决的关键问题】挑选同一养殖条件下极大个体和极小个体的墨瑞鳕,通过高通量测序对其肌肉组织进行转录组分析,筛选出差异表达基因,并利用GO功能注释及KEGG信号通路富集进行差异性分析,旨在掌握不同规格个体间差异表达基因的表达特点,为墨瑞鳕功能相关基因深度挖掘及分子遗传育种提供科学依据。
1 材料与方法
1. 1 试验材料
供试墨瑞鳕为天津盛亿养殖有限公司饲养的5月龄苗种,在同一养殖池中随机选取极大个体和极小个体各3尾,对应的体长分别为13.37±0.29和7.75±0.06 cm,体质量分别为41.23±3.10和9.57±0.21 g。采集墨瑞鳕肌肉组织,经液氮速冻后-80 ℃保存备用。
1. 2 cDNA文库构建及高通量测序
使用TRIzol Reagent试剂盒(Invitrogen)对提取肌肉组织总RNA,分别采用琼脂糖凝胶电泳检测RNA是否降解,NanoDrop检测OD260/280比值,Qubit检测RNA浓度,Agilent 2100 Bioanalyzer检测RIN值(RNA integrity number,分子完整数)。根据TruSeq DNA Library Prep Kit (Illumina)说明,进行cDNA合成、末端修复、连接接头及扩增纯化,最终获得墨瑞鳕肌肉组织cDNA文库。构建好的cDNA文库委托天津诺禾致源生物信息科技有限公司使用Illumina HiSeqTM 4000测序平台完成测序。014C7B63-A0F3-407B-A447-0D6F456619EF
1. 3 序列拼接及功能注释
将测序所得原始序列(Raw reads)中带接头且低质量的序列删除,即得到有效序列(Clean reads)。应用Trinity对Cleans reads进行拼接,选择最长的转录本作为Unigenes。将所得的Unigenes在Nr、Nt、Pfam、KOG/COG、Swiss-Prot、KEGG和GO等数据库中进行比对,以获得Unigenes的功能注释信息。
1. 4 差异基因表达分析
利用Bowtie将每个样品的Clean reads比对到组装出来的转录本上,使用RSEM统计每个样品比对到每个基因上的Read count数目,根据FPKM估算基因的表达水平。采用DESeq筛选差异表达基因,差异表达基因筛选条件:P<0.05且|log2 Fold Change|>1。采用GOseq和KOBAS进行差异表达基因的GO功能注释分析及KEGG信号通路富集分析。
1. 5 SSR鉴定分析
采用MISA对获得的Unigenes进行微卫星位点(SSR)查找,其筛选参数设为:单核苷酸重复、二核苷酸重复、三核苷酸重复、四核苷酸重复、五核苷酸重复、六核苷酸重复的最少重复次数分别为10、6、5、5、5和5。
2 结果与分析
2. 1 转录组测序与组装结果
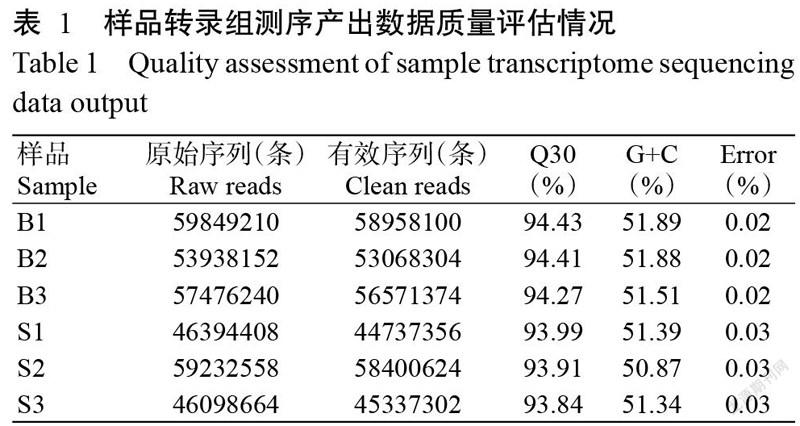
采用Illumina HiSeqTM 4000测序平台对极大个体和极小个体(各3尾)进行转录组测序,测序产出数据的质量评估情况详见表1。6个样品共测序获得322989232条Raw reads,去除低质量序列后获得317073060条Clean reads。各样品的Q30均在93.00%以上,GC含量在50.00%以上,表明转录组测序产出量丰富且质量良好。通过数据组装共得到39749条Unigenes,其长度范围在301~55230 bp,平均长度为1705 bp。
2. 2 Unigenes注释结果
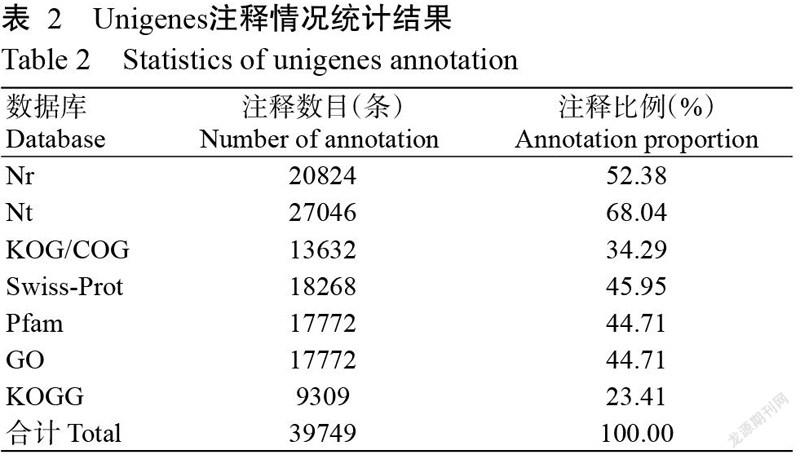
拼接获得的39749条Unigenes在Nr、Nt、Pfam、KOG/COG、Swiss-Prot、KEGG及GO等数据库中进行比对,结果如表2所示,注释到Nt、Nr、Swiss-Prot和Pfam数据库的Unigenes分别有27046、20824、18268和17772条,其中注释到Nr数据库的Unigenes占Unigenes总数的52.38%(表2)。在7个数据库中均得到注释的Unigenes共计6742条,占Unigenes总数的16.96%;至少在1个数据库中得到注释的Unigenes共计29069条,占Unigenes总数的73.13%,剩下未注释的Unigenes可能是未知基因。
2. 3 差异表达基因筛选结果
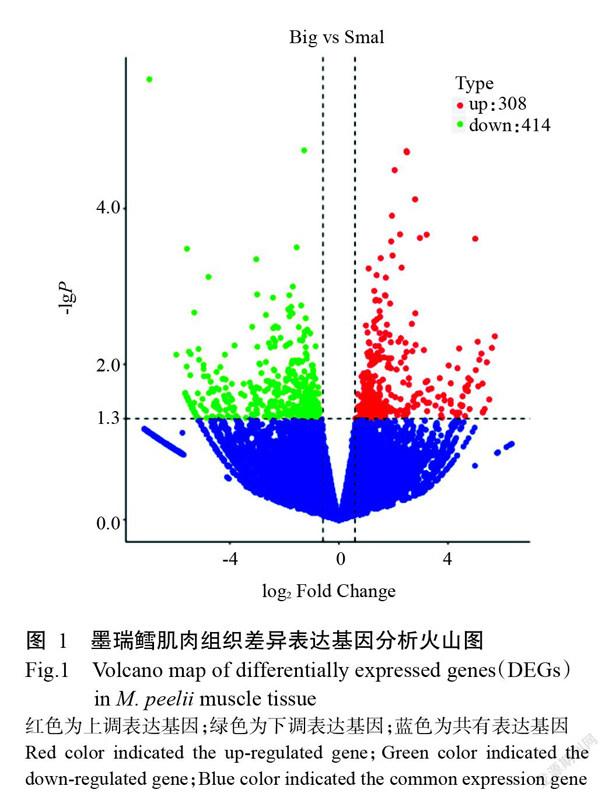
根据差异表达基因筛选条件P<0.05且|log2 Fold Change|>1,采用DESeq进行筛选差异表达基因,结果筛选得到722个差异表达基因,其中上调基因308个、下调基因414个(图1)。
2. 4 差异表达基因GO功能注释分析结果
对722个差异表达基因进行GO功能注释分析,结果表明差异表达基因分别注释到生物学过程(Biological process)、细胞组分(Cellular component)及分子功能(Molecular function)三大功能分类(图2)。在生物学过程中,差异表达基因主要注释到细胞过程(Cellular process)、代谢过程(Metabolic process)、單有机体过程(Single organism process)、有机物代谢过程(Metabolic process of organic matter)及初级代谢过程(Primary metabolic process)等方面;在细胞组成中,差异表达基因主要注释到膜(Membrane)、细胞器(Organelle)及高分子复合物(Polymer complex)等方面;在分子功能中,差异表达基因主要注释到结合(Combination)、催化活性(Catalytic activity)、水解酶活性(Hydrolase activity)及GTPase活性(GTPase activity)等方面。
2. 5 差异表达基因KEGG信号通路富集分析结果
差异表达基因KEGG信号通路富集分析结果(图3)显示,722个差异表达基因被成功富集到234条KEGG信号通路上,且主要富集在磷脂酰肌醇3激酶/蛋白激酶信号通路(PI3K-Akt signaling pathway)、MAPK信号通路(MAPK signaling pathway)、半胱氨酸和蛋氨酸代谢(Cysteine and methionine metabolism)、PPAR信号通路(PPAR signaling pathway)、B细胞受体信号通路(B cell receptor signaling pathway)等信号通路上。
2. 6 SSR鉴定分析结果
在39749条Unigenes中鉴定筛选出22120个SSRs,占Unigenes总数的55.65%,SSR的平均间距为3063 bp。其中,复合型SSR有2163个,单核苷酸重复SSR有9483个,二核苷酸重复SSR有6742个,三核苷酸重复SSR有3326个,四核苷酸重复SSR有356个,五核苷酸重复SSR有36个,六核苷酸重复SSR有14个。在单核苷酸重复类型中,数量最多的重复基元为A/T(8535个),二核苷酸重复中出现次数最多的为AC/GT(2569个)。
3 讨论
生长分化是鱼类生长过程中的普遍现象,同一群体中的个体由于受到遗传、环境及营养等因素的协同影响,通常会出现生长分化现象(石军等,2013)。为揭示墨瑞鳕的生长分化机理,本研究针对同一群体中不同生长规格的墨瑞鳕肌肉组织进行转录组测序,结果共获得39749条Unigenes,其长度为301~55230 bp,平均长度为1705 bp,数据产出与质量均满足转录组分析及差异表达基因挖掘的基本需求。通过与Nr、Nt、Pfam、KOG/COG、Swiss-Prot、KEGG和GO等数据库中的序列进行比对及功能注释,结果表明,有29069条Unigenes与其他物种的已知基因具有不同程度的同源性,占Unigenes总数的73.13%;其中在GO和KEGG数据库中注释富集到722条编码氨基酸次生代谢途径关键酶基因。014C7B63-A0F3-407B-A447-0D6F456619EF
高通量转录组测序技术在丰富物种基因资源的同时,也为分子标记的开发提供了有利条件(贾昌路等,2015;宋尚桥等,2020;彭金英和伊成器,2021)。与传统的磁珠富集法相比,利用转录组测序进行分子标记开发具有更周期短、费用低廉、标记量大、标记与功能基因连锁等优势(黄思婕,2020),目前已在水产研究领域得到广泛应用(龚诗琦等,2016;赵彦花等,2019;Francis et al.,2019;方军等,2020;李喜莲等,2020)。本研究在39749条Unigenes中筛选出22120个SSRs,其发生率为55.65%,远高于龚诗琦等(2016)在黄姑鱼(39.30%)、方军等(2020)在青蛤(10.76%)、李喜莲等(2020)在红螯螯虾(33.74%)中的筛选效果,说明本研究转录组数据中墨瑞鳕的SSR分子标记含量更丰富,可为下一步开展群体遗传结构分析、亲缘关系鉴定、种质资源保护及良种选育提供技术支撑。
本研究的差异表达基因GO功能注释分析结果表明,注释基因数目较多的GO功能条目包括细胞过程、代谢过程、膜、细胞器及结合等;同时部分差异表达基因富集在肌钙蛋白复合物(Troponin complex)、横纹肌细丝(Striated muscle filament)、肌原纤维(Myofibril)、肌节(Sarcomere)、肌丝(Myofilament)、收缩纤维(Shrinkage fiber)、收缩纤维部分(Shrin-kage fiber part)、蛋白质分解代谢过程调节(Regulation of protein catabolism)、组织再生(Tissue regene-ration)、发育生长(Development and growth)、肌动蛋白结合(Actin binding)、生长因子活性(Growth factor activity)、胰岛素样生长因子结合(Insulin like growth factor binding)、生长因子结合(Growth factor binding)、细胞生长调节(Cell growth regulation)及细胞生长(Cell growth)等GO功能条目,这些基因可能参与墨瑞鳕的生长调控过程,可进一步进行基因功能与表达模式研究。KEGG信号通路富集分析结果显示,差异表达基因被成功富集到234条信号通路上,富集度最高的是磷脂酰肌醇3激酶/蛋白激酶信号通路。此外,本研究筛选出部分与生长过程密切相关的KEGG信号通路,包括胰岛素信号通路(Insulin signaling pathway)、MAPK信号通路、细胞凋亡(Apoptosis)、FoxO信号通路(FoxO signaling pathway)、TGF-β信号通路(TGF-beta signaling pathway)等,与Zhang等(2020)的研究结果一致。磷脂酰肌醇3激酶/蛋白激酶信号通路可被多种生长因子和信号传导复合物,包括成纤维细胞生长因子(FGF)、血管内皮生长因子(VEGF)、人生长因子(HGF)、血管位蛋白 I(Ang1)和胰岛素等激活,活化的Akt通过磷酸化作用调控一系列下游因子以实现对细胞增殖、分化、凋亡和葡萄糖转运等功能的调控(狄正凯,2020)。该结论为进一步阐释墨瑞鳕的生长发育机理和调控网络提供了基础数据支持。
4 讨论
基于转录组测序分析获得的墨瑞鳕肌肉组织差异表达基因以发挥结合、细胞过程及代谢过程等功能为主,且主要富集在PI3K-Akt信号通路、核糖体信号通路、FoxO信号通路及细胞凋亡等能量代谢相关通路上,通过共同协调而对墨瑞鳕的生长发育起调控作用。
参考文献:
白献晓,张子敬,王璟,徐照学. 2017. 转录组测序技术在家畜遗传育种中的应用研究进展[J]. 河南农业科学,46(4):6-9. [Bai X X,Zhang Z J,Wang J,Xu Z X. 2017. Application of transcriptome sequencing technology in genetic breeding of livestock[J]. Journal of Henan Agricultural Sciences,46(4):6-9.] doi:10.15933/j.cnki.1004-3268. 2017.04.002.
崔凯,吴伟伟,刁其玉. 2019. 转录组测序技术的研究和应用进展[J]. 生物技术通报,35(7):1-9. [Cui K,Wu W W,Diao Q Y. 2019. Application and research progress on transcriptomics[J]. Biotechnology Bulletin,35(7):1-9.] doi:10.13560/j.cnki.biotech.bull.1985.2019-0374.
狄正凯. 2020. 光照对循环水系统中墨瑞鳕生长、肌肉营养成分及应激反应的影响[D]. 上海:上海海洋大学. [Di Z K. 2020. Effects of light factor on the growth,muscle nutrition and stress response of Murray cod in recirculating aquaculture[D]. Shanghai:Shanghai Ocean University.] doi:10.27314/d.cnki.gsscu.2020.000469.
方军,沈彦鹏,张雷雷,李腾腾,邵艳卿. 2020. 基于转录组数据的青蛤微卫星标记开发与验證[J]. 应用海洋学学报,39(2):214-220. [Fang J,Shen Y P,Zhang L L,Li T T,Shao Y Q. 2020. Development and validation of SSR mar-kers in Cyclina sinensis[J]. Journal of Applied Oceanography,39(2):214-220.] doi:10.3969/J.ISSN.2095-4972. 2020.02.008.014C7B63-A0F3-407B-A447-0D6F456619EF
冯培哲. 2020. 金钱鱼生长抑素(Somatostatin)在生长调控中的功能研究[D]. 湛江:广东海洋大学. [Feng P Z. 2020. Functions of somatostatin(SST) in growth regulation of Scatophagus argus[D]. Zhanjiang:Guangdong Ocean University.] doi:10.27788/d.cnki.ggdhy.2020.000145.
龚诗琦,王志勇,肖世俊,林爱强,谢仰杰. 2016. 黄姑鱼转录组SSR的开发与验证[J]. 集美大学学报(自然科学版),21(4):241-246. [Gong S Q,Wang Z Y,Xiao S J,Lin A Q,Xie Y J. 2016. Development and validation of SSR based on transcriptome of Yellow Drum,Nibea albiflora[J]. Journal of Jimei University(Natural Science),21(4):241-246.] doi:10.3969/j.issn.1007-7405.2016.04.001.
黄思婕. 2020. 持续性高温对雌雄罗非鱼肌肉生长的影响机制研究及可变剪接分析[D]. 上海:上海海洋大学. [Huang S J. 2020. Study on the growth mechanism of muscle after persistent high temperature to male and female Nile tilapia and alternative splicing analysis[D]. Shanghai:Shanghai Ocean University.] doi:10.27314/d.cnki.gsscu.2020. 000392.
黄新芯,蒋艳琳,蒋小姿,杨天燕. 2021. 基于高通量转录组测序技术的龙头鱼微卫星信息分析[J]. 浙江海洋大学学报(自然科学版),40(3):189-197. [Huang X X,Jiang Y L,Jiang X Z,Yang T Y. 2021. Analysis of microsatellite markers in harpadon nehereus based on transcriptome sequencing Illumina HiseqTM 2500[J]. Journal of Zhejiang Ocean University(Natural Science),40(3):189-197.] doi:10.3969/j.issn.1008-830X.2021.03.001.
贾昌路,张瑶,朱玲,张锐. 2015. 转录组测序技术在生物测序中的应用研究进展[J]. 分子植物育种,13(10):2388-2394. [Jia C L,Zhang Y,Zhu L,Zhang R. 2015. Application progress of transcriptome sequencing technology in biological sequencing[J]. Molecular plant Breeding,13(10):2388-2394.] doi:10.13271/j.mpb.013.002388.
李喜莲,郭建林,李倩,施伟达,黄振远,顾志敏. 2020. 红螯螯虾转录组中的SSR位点信息分析[J]. 湖北农业科学,59(7):207-211. [Li X L,Guo J L,Li Q,Shi W D,Huang Z Y,Gu Z M. 2020. The information analysis of SSR loci in the red claw crayfish(Cherax quadricarinatus) transcriptome[J]. Hubei Agricultural Sciences,59(7):207-211.] doi:10.14088/j.cnki.issn0439-8114.2020.07.043.
李雅慧,刘志伟,戴习林. 2021. 生长滞缓与正常罗氏沼虾转录组差异分析[J]. 基因组学与应用生物学,40(1):89-100. [Li Y H,Liu Z W,Dai X L. 2021. Transcriptome analysis of growth retardation and normal Macrobrachium rosenbergii[J]. Genomics and Applied Biology,40(1):89-100.] doi:10.13417/j.gab.040.000089.
林明德. 2019. 基于转录组测序对杂交石斑鱼及其母本褐点石斑鱼的比较分析[D]. 湛江:广东海洋大学. [Lin M D. 2019. Comparative analysis of hybrid grouper (Epinephelus fuscoguttatus ♀×E. Polyphekadion ♂) and its female parent tiger grouper(E. Fuscoguttatus) based on transcriptome sequencing[D]. Zhanjiang: Guangdong Ocean University.] doi:10.27788/d.cnki.ggdhy.2019.000082.
刘思嘉,田菲,张存芳,乔志刚,赵凯. 2018. 鲤在低温胁迫下肝胰腺转录组测序分析[J]. 生物技术通報,34(11):168-178. [Liu S J,Tian F,Zhang C F,Qiao Z G,Zhao K. 2018. Transcriptome sequencing and analysis of hepatopancreas from carps under cold stress[J]. Biotechnology Bulletin,34(11):168-178.] doi:10.13560/j.cnki.biotech.bull.1985.2018-0503.014C7B63-A0F3-407B-A447-0D6F456619EF
罗钦,李冬梅,黄敏敏,饶秋华,刘洋,翁伯琦,潘葳,罗土炎. 2020. 不同生长阶段墨瑞鳕脂肪酸组成及主成分分析[J]. 核农学报,34(4):788-795. [Luo Q,Li D M,Huang M M,Rao Q H,Liu Y,Weng B Q,Pan W,Luo T Y. 2020. Fatty acid compositions and principal component analysis in muscle of Murray cod at different growth stages[J]. Journal of Nuclear Agricultural Sciences,34(4):788-795.] doi:10.11869/j.issn.100-8551.2020.04.0788.
罗志嘉,李潇,曾丹,王佩,彭娜,王晓清. 2019. 角鳖RNA-seq转录组分析及生长相关基因筛选[J]. 基因组学与应用生物学,38(4):1480-1487. [Luo Z J,Li X,Zeng D,Wang P,Peng N,Wang X Q. 2019. RNA-seq transcriptome analysis and growth related gene screening of Apalone spinifera[J]. Genomics and Applied Biology,38(4):1480-1487.] doi:10.13417/j.gab.038.001480.
孟玮,徐开达,李振华,史会来,周永东. 2021. 急性盐度胁迫对日本黄姑鱼肌肉组织转录组的影响[J]. 水产学报,45(5):649-660. [Meng W,Xu K D,Li Z H,Shi H L,Zhou Y D. 2021. Transcriptome analysis of Nibea japonica under acute salinity stress[J]. Journal of Fisheries of China,45(5):649-660.] doi:10.11964/jfc.20200612317.
彭金英,伊成器. 2021. 蓬勃發展的表观转录组学[J]. 中国生物化学与分子生物学报,37(4):407-418. [Peng J Y,Yi C Q. 2021. Flourishing epitranscriptomics research[J]. Chinese Journal of Biochemistry and Molecular Biology,37(4):407-418.] doi:10.13865/j.cnki.cjbmb.2021.03.1076.
饶秋华,刘洋,张志灯,罗钦,罗土炎. 2020. 加快墨瑞鳕新兴水产养殖业发展的对策[J]. 科技导报,38(15):52-58. [Rao Q H,Liu Y,Zhang Z D,Luo Q,Luo T Y. 2020. Countermeasures for speeding up the emerging Murray cod (Maccullochella peelii) industry development[J]. Science & Technology Review,38(15):52-58.] doi:10.3981/j.issn.1000-7857.2020.15.006.
石军,褚武英,张建社. 2013. 鱼类肌肉生长分化与基因表达调控[J]. 水生生物学报,37(6):1145-1152. [Shi J,Chu W Y,Zhang J S. 2013. Muscle growth,differentiation and gene expression regulation in fish[J]. Acta Hydrobiologica Sinica,37(6):1145-1152.] doi:10.7541/2013.155.
宋尚桥,马围围,张超龙,曾素先,孙翠翠,李鑫,严瑾,黎宗强. 2020. 基于转录组测序生物信息学分析的研究进展[J]. 中国畜牧兽医,47(2):392-398. [Song S Q,Ma W W,Zhang C L,Zeng S X,Sun C C,Li X,Yan J,Li Z Q. 2020. Advances in bioinformatics analysis based on transcriptome sequencing[J]. China Animal Husbandry & Veterinary Medicine,47(2):392-398.] doi:10.16431/j.cnki. 1671-7236.2020.02.009.
王登东,杨玉鹏,郑乐云,孙恺辉,何家瑞,王崇伟,邓贤铭,李水生,张勇,林浩然. 2019. 云龙石斑鱼生长优势的转录组研究[J]. 海南热带海洋学院学报,26(2):1-8. [Wang D D,Yang Y P,Zheng L Y,Sun K H,He J R,Wang C W,Deng X M,Li S S,Zhang Y,Lin H R. 2019. Transcriptomic studies of a novel hybrid“Yunlong grouper”on the growth superiorities[J]. Journal of Qiongzhou University,26(2):1-8.] doi:10.13307/j.issn.2096-3122.2019.02.01.
王红明,丁雪婧,陈俭,宋守钢,谭北平,章双. 2021. 饲料中添加甘露寡糖对珍珠龙胆石斑鱼生长性能、血清免疫指标、转录组及肠道菌群的影响[J]. 动物营养学报,33(12):6982-6998. [Wang H M,Ding X J,Chen J,Song S G,Tan B P,Zhang S. 2021. Effects of dietary mannan-oligosaccharides on growth performance,serum immune indices,transcriptome and intestinal microflora of Epinephelus fuscoguttatus ♀×Epinephelus lanceolatus ♂[J]. Chinese Journal of Animal Nutrition,33(12):6982-6998.] doi:10.3969/j.issn.1006-267x.2021.12.039.014C7B63-A0F3-407B-A447-0D6F456619EF
严璐琪,郭香,巫旗生,祁剑飞,宁岳,王晓清,曾志南. 2016. 葡萄牙牡蛎外套膜转录组测序及壳色基因挖掘[J]. 湖南农业大学学报(自然科学版),42(4):409-414. [Yan L Q,Guo X,Wu Q S,Qi J F,Ning Y,Wang X Q,Zeng Z N. 2016. Transcriptome analysis and shell gene mining on Crassostrea angulata[J]. Journal of Hunan Agricultural University(Natural Sciences),42(4):409-414.] doi:10. 13331/j.cnki.jhau.2016.04.012.
张毓霞,石戈,王日昕,宫延斌,范美华,廖智. 2018. 大弹涂鱼皮肤转录组测序及抗菌肽基因分析[J]. 生命科学研究,22(1):26-35. [Zhang Y X,Shi G,Wang R X,Gong Y B,Fan M H,Liao Z. 2018. Transcriptome of Boleophthalmus pectinirostris skin and analysis of antimicrobial peptide related unigenes[J]. Life Science Research,22(1):26-35.] doi:10.16605/j.cnki.1007-7847.2018.01.005.
趙彦花,区又君,温久福,李加儿,周慧. 2019. 基于转录组测序技术的黄唇鱼SSR分子标记筛选[J]. 南方农业学报,50(9):2078-2087. [Zhao Y H,Ou Y J,Wen J F,Li J E,Zhou H. 2019. Development of SSR markers in Bahaba flavolabiata by transcriptome sequencing[J]. Journal of Southern Agriculture,50(9):2078-2087.] doi:10.3969/j.issn.2095-1191.2019.09.26.
Dowming G,Litvak M. 2001. The effect of light intensity and spectrum on the incidence of first feeding by larval haddock[J]. Journal of Fish Biology,59(6):1566-78. doi:10.1111/j.1095-8649.2001.tb00221.x.
Forbes J,Watts R J,Robinson W A,Baumgartner L J,McGuffie P,Cameron L M,Crook D A. 2016. Assessment of stocking effectiveness for Murray cod (Maccullochella peelii) and golden perch (Macquaria ambigua) in ri-vers and impoundments of south-eastern Australia[J]. Marine and Freshwater Research,67(10):1410-1419. doi:10.1071/MF15230.
Francis D S,Cleveland B J,Jones P L,Turchini G M,Conlan J A. 2019. Effects of PUFA-enriched Artemia on the early growth and fatty acid composition of Murray cod larvae[J]. Aquaculture,513:734362. doi:10.1016/j.aquaculture.2019.734362.
Loughnan S R,Baranski M D,Robinson N A,Jones P L P,Burridge C P. 2010. Microsatellite loci for studies of wild and hatchery Australian Murray cod Maccullochella peelii peelii(Percichthyidae)[J]. Molecular Ecology Notes,4(3):382-384. doi:10.1111/j.1471-8286.2004.00660.x.
Zhang J H,Shen Y B,Xu X Y,Dai Y F,Li J L. 2020. Transcriptome analysis of the liver and muscle tissues of black carp (Mylopharyngodon piceus) of different growth rates[J]. Marine Biotechnology,22:706-716. doi:10.1007/ s10126-020-09994-z.
(责任编辑 兰宗宝)014C7B63-A0F3-407B-A447-0D6F456619EF
