天然东北红豆杉林土壤细菌多样性研究
2022-06-15贾丹王琪瑶肖宇飞刘玉龙梁素钰
贾丹 王琪瑶 肖宇飞 刘玉龙 梁素钰
摘 要:利用高通量测序方法研究不同林龄的东北红豆杉林根际及非根际土壤细菌多样性,同时测定土壤养分(总有机质、全氮、全磷及全钾)含量。通过对土壤细菌多样性及其与土壤养分之间关系的研究,得到红豆杉林根际与非根际土壤微生物的结构和土壤养分因子对土壤微生物多样性的影响等信息,从而对天然东北红豆杉的保护提供理论支持。结果表明,东北红豆杉不同林龄之间、根际与非根际之间土壤肥力均差异显著(P<0.05);实验地区土壤细菌共分为44个菌门,优势菌门为变形菌门(相对丰度为40.54%~43.89%)和酸杆菌门(相对丰度为16.53%~28.81%);土壤全磷与细菌的相关性较高;所有样地共同解释30.46%的细菌变异率;成熟林样地内的主要细菌菌门为变形菌门、厚壁菌门、拟杆菌门、芽单胞菌门、绿弯菌门、棒状杆菌门和硝化螺旋菌门。土壤总有机质、全磷、全氮和全钾含量在成熟林样地内占主导地位,所以,天然东北红豆杉根際土壤细菌多样性丰度低于非根际土壤;病腐木根际土壤细菌对土壤细菌变异的贡献率最大;引起微生物变异的最主要因素为土壤全磷。
关键词:东北红豆杉;高通量测序;土壤养分;土壤微生物;细菌多样性
中图分类号:S714.5 文献标识码:A 文章编号:1006-8023(2022)03-0026-06
Study on Soil Bacterial Diversity of Natural Taxus cuspidata Forest
JIA Dan, WANG Qiyao, XIAO Yufei, LIU Yulong, LIANG Suyu
(Heilongjiang Institute of Ecology, Harbin 150081, China)
Abstract:In this study, high throughput sequencing was used to study the bacterial diversity in rhizosphere soil and non rhizosphere soil of Taxus cuspidata forest at different ages, and the contents of soil nutrients (total organic matter, total nitrogen, total phosphorus and total potassium) were determined. Through the study of soil bacterial diversity and the relationship between soil bacterial diversity and soil nutrients, the structure of rhizosphere soil and non rhizosphere soil microorganisms in Taxus cuspidata forest and the impact of soil nutrient factors on soil microbial diversity were obtained, so as to provide theoretical support for the protection of natural Taxus cuspidata. The results showed that there were significant differences in soil fertility in different forest ages and in rhizosphere soil and non rhizosphere soil of Taxus cuspidata forest (P<0.05). There were 44 phyla in the experimental area, and the dominant phyla were Proteobacteria (relative abundance: 40.54%-43.89%) and Acidobacteria (relative abundance:16.53%-28.81%). There was high correlation between soil total phosphorus and bacteria. The soil total phosphorus could explain 30.46% of bacterial variation rate in all plots. The main bacterial phyla in the mature forest sample plot were Proteobacteria, Firmicutes, Bacteroidetes, Gemmatimonadetes, Chloroflexi, Rokubacteria and Nitrospirae. The contents of total organic matter, total phosphorus, total nitrogen and total potassium were dominant in mature forest plots. The bacterial diversity in rhizosphere soil of Taxus cuspidata was lower than that in non rhizosphere soil. The contribution rate of rhizosphere soil bacteria to soil bacterial variation was the largest. The main factor causing microbial variation was soil total phosphorus.532E945A-892D-40FE-9AAE-7ACC3F1AA1F0
Keywords:Taxus cuspidata; high throughput sequencing; soil nutrient; soil microorganism; bacterial diversity
0 引言
土壤细菌是土壤的重要组成部分,可以分解土壤中的有机质,从而促进土壤的养分循环[1],对植物生长产生比较大的影响 [2-6]。森林的演替是植物和土壤细菌多样性变化的主要原因之一[7],有研究表明,植物根际细菌与植物的生长发育等方面有着紧密联系[8],而土壤化学性质是驱动土壤细菌变异的最主要因子[9]。土壤微生物多样性的稳定有利于森林生态系统维持多样性和稳定性[10-11]。近年来,高通量测序技术凭借着快速、高效和覆盖性高等优点逐步成为研究微生物多样性的手段[12],通过该技术的使用,使得森林土壤微生物多样性的研究取得了较大的进步[13-14]。
东北红豆杉(Taxus cuspidata)是我国一级保护植物,有着较高的科研价值。但是,随着全球气候变化、人为干扰[15]和土壤环境改变[16-17]等因素的影响,天然东北红豆杉林的面积正在进一步缩小。本项研究分别提取3种类型(成熟林、中龄林及枯立木)东北红豆杉根际土壤与非根际土壤总DNA,通过高通量测序的方法得到东北红豆杉土壤细菌的多样性信息。同时测定土壤总有机质、全氮、全磷和全钾的含量,结合高通量测序结果分析土壤细菌多样性与土壤肥力的关系,以期对保护天然东北红豆杉方面提供理论基础。
1 材料与方法
1.1 研究地概况
样地位于黑龙江省牡丹江市穆棱红豆杉自然保护区(130°18′E,43°53′N)内,该地区多为丘陵地带,土壤以暗棕壤为主,年平均气温3.1 ℃,年平均降水量510~560 mm。研究共设置3块样地,分别为红豆杉成熟林(A)、红豆杉中龄林(B)及病腐木对照林(C)。3块样地的面积均为400 m2,样地坡向均为北坡,平均坡度为5°,郁闭度为0.6~0.8。伴生树种为蒙古栎(Quercus mongolica Fisch. ex Ledeb)、臭冷杉(Abies nephrolepis (Trautv.) Maxim)、楓桦(Betula costata Trautv)和椴树(Tilia tuan Szyszyl)等,灌木以簇毛槭(Acer barbinerve Maxim)、长白忍冬(Lonicera ruprechtiana Regel)、溲疏(Deutzia scabra Thunb)、茶藨子(Ribes janczewskii Pojark)和鼠李(Rhamnus davurica Pall)为主。
1.2 土壤样本的采集
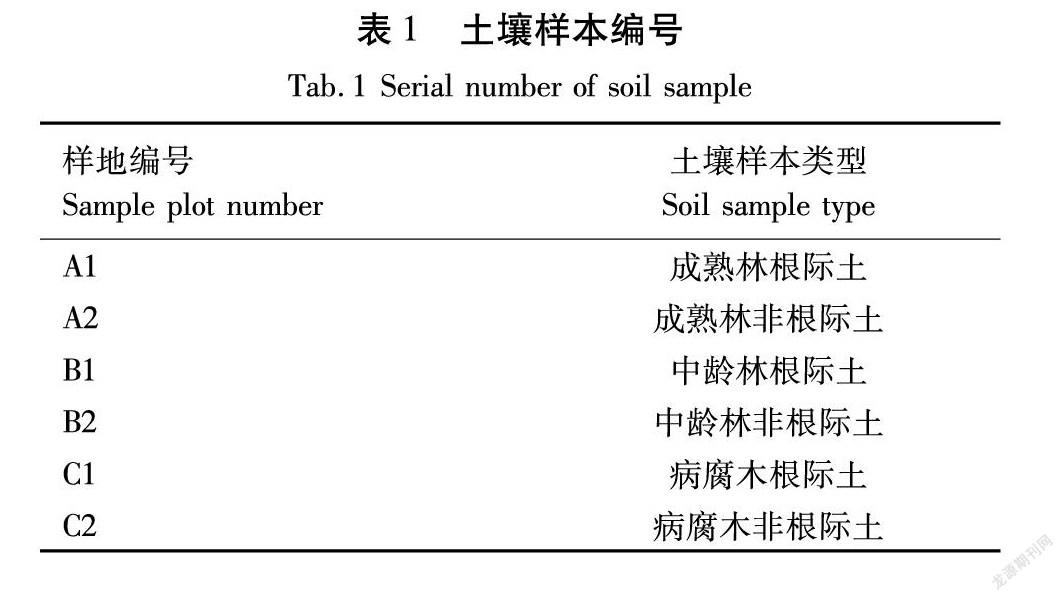
土壤样本分为根际土壤和非根际土壤。根际土壤样本的取样方法为:选取样地内所有红豆杉作为对象,利用花匠铲挖出根部,再收集根部土壤,每株红豆杉取5个平行样进行混合,每个样地共取3株红豆杉根际土作为一组。非根际土壤样本则是在样地内按“Z”字形进行取样,共取7个点混合后为一个平行样,每个样地共取3个平行样,土壤样本编号见表1。
将每个土壤样本平均分为2份,一份装入无菌自封袋中,风干后保存;另一份装入无菌离心管中,置于干冰中低温保存,尽快带回实验室放入-80 ℃冰箱中保存。
1.3 实验方法
将风干的土壤过2 mm筛后,测定土壤养分。土壤总有机质(SOM)利用碳氮分析仪(德国耶拿分析仪器股份公司,型号为Multi N/C 2100)进行测定;土壤全氮(TN)利用凯氏定氮仪(山东海能科学仪器有限公司, 型号为K9860)进行测定;土壤全钾(TK)利用原子吸收光谱(赛默飞世尔科技有限公司,型号为ICE3300)进行测定;土壤全磷(TP)利用比色法进行测定[18]。
称取5 g低温保存的土壤,利用土壤DNA提取试剂盒(美国MO BIO公司,型号为PowerSoilDNA Isolation Kit)提取土壤总DNA,再利用引物27F与1 492 R扩增细菌的V3+V4区,得到原始数据(Raw Data),再将原始数据进行拼接、过滤和质控等步骤得到样本的操作分类单元(operational taxonomic unit,OTU)信息。利用OTU信息来注释物种和后续的多样性分析[19]。
1.4 数据的统计与分析
文中的方差分析、相关性分析、主成分分析(Principal Component Analysis,PCA)等利用IBM SPSS软件进行统计分析,Alpha多样性指数和冗余分析利用R语言软件中的Vegan扩展包进行分析,UniFrac距离利用FastTree软件进行运算[18]。
2 结果与分析
2.1 土壤养分含量的测定
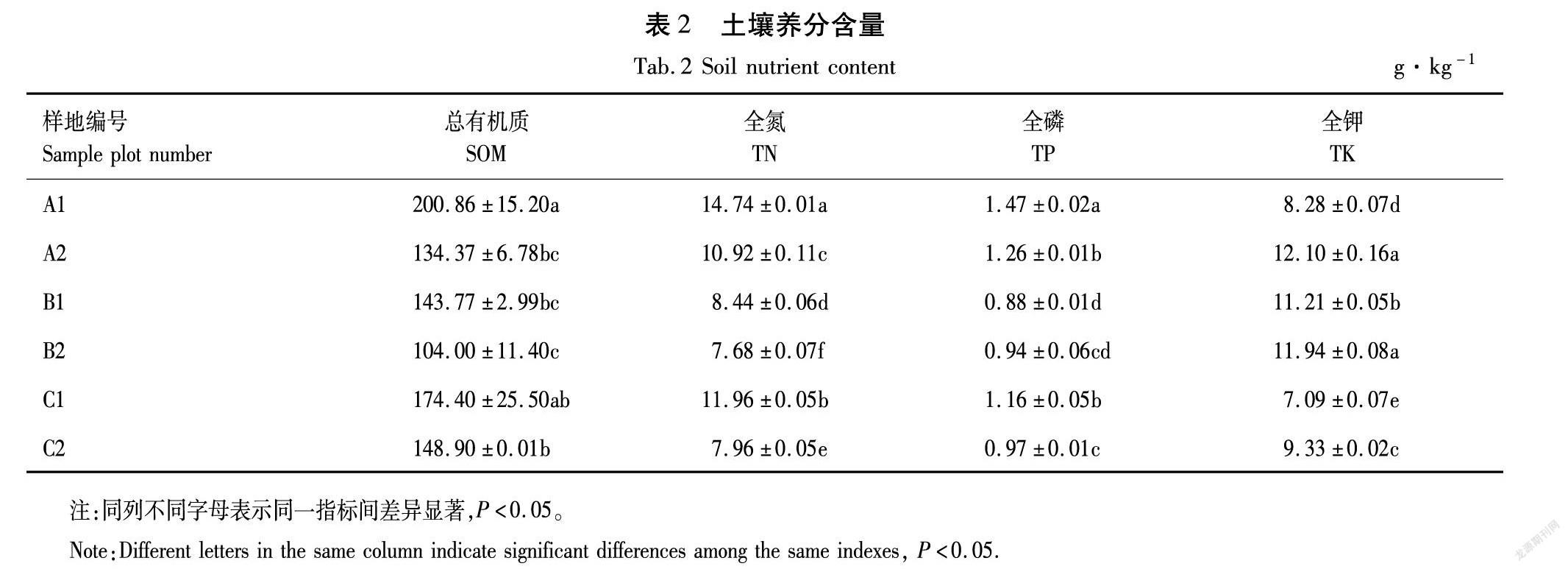
测定风干土壤的总有机质、全氮、全磷和全钾的含量,结果见表2。
由表2可知,6个样本中的土壤化学性质之间的差异较大,其中土壤总有机质含量大小为:A1>C1>C2>B1>A2>B2;全氮含量的大小为:A1>C1>A2>B1>C2>B2;全磷含量大小为:A1>A2>C1>C2>B2>B1;全钾含量大小为:A2>B2>B1>C2>A1>C1。从测试结果来看,成熟林根际土壤的总有机质、全氮和全磷的含量最高,而全钾含量较低。中龄林的非根际土的总有机质和全氮的含量最低。
2.2 土壤细菌OTU分析
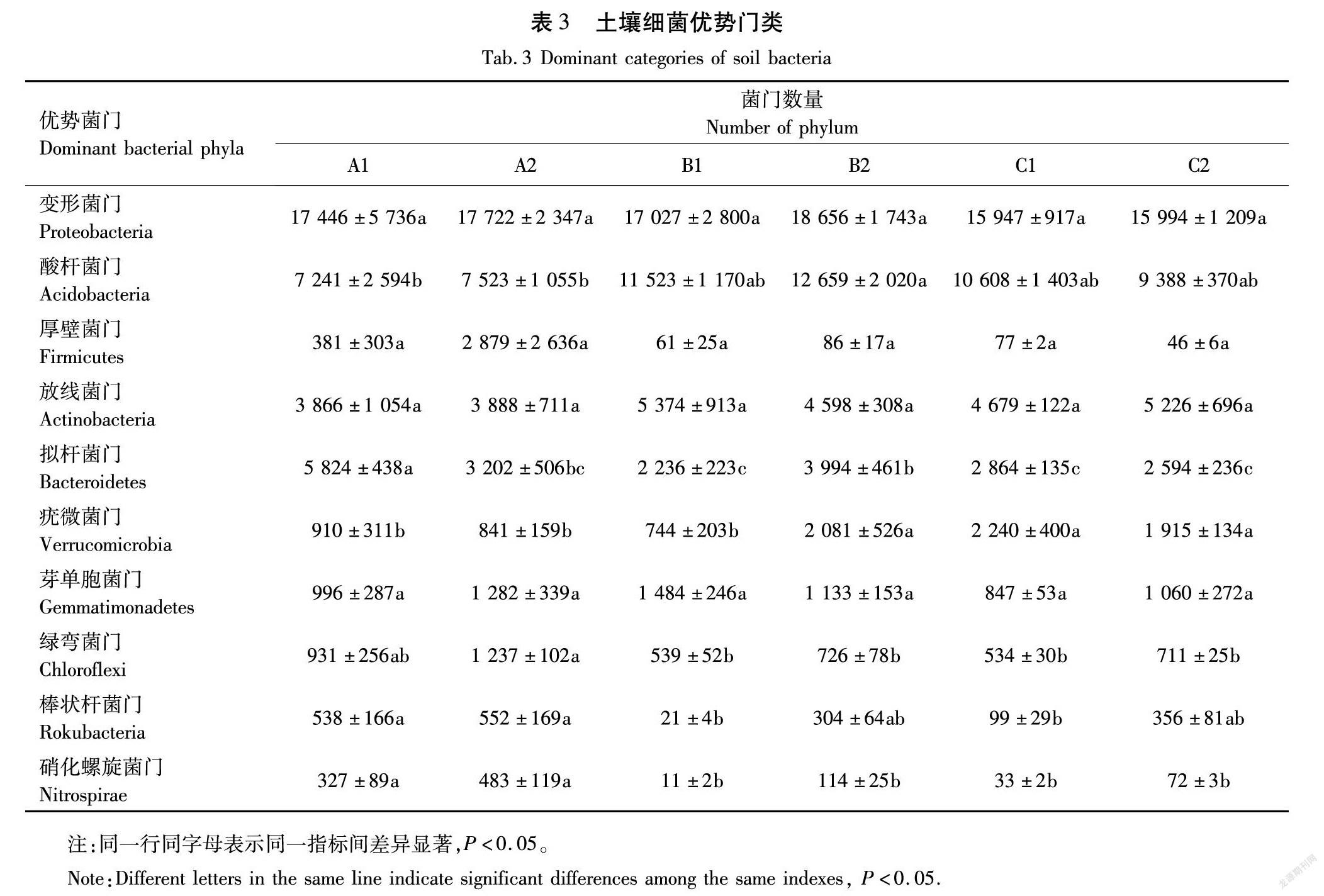
将测序得到的OTU结果进行对比后,得到了土壤细菌的物种信息,本研究共得到44个细菌菌门,其中相对丰度前10位的菌门占总体的96%以上,为优势菌门,结果见表3。
由表3可知,样地内丰度前10位的细菌菌门为:变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)、棒状杆菌门(Rokubacteria)、硝化螺旋菌门(Nitrospirae)。所有样地中,变形菌门、厚壁菌门、放线菌门和芽单胞菌门4个菌门差异不显著,其余菌门差异显著(P<0.05)。丰度第二的酸杆菌门在红豆杉成熟林中的数量明显低于其他两块样地。成熟林根际土壤的拟杆菌门数量远高于其他样地。B2、C1和C2土壤样本中的疣微菌门数量高于A1、A2和B1。A2中绿弯菌门数量最多,C1中最少。棒状杆菌门在A1中数量最多,B1中数量最少。硝化螺旋菌门在A2中最多,B1中数量最少。532E945A-892D-40FE-9AAE-7ACC3F1AA1F0
2.3 土壤养分与细菌门相关性分析
为了研究土壤养分与土壤细菌的相关性,将土壤养分含量与相对丰度前10位的菌门进行相关性分析,具体结果见表4。
由表4可知,土壤全磷与拟杆菌门呈极显著正相关,与绿弯菌门、棒状杆菌门和硝化螺旋菌门呈显著正相关。土壤全氮含量与拟杆菌门呈极显著正相关。
2.4 土壤细菌Alpha多样性指数分析
Alpha多样性指数分析又称组内分析,是分析每个样本内土壤细菌多样性的一种方法。本研究共选择物种检出数量(observed species)、Shannon多样性指数、Chao1多样性指数、ACE多样性指数和覆盖度(goods coverage)5个指标进行分析,结果见表5。
由表5可知,检出物种数量由高到低顺序为:B2>C2>A2>A1>C1>B1。Shannon指数顺序为:B2>A2>C2>A1>C1>B1。Chao1指数为:B2>C2>A1>C1>A2>B1。ACE指数为:B2>C2>A1>C1>A2>B1。其中B2样本中无论是检出物种的数量还是多样性指数均为最高,B1则为最低。在A组和C组也得到相同的结论,即根际土壤细菌多样性均低于非根际土壤细菌多样性。
2.5 土壤细菌Beta组间分析
Beta组间分析,目的是分析各样本之间细菌多样性的差异。本研究选用PCA对6个样本细菌多样性进行分析,结果如图1所示。
由图1可知,第一主成分B1、C1和B2与其余样地区分开来(在第一主成分上的贡献值为正),B1在第一主成分上的贡献率最大。B2、C2和C1在第二成分上的贡献率为正,且B2的贡献率最大。所有样地共同解释细菌变异率的30.46%,6个样本中C1对细菌变异率的贡献最大。
由图2可知,6个样本中的土壤细菌在门水平上分为兩大类,即A1与A2在遗传距离为0.118 0处聚成一类,其余4个样本聚成一类,两大类的遗传距离为0.089 0。其中,B2与C1遗传距离最小为0.048 9,C2与C1、B2的遗传距离为0.001 0。B2、C1、C2与B1的遗传距离为0.045 1。
2.6 土壤养分与土壤细菌冗余分析
为了研究土壤细菌受土壤养分的影响,将丰度前10的土壤细菌门与土壤养分进行冗余分析(redundancy analysis, RDA),结果如图3所示。
由图3可知,变形菌门、厚壁菌门、拟杆菌门、芽单胞菌门、绿弯菌门、棒状杆菌门和硝化螺旋菌门与A1和A2的相关性较高,而酸杆菌门、放线菌门和疣微菌门与其余样本的相关性更高。
土壤总有机质、土壤全氮、土壤全磷和土壤全钾均在A样地内起主导作用,且引起微生物变异的最主要因素为土壤全磷,土壤总有机质的影响最小。
3 讨论
本研究表明,天然红豆杉林地内土壤细菌丰度最高的2个门为变形菌门和酸杆菌门,这与以往的相关研究报道一致[18, 20],这主要是因为变形菌门和酸杆菌门的生态位较高,且这2个菌门的细菌都有较高的环境适应性[21-22]。由PCA和聚类分析结果可知,A样地与其他两块样地的土壤微生物亲缘关系较远,结合Alpha分析可以得到成熟林样地内土壤细菌构成与中龄林差距较大,这与李萍等[23]的研究结果一致。
范媛媛等[24]研究表明,针叶树种成熟林地内土壤养分高于中龄林,这与本研究的结果一致,这是因为土壤养分会随着枯落物的增加而增加,而成熟林的枯落物要高于中龄林[25-26]。曹升等[27]研究表明,不同林龄的土壤微生物的差别较大,成熟林土壤细菌是土壤微生物变异的最主要因素,这与本研究的结果一致。
RDA结果表明,全磷是驱动细菌变异的最主要因素,主要由于本研究土壤优势菌门为变形菌门,而变形菌门是分解有机质的主要细菌[20],土壤全磷与细菌优势菌门的相关性较高 [28]。这与姜雪薇等[28] 的研究结果一致。
4 结论
本文利用高通量测序方法研究了天然东北红豆杉林地土壤微生物的多样性,同时测定了土壤养分含量,将所得到的结果进行分析得到了如下结论。
(1)根据Alpha多样性分析的结果表明,天然东北红豆杉根际土壤细菌多样性丰度低于非根际土壤。
(2)PCA分析的结果表明,病腐木根际土壤细菌对土壤细菌变异的贡献率最大。
(3)由RDA的结果可以得到土壤全磷含量是引起土壤细菌变异的主要因素,且相关性分析结果也证明土壤全磷含量与某些细菌的相关性较高。
【参 考 文 献】
[1]NAKAYAMA M, IMAMURA S, TANIGUCHI T, et al. Does conversion from natural forest to plantation affect fungal and bacterial biodiversity, community structure, and co-occurrence networks in the organic horizon and mineral soil? [J]. Forest Ecology and Management, 2019, 446: 238-250.
[2]SHEN R C, XU M, LI R Q, et al. Spatial variability of soil microbial biomass and its relationships with edaphic, vegetational and climatic factors in the Three-River Headwaters region on Qinghai-Tibetan Plateau[J]. Applied Soil Ecology, 2015, 95: 191-203.532E945A-892D-40FE-9AAE-7ACC3F1AA1F0
[3]ZHANG T, LI Y F, CHANG S X, et al. Converting paddy fields to Lei bamboo (Phyllostachys praecox) stands affected soil nutrient concentrations, labile organic carbon pools, and organic carbon chemical compositions[J]. Plant and Soil, 2013, 367(1/2): 249-261.
[4]ANDERSSON K O, TIGHE M K, GUPPY C N, et al. Incremental acidification reveals phosphorus release dynamics in alkaline vertic soils[J]. Geoderma, 2015, 259/260: 35-44.
[5]MARTIN M, STANCHI S, JAKEER HOSSAIN K M, et al. Potential phosphorus and arsenic mobilization from Bangladesh soils by particle dispersion[J]. Science of the Total Environment, 2015, 536: 973-980.
[6]TIAN K, ZHAO Y C, XU X H, et al. Effects of long-term fertilization and residue management on soil organic carbon changes in paddy soils of China: a meta-analysis[J]. Agriculture, Ecosystems & Environment, 2015, 204: 40-50.
[7]賈丹, 王刚, 王文帆, 等. 利用RAPD技术对牡丹江地区红松根际土壤微生物多样性的分析[J]. 森林工程, 2013, 29(6): 33-35, 61.
JIA D, WANG G, WANG W F, et al. Analysis of Korean pine rhizosphere soil microorganism diversity in Mudanjiang area by using RAPD technique[J]. Forest Engineering, 2013, 29(6): 33-35, 61.
[8]BERENDSEN R L, PIETERSE C M J, BAKKER P A H M. The rhizosphere microbiome and plant health[J]. Trends in Plant Science, 2012, 17(8): 478-486.
[9]马转转, 乔沙沙, 曹苗文, 等. 环境选择和扩散限制驱动温带森林土壤细菌群落的构建[J]. 应用生态学报, 2018, 29(4): 1179-1189.
MA Z Z, QIAO S S, CAO M W, et al. Environmental selection and dispersal limitation drive the assemblage of bacterial community in temperate forest soils[J]. Chinese Journal of Applied Ecology, 2018, 29(4): 1179-1189.
[10]李明美, 全飞, 孙树晴, 等. 近自然管理对橡胶林土壤细菌组成及多样性的影响[J]. 西部林业科学, 2021, 50(5): 81-89.
LI M M, QUAN F, SUN S Q, et al. The effect of close-to-natural management on soil bacteria in rubber plantations[J]. Journal of West China Forestry Science, 2021, 50(5): 81-89.
[11]DENG H, GUO G X, ZHU Y G. Pyrene effects on methanotroph community and methane oxidation rate, tested by dose-response experiment and resistance and resilience experiment[J]. Journal of Soils and Sediments, 2011, 11(2): 312-321.
[12]QUAIL M A, KOZAREWA I, SMITH F, et al. A large genome centers improvements to the Illumina sequencing system[J]. Nature Methods, 2008, 5 (12): 1005-1010.
[13]LEPLEUX C, UROZ S, COLLIGNON C, et al. A short-term mineral amendment impacts the mineral weathering bacterial communities in an acidic forest soil[J]. Research in Microbiology, 2013, 164(7): 729-739.532E945A-892D-40FE-9AAE-7ACC3F1AA1F0
[14]HARTMANN M, HOWES C G, VANINSBERGHE D, et al. Significant and persistent impact of timber harvesting on soil microbial communities in Northern coniferous forests[J]. The ISME Journal, 2012, 6 (12): 2199-2218.
[15]ZU Y G, CHEN H F, WANG W J, et al. Population structure and distribution pattern of Taxus cuspidata in Muling region of Heilongjiang Province, China[J]. Journal of Forestry Research, 2006, 17(1): 80-82.
[16]陳杰,龙婷,杨蓝,等.东北红豆杉生境适宜性评价[J].北京林业大学学报,2019,41(4):51-59.
CHEN J, LONG T, YANG L, et al. Habitat suitability assessment of Taxus cuspidate[J]. Journal of Beijing Forestry University, 2019, 41(4): 51-59.
[17]姜泉.红豆杉种子育苗技术研究[J].林业科技情报,2021,53(4):78-80.
JIANG Q. Study on seed seedling raising technology of Taxus Linn.[J]. Forestry Science and Technology Information, 2021, 53(4): 78-80.
[18]JIA D, DONG X B, LI Y H. Effect of strip harvesting on bacterial diversity of forest soils in the Daxingan Mountains[J]. Soil Science Society of America Journal, 2020, 84(2): 512-521.
[19]ADAMS R I, MILETTO M, TAYLOR J W, et al. Dispersal in microbes: fungi in indoor air are dominated by outdoor air and show dispersal limitation at short distances[J]. The ISME Journal, 2013, 7 (7): 1262-1273.
[20]乔沙沙,周永娜,刘晋仙,等.关帝山针叶林土壤细菌群落结构特征[J].林业科学,2017,53(2):89-99.
QIAO S S, ZHOU Y N, LIU J X, et al. Characteristics of soil bacterial community structure in coniferous forests of guandi mountains, Shanxi Province[J]. Scientia Silvae Sinicae, 2017, 53(2): 89-99.
[21]范雅倩,安菁,梁晨.北京市松山国家级自然保护区典型植被群落的土壤微生物群落结构特征[J].北方园艺,2021(1):81-86.
FAN Y Q, AN J, LIANG C. Soil microbial structure characteristics of typical vegetation communities in Beijing City Songshan national nature reserve[J]. Northern Horticulture, 2021(1): 81-86.
[22]唐靓茹,刘雄盛,蒋燚,等.红锥 4 种林型土壤理化性质及微生物量差异分析 [J].中南林业科技大学学报,2020, 40(1):76-81, 104.
TANG J R, LIU X S, JIANG Y, et al. Analysis on difference of soil physical and chemical properties and microorganism quantity in four types Castanopsis hystrix forest[J]. Journal of Central South University of Forestry & Technology, 2020, 40(1):76-81, 104.
[23]李萍,史荣久,赵峰,等.大兴安岭落叶松林不同演替阶段土壤细菌群落结构与功能潜势[J].应用生态学报,2019,30(1):95-107.
LI P, SHI R J, ZHAO F, et al. Soil bacterial community structure and predicted functions in the larch forest during succession at the Greater Khingan Mountains of Northeast China[J]. Chinese Journal of Applied Ecology, 2019, 30(1): 95-107.532E945A-892D-40FE-9AAE-7ACC3F1AA1F0
[24]范媛媛,李懿,李启迪.不同林龄油松土壤微生物、酶活性和养分特征[J].水土保持研究,2019,26(6):58-64.
FAN Y Y, LI Y, LI Q D. Microbe, enzymatic activity and nutrient contents of soils in different stand ages of Pinus tabuliformis[J]. Research of Soil and Water Conservation, 2019, 26(6): 58-64.
[25]DALY K R, MOONEY S J, BENNETT M J, et al. Assessing the influence of the rhizosphere on soil hydraulic properties using X-ray computed tomography and numerical modelling[J]. Journal of Experimental Botany, 2015, 66(8): 2305-2314.
[26]LI H, YANG X R, WENG B S, et al. The phenological stage of rice growth determines anaerobic ammonium oxidation activity in rhizosphere soil[J]. Soil Biology and Biochemistry, 2016, 100: 59-65.
[27]曹升,潘菲,林根根,等.不同林龄杉木林土壤细菌群落结构与土壤酶活性变化研究[J].生态学报,2021,41(5):1846-1856.
CAO S, PAN F, LIN G G, et al. Changes of soil bacterial structure and soil enzyme activity in Chinese fir forest of different ages[J]. Acta Ecologica Sinica, 2021, 41(5): 1846-1856.
[28]姜雪薇,馬大龙,臧淑英,等.高通量测序分析大兴安岭典型森林土壤细菌和真菌群落特征[J].微生物学通报,2021,48(4):1093-1105.
JIANG X W, MA D L, ZANG S Y, et al. Characteristics of soil bacterial and fungal community of typical forest in the Greater Khingan Mountains based on high-throughput sequencing[J]. Microbiology China, 2021, 48(4): 1093-1105.532E945A-892D-40FE-9AAE-7ACC3F1AA1F0
